Bài 1.53 Trang 11 SBT Hóa 10 Nâng Cao: Nguyên Tử N Có Z = 7, Lớp ...
Có thể bạn quan tâm
 Trang chủ Lớp 10 SBT Hóa học 10 Nâng cao (sách cũ) Bài 1.53 trang 11 SBT Hóa 10 nâng cao: Nguyên tử N... Bài 1.53 trang 11 Sách bài tập (SBT) Hóa học 10 Nâng cao. Hãy giải thích sự sắp xếp các electron vào các obitan trong nguyên tử nitơ (Z = 7) để minh họa cho các nguyên lí vững. Bài 7: Năng lượng của các electron trong nguyên tử. Cấu hình electron nguyên tử
Trang chủ Lớp 10 SBT Hóa học 10 Nâng cao (sách cũ) Bài 1.53 trang 11 SBT Hóa 10 nâng cao: Nguyên tử N... Bài 1.53 trang 11 Sách bài tập (SBT) Hóa học 10 Nâng cao. Hãy giải thích sự sắp xếp các electron vào các obitan trong nguyên tử nitơ (Z = 7) để minh họa cho các nguyên lí vững. Bài 7: Năng lượng của các electron trong nguyên tử. Cấu hình electron nguyên tử Bài 1.53 trang 11 SBT Hóa học 10 Nâng cao
Hãy giải thích sự sắp xếp các electron vào các obitan trong nguyên tử nitơ (Z = 7) để minh họa cho các nguyên lí vững bền, nguyên lí Pau-li và quy tắc Hun.

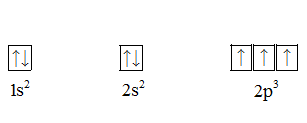
Nguyên tử N có Z = 7, lớp vỏ nguyên tử có 7 electron được phân bố vào các obitan theo thứ tự tăng dần các mức năng lượng (theo nguyên lí vững bền): 1s, 2s và 2p.
- Electron đầu tiên được xếp vào obitan 1s. Electron thứ hai có thể ghép đôi hay xếp vào phân lớp 2p. Do năng lượng ghép đôi bé hơn so với chênh lệch năng lượng giữa lớp 1 và lớp 2 nên electron thứ hai sẽ xếp vào obitan 1s, lúc đó hai electron được cặp đôi. Ta có kí hiệu 1s2 chỉ hai electron đã cặp đôi trên 1 obitan 1s.
Advertisements (Quảng cáo)
- Electron thứ 3 không được xếp vào cùng obitan 1s với hai electron sẵn có (nguyên lí Pau – li) mà xếp vào phân lớp 2s. Ta có kí hiệu 2s1 cho biết rằng có 1 electron trên obitan này. Electron thứ 4 sẽ xếp vào phân lớp 2s do năng lượng của phân lớp 2s bé hơn so với 2p. Ta có kí hiệu 2s2 chỉ ra rằng không có electron độc thân nào trên obitan này.
- Electron thứ 5, 6 và 7 sẽ xếp vào phân lớp 2p với 3 obitan giống nhau hoàn toàn. Ba electron được phân bố vào 3 obitan 2p nên mỗi obitan có 1 electron (quy tắc Hun). Cấu hình electron nguyên tử của nguyên tố nitơ là:
Bạn đang xem bài tập, chương trình học môn SBT Hóa học 10 Nâng cao (sách cũ). Vui lòng chọn môn học sách mới cần xem dưới đây:
- Hóa lớp 10 - Kết nối tri thức
- Hóa lớp 10 - Cánh diều
- Hóa lớp 10 - Chân trời sáng tạo
- SBT Hóa 10 - Kết nối tri thức
- SBT Hóa 10 - Chân trời sáng tạo
- SBT Hóa 10 - Cánh diều
- Môn học khác Lớp 10
Advertisements (Quảng cáo)
Danh sách bài tập
Bài 1.61 trang 12 SBT Hóa 10 nâng cao: 2s1; Bài 1.58, 1.60 trang 11, 12 SBT Hóa 10 nâng cao: Cấu hình electron lớp ngoài cùng của nguyên tử nguyên tố X được... Bài 1.57 trang 11 Sách bài tập (SBT) Hóa học 10 Nâng cao: 2, 2; Bài 1.55 trang 11 SBT Hóa lớp 10 nâng cao: Cấu hình electron là sự phân bố các electron theo từng lớp và phân... Bài 1.56 trang 11 Sách bài tập Hóa 10 nâng cao: Viết cấu hình electron nguyên tử của các nguyên tố sau: Bài 1.54 trang 11 SBT Hóa 10 nâng cao: Việc xếp các electron vào các ô lượng tử là thao tác để xem xét... Chọn lớp học Lớp 1 Lớp 2 Lớp 3 Lớp 4 Lớp 5 Lớp 6 Lớp 7 Lớp 8 Lớp 9 Lớp 10 Lớp 11 Lớp 12Mới cập nhật
Bài 28. Phát triển kinh tế và đảm bảo an ninh quốc phòng ở Biển Đông và các đảo, quần đảo trang 75, 76,... Biển Đông nằm ở phía tây của Thái Bình Dương. Giải Câu 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12,... Bài 27. Phát triển các vùng kinh tế trọng điểm trang 73, 74 SBT Địa lý 12 Cánh diều: Các vùng kinh tế trọng... Đặc điểm chung của các vùng kinh tế trọng điểm là bao gồm nhiều tỉnh, thành phố; có ranh giới, có thể thay đổi... Bài 25. Sử dụng hợp lý tự nhiên để phát triển kinh tế ở Đồng bằng sông Cửu Long trang 69, 70, 71 SBT... Đồng bằng sông Cửu Long chỉ giáp với Đông Nam Bộ. Giải Câu 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11,... Bài 24. Phát triển kinh tế – xã hội ở Đông Nam Bộ trang 65, 66, 67 SBT Địa lý 12 Cánh diều: Đặc... Đông Nam Bộ không có biên giới giáp với Lào. Phân tích và lời giải Câu 1, 2, 3, 4, 5, 6, 7, 8,... Bài 23. Khai thác thế mạnh để phát triển kinh tế ở Tây Nguyên trang 61, 62, 63 SBT Địa lý 12 Cánh diều:... Vị trí Địa Lí của vùng Tây Nguyên nằm trong nội địa, có biên giới với Lào và Cam-pu-chia. Giải Câu 1, 2, 3,... Bài 22. Phát triển kinh tế biển ở Duyên hải Nam Trung Bộ trang 58, 59, 60 SBT Địa lý 12 Cánh diều: Đặc... Duyên hải Nam Trung Bộ có vị trí trung gian giữa bắc - nam, giữa vùng Tây Nguyên và Biển Đông. Trả lời Câu... © Copyright 2017 - BaitapSGK.comTừ khóa » Số Electron ở Lớp Ngoài Cùng Trong Nguyên Tử N (z = 7) Là
-
Hãy Viết Cấu Hình Electron Của Các Nguyên Tử N (Z=7) - Hoc24
-
Số Electron Hóa Trị Của Nguyên Tử Có Số Hiệu Nguyên Tử Z = 7 Là :
-
Ở Trạng Thái Cơ Bản,cấu Hình Electron Nguyên Tử Nitơ (Z = 7) Có
-
Lớp Vỏ Nguyên Tử Nitơ (Z = 7) Có Bao Nhiêu Electron Lớp Ngoài Cùng
-
Số Electron ở Lớp Ngoài Cùng Trong Nguyên Tử N Z = 7 Là
-
Cho N (Z = 7). Cấu Hình Electron Của Nitơ Là?
-
Ở Trạng Thái Cơ Bản,cấu Hình Electron Nguyên Tử Nitơ (Z = 7) Có...
-
Cấu Hình Electron Nguyên Tử Của Nitơ Có Z=7 Là - Hoc247
-
Nguyên Tử Nitơ Z 7 Có Số Lớp Electron Số Electron Lớp Ngoài Cùng Lần ...
-
Cấu Hình Electron Lớp Ngoài Cùng Của Nguyên Tố Nitơ Z 7 Là
-
Cho Nguyên Tử Nitơ (Z = 7 Xác định Số Proton Và Số Electron Của ...
-
Cấu Hình Electron Lớp Ngoài Cùng Của Nguyên Tố N Z 7 - Blog Của Thư
-
Ở Trạng Thái Cơ Bản, Cấu Hình Electron Nguyên Tử Nitơ (Z = 7) Có Bao ...
-
Giải Sách Bài Tập Hóa Học 10 - Bài 5: Cấu Hình Electron