Bài 5. Cấu Hình Electron Nguyên Tử - Củng Cố Kiến Thức
I. THỨ TỰ CÁC MỨC NĂNG LƯỢNG TRONG NGUYÊN TỬ
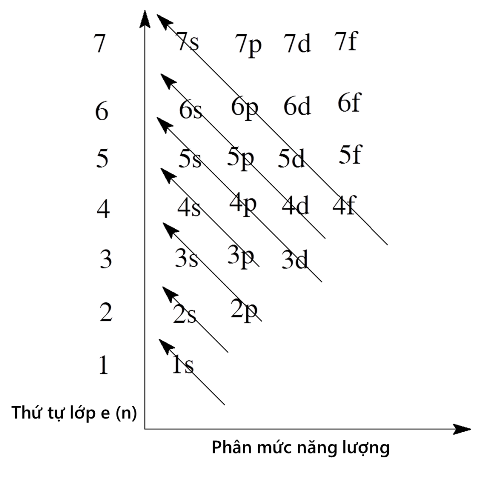 - Các electron sắp vào các lớp và phân lớp từ mức năng lượng thấp đến mức năng lượng cao theo thứ tự sau: $1s\,\,\,2s\,\,\,2p\,\,\,3s\,\,\,3p\,\,\,4s\,\,\,3d\,\,\,4p\,\,\,5s\,\,\,4d\,\,\,5p\,\,\,6s\,\,\,4f\,\,\,5d\,…$
- Các electron sắp vào các lớp và phân lớp từ mức năng lượng thấp đến mức năng lượng cao theo thứ tự sau: $1s\,\,\,2s\,\,\,2p\,\,\,3s\,\,\,3p\,\,\,4s\,\,\,3d\,\,\,4p\,\,\,5s\,\,\,4d\,\,\,5p\,\,\,6s\,\,\,4f\,\,\,5d\,…$
- Khi điện tích hạt nhân tăng, có sự chèn mức năng lượng nên mức năng lượng của $4s$ thấp hơn $3d$.
II. CẤU HÌNH ELECTRON NGUYÊNTỬ
1. Cấu hình electron nguyên tử
- Cấu hình electron nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
a) Quy ước cách viết cấu hình electron nguyên tử
- Số thứ tự lớp electron được ghi bằng chữ số ($1,\,\,2,\,\,3…$).
- Phân lớp được ghi bằng các chữ cái thường ($s,\,\,p,\,\,d,\,\,f$).
- Số electron trong một phân lớp được ghi bằng chỉ số ở phía trên bên phải kí hiệu của phân lớp (${s^2},\,\,{p^6}…$).
b) Cách viết cấu hình electron nguyên tử
- Xác định số electron trong nguyên tử.
- Phân bố các electron theo thứ tự tăng dần mức năng lượng theo quy tắc sau:
+ Lớp electron tăng dần ($n = 1,\,\,2,\,\,3…$).
+ Trong cùng một lớp theo thứ tự: $s,\,\,p,\,\,d,\,\,f$.
c) Ví dụ cấu hình electron của các nguyên tử
${}_{1}H: 1{s^1}$
${}_{2}He: 1{s^2}$
${}_{8}O: 1{s^2}\,\,2{s^2}\,\,2{p^4}$ hoặc viết gọn là $[He]\,\,2{s^2}\,\,2{p^4}$
${}_{18}Ar: 1{s^2}\,\,2{s^2}\,\,2{p^6}\,\,3{s^2}\,\,3{p^6}$
${}_{20}Ca: 1{s^2}\,\,2{s^2}\,\,2{p^6}\,\,3{s^2}\,\,3{p^6}\,\,4{s^2}$ hoặc viết gọn là $[Ar]\,\,4{s^2}$
${}_{35}Br: 1{s^2}\,\,2{s^2}\,\,2{p^6}\,\,3{s^2}\,\,3{p^6}\,\,3{d^{10}}\,\,4{s^2}\,\,4{p^5}$ hoặc viết gọn là $[Ar]\,\,3{d^{10}}\,\,4{s^2}\,\,4{p^5}$
d) Phân lớp cuối cùng là họ của nguyên tố
- $H,\,He,\,Ca$: là nguyên tố $s$ vì electron cuối cùng điền vào phân lớp $s$.
- $O,\,Ar,\,Br$: là nguyên tố $p$ vì electron cuối cùng điền vào phân lớp $p$.
- Ngoài ra còn có nguyên tố $d$, nguyên tố $f$.
2. Cấu hình electron nguyên tử của 20 nguyên tố đầu
| $Z$ | Tên nguyên tố | Kí hiệu hóa học |
| Cấu hình electron của nguyên tử | ||||||
| $1$ | Hiđro | $H$ |
| $1{s^1}$ | ||||||
| $2$ | Heli | $He$ |
| $1{s^2}$ | ||||||
| $3$ | Liti | $Li$ |
| $1{s^2}\,\,2{s^1}$ | ||||||
| $4$ | Beri | $Be$ |
| $1{s^2}\,\,2{s^2}$ | ||||||
| $5$ | Bo | $B$ |
| $1{s^2}\,\,2{s^2}\,\,2{p^1}$ | ||||||
| $6$ | Cacbon | $C$ |
| $1{s^2}\,\,2{s^2}\,\,2{p^2}$ | ||||||
| $7$ | Nitơ | $N$ |
| $1{s^2}\,\,2{s^2}\,\,2{p^3}$ | ||||||
| $8$ | Oxi | $O$ |
| $1{s^2}\,\,2{s^2}\,\,2{p^4}$ | ||||||
| $9$ | Flo | $F$ |
| $1{s^2}\,\,2{s^2}\,\,2{p^5}$ | ||||||
| $10$ | Neon | $Ne$ |
| $1{s^2}\,\,2{s^2}\,\,2{p^6}$ | ||||||
| $11$ | Natri | $Na$ |
| $1{s^2}\,\,2{s^2}\,\,2{p^6}\,\,3{s^1}$ | ||||||
| $12$ | Magie | $Mg$ |
| $1{s^2}\,\,2{s^2}\,\,2{p^6}\,\,3{s^2}$ | ||||||
| $13$ | Nhôm | $Al$ |
| $1{s^2}\,\,2{s^2}\,\,2{p^6}\,\,3{s^2}\,\,3{p^1}$ | ||||||
| $14$ | Silic | $Si$ |
| $1{s^2}\,\,2{s^2}\,\,2{p^6}\,\,3{s^2}\,\,3{p^2}$ | ||||||
| $15$ | Photpho | $P$ |
| $1{s^2}\,\,2{s^2}\,\,2{p^6}\,\,3{s^2}\,\,3{p^3}$ | ||||||
| $16$ | Lưu huỳnh | $S$ |
| $1{s^2}\,\,2{s^2}\,\,2{p^6}\,\,3{s^2}\,\,3{p^4}$ | ||||||
| $17$ | Clo | $Cl$ |
| $1{s^2}\,\,2{s^2}\,\,2{p^6}\,\,3{s^2}\,\,3{p^5}$ | ||||||
| $18$ | Agon | $Ar$ |
| $1{s^2}\,\,2{s^2}\,\,2{p^6}\,\,3{s^2}\,\,3{p^6}$ | ||||||
| $19$ | Kali | $K$ |
| $1{s^2}\,\,2{s^2}\,\,2{p^6}\,\,3{s^2}\,\,3{p^6}\,\,4{s^1}$ | ||||||
| $20$ | Canxi | $Ca$ |
| $1{s^2}\,\,2{s^2}\,\,2{p^6}\,\,3{s^2}\,\,3{p^6}\,\,4{s^2}$ |
3. Đặc điểm lớp electron ngoài cùng
- Đối với nguyên tử của tất cả các nguyên tố, lớp electron ngoài cùng có nhiều nhất là $8$ electron.
- Các nguyên tử đều có khuynh hướng đạt trạng thái bão hòa bền với $8$ electron ở lớp ngoài cùng (trừ $He$ có $2\,e$ ngoài cùng).
- Lớp electron ngoài cùng quyết định tính chất hóa học của một nguyên tố:
+ Nếu tổng số electron ngoài cùng $< 4\,\,(1,\,2,\,3\,e)$ $\Rightarrow$ Nguyên tử CHO electron $\Rightarrow$ là kim loại.
+ Nếu tổng số electron ngoài cùng $> 4\,\,(5,\,6,\,7\,e)$ $\Rightarrow$ Nguyên tử NHẬN electron $\Rightarrow$ là phi kim.
+ Nếu tổng số electron ngoài cùng $= 4\,$ $\Rightarrow$ Nguyên tử có thể là kim loại hoặc phi kim.
+ Nếu tổng số electron ngoài cùng $= 8$ (trừ $He$ có $2\,e$ ngoài cùng) $\Rightarrow$ Nguyên tử bền về mặt hóa học $\Rightarrow$ là khí hiếm.
$\Longrightarrow$ Vậy: khi biết cấu hình electron của nguyên tử có thể dự đoán được loại nguyên tố.
Từ khóa » E Cuối Cùng Là Gì
-
Chuyên đề Vai Trò Và ý Nghĩa Của Electron (ngoài Cùng, Cuối Cùng ...
-
Cấu Hình Electron Nguyên Tử - Thầy Phạm Ngọc Dũng Dạy HÓA
-
Cấu Hình Electron – Wikipedia Tiếng Việt
-
Cấu Hình Electron - Hóa
-
Electron Cuối Cùng Của Nguyên Tử Nguyên Tố X Phân Bố Vào Phân ...
-
Electron Cuối Cùng Phân Bố Trong Nguyên Tử X Là 3d8. Số ... - Hoc247
-
Viết Cấu Hình E Của D( Số Electron Cuối Cùng điền Vào Phân Lớp 4s1?
-
Chất Nhận Electron Cuối Cùng Của Quá Trình Quang Hợp Là Gì?
-
Chương 1. Nguyên Tử - Hoc24
-
Giá Trị Cuối Cùng Là Gì? Phân Loại, Cách Tính Terminal Value?
-
Người Tiêu Thụ Cuối Cùng Là Gì? Mô Hình Giải Thích Hành Vi Mua Sắm
-
Toàn Bộ Lý Thuyết Và Cách Viết Cấu Hình Electron Nguyên Tử Dễ Nhớ
-
Lý Thuyết, Cách Viết Cấu Hình Electron Nguyên Tử Và Bài Tập Vận ...