A. Bảng Hệ Thống Hóa: Các Loại Hợp Chất Vô Cơ
Có thể bạn quan tâm
-
-

-
Mầm non
-
Lớp 1
-
Lớp 2
-
Lớp 3
-
Lớp 4
-
Lớp 5
-
Lớp 6
-
Lớp 7
-
Lớp 8
-
Lớp 9
-
Lớp 10
-
Lớp 11
-
Lớp 12
-
Thi vào lớp 6
-
Thi vào lớp 10
-
Thi Tốt Nghiệp THPT
-
Đánh Giá Năng Lực
-
Khóa Học Trực Tuyến
-
Hỏi bài
-
Trắc nghiệm Online
-
Tiếng Anh
-
Thư viện Học liệu
-
Bài tập Cuối tuần
-
Bài tập Hàng ngày
-
Thư viện Đề thi
-
Giáo án - Bài giảng
-
Tất cả danh mục
-
- Mầm non
- Lớp 1
- Lớp 2
- Lớp 3
- Lớp 4
- Lớp 5
- Lớp 6
- Lớp 7
- Lớp 8
- Lớp 9
- Lớp 10
- Lớp 11
- Lớp 12
- Thi Chuyển Cấp
-
- Hôm nay +3
- Ngày 2 +3
- Ngày 3 +3
- Ngày 4 +3
- Ngày 5 +3
- Ngày 6 +3
- Ngày 7 +5
Nâng cấp gói Pro để trải nghiệm website VnDoc.com KHÔNG quảng cáo, và tải file cực nhanh không chờ đợi.
Tìm hiểu thêm » Mua ngay Từ 79.000đ Hỗ trợ ZaloCác loại hợp chất vô cơ lớp 9
- A. Bảng hệ thống hóa: Các loại hợp chất vô cơ
- B. Nội dung chi tiết các hợp chất vô cơ
- C. Sơ đồ mối quan hệ giữa các hợp chất vô cơ
- Những phản ứng hóa học minh họa
- Sơ đồ tư duy hợp chất vô cơ
- D. Bài tập vận dụng nâng cao
- 1. Câu hỏi trắc nghiệm vô cơ
- 2. Đáp án hướng dẫn giải chi tiết
Bảng hệ thống hóa các loại hợp chất vô cơ giúp các bạn học sinh nhớ lại và hệ thống hoá những tính chất hoá học của mỗi loại hợp chất vô cơ đã học trong chương trình Hóa 9. Bên cạnh đó tài liệu còn đưa ra nội dung câu hỏi bài tập, giúp bạn đọc luyện tập, nâng cao kĩ năng giải bài tập.
- Bài tập Hóa học 9 Chương 1: Các hợp chất vô cơ
- Tóm tắt lý thuyết hóa học 9
- Bí quyết cân bằng nhanh các phản ứng hóa học
- Phân loại, gọi tên và viết công thức hóa học các hợp chất vô cơ
- Các công thức hóa học lớp 9 Đầy đủ nhất
- Đề cương ôn tập hóa 9 học kì 1 năm học 2021
A. Bảng hệ thống hóa: Các loại hợp chất vô cơ
| OXIT | AXIT | BAZƠ | MUỐI | |
| KHÁI NIỆM | Là hợp chất trong đó có một nguyên tố là oxi | Là hợp chất mà phân tử gồm một hay nhiều nguyên tử hiđro liên kết với một gốc axit. Các nguyên tử hidro này có thể thay thế bởi nguyên tử kim loại | Là hợp chất mà phân tử gồm một nguyên tử kim loại liên kết với một hay nhiều nhóm hidroxit (-OH) | Là hợp chất mà phân tử gồm một hay nhiều nguyên tử kim loại liên kết với một hay nhiều gốc axit |
| CTHH TỔNG QUÁT | MxOy trong đó: M là KHHH của kim loại hoặc phi kim; Hóa trị của M là 2y/x | HnR trong đó: R là gốc axit, n là hóa trị của gốc axit | M(OH)n trong đó: M là KHHH của kim loại; n là hóa trị của kim loại. | MxRy trong đó: M là KHHH của kim loại R là gốc axit; x, y là các chỉ số |
| PHÂN LOẠI | - oxit bazơ - oxit axit - oxit lưỡng tính -oxit trung tính | Theo thành phần:- axit có oxi- axit không có oxi Theo tính chất:- axit mạnh: HCl, HNO3, H2SO4...- axit yếu: H2CO3, H2S... | -Bazơ tan trong nước (kiềm): NaOH, KOH, Ca(OH)2, Ba(OH)2... - Bazơ không tan: Cu(OH)2, Mg(OH)2, Fe(OH)2, Fe(OH)3... | - Muối trung hòa: CaCO3, Na2SO4, Cu(NO2)2... - Muối axit: NaHCO3, NaHSO4, Ca(H2PO4)2... |
B. Nội dung chi tiết các hợp chất vô cơ
Để giúp bạn đọc hiểu chi tiết các hợp chất vô cơ. VnDoc biên soạn chi tiết nội dung tài liệu:
Cách gọi tên, phân loại, tính chất hóa học của các hợp chất vô cơ tại: Các loại hợp chất vô cơ
- Tính chất hóa học Oxit Bazơ
- Tính chất hóa học Oxit Axit
- Axit là gì? Tính chất hóa học của axit
- Tính chất hóa học của Bazơ
- Muối là gì? Tính chất hóa học của muối
- Oxit lưỡng tính là gì? Các oxit lưỡng tính
- Oxit trung tính là gì? Tính chất hóa học của oxit trung tính
C. Sơ đồ mối quan hệ giữa các hợp chất vô cơ
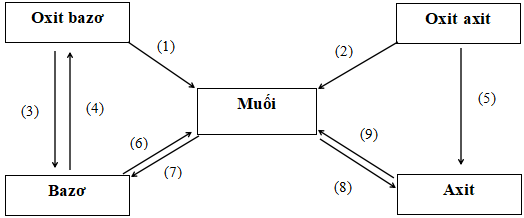
Những phản ứng hóa học minh họa
(1) CuO + 2HCl → CuCl2 + H2
(2) CO2 + KOH → K2CO3 + H2O
(3) K2O + H2O → 2KOH
(4) Cu(OH)2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) CuO + H2O
\(\overset{t^{\circ } }{\rightarrow}\) CuO + H2O
(5) SO2 + H2O → H2SO3
(6) Mg(OH)2 + H2SO4 → MgSO4 + H2O
(7) CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
(8) AgNO3 + HCl → AgCl + HNO3
(9) H2SO4 + ZnO → ZnSO4 + H2O
Sơ đồ tư duy hợp chất vô cơ
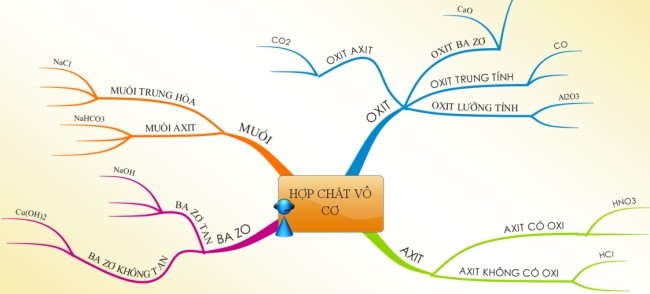
D. Bài tập vận dụng nâng cao
1. Câu hỏi trắc nghiệm vô cơ
Câu 1. Dãy chất nào sau đây gồm các chất tác dụng được với dung dịch H2SO4 đặc, nóng?
A. Cu, Mg(OH)2, CuO và SO2
B. Fe, Cu(OH)2, MgO và CO2
C. Cu, NaOH, Mg(OH)2 và CaCO3
D. Cu, MgO, CaCO3 và CO2
Câu 2. Dãy nào sau đây gồm các chất tác dụng được với dung dịch NaOH?
A. CO2, HCl và CuCl2
B. KOH, HCl và CuCl2
C. CuO, HCl và CuCl2
D. KOH, CuO và CuCl2
Câu 3. Hỗn hợp gồm Cu và Al có khối lượng 10 gam tác dụng vừa đủ với dung dịch HCl dư thu được 1,68 lít khí (đktc). Thành phần phần trăm khối lượng của Cu và Al trong hỗn hợp lần lượt là:
A. 27% và 73%
B. 86,5% và 13,5%
C. 50% và 50%
D. 75% và 25%
Câu 4. NaOH không được tạo thành trong thí nghiệm nào sau đây?
A. Cho kim loại Na tác dụng với H2O
B. Cho oxit kim loại Na2O tác dụng với H2O
C. Cho Na2O tác dụng với dung dịch HCl
D. Cho Na2SO4 tác dụng với Ba(OH)2
Câu 5. Cho các chất: SO2, NaOH, MgCO3, CaO và HCl. Số cặp chất phản ứng được với nhau là:
A. 2
B. 4
C. 3
D. 5
Câu 6. Thí nghiệm nào dưới đây không tạo ra muối
A. Cho bột CuO tác dụng với dung dịch HCl
B. Cho Fe tác dụng với dung dịch HCl
C. Cho muối NaCl tác dụng với AgNO3
D. Cho Ag tác dụng với H2SO4 loãng
Câu 7. Để phân biệt 3 chất rắn CaO, MgO, P2O5 có thể dùng thuốc thử là
A. Dung dịch NaOH
B. nước và quỳ tím
C. Dung dịch Ca(OH)2
D. Dung dịch HCl
Câu 8 Cho hỗn hợp sau: NaCl, Na2CO3 và NaOH. Để thu được muối ăn tinh khiết, từ hỗn hợp trên có thể dùng một lượng dư dung dịch chất nào sau đây?
A. BaCl2
B. HCl
C. Na2CO3
D. CaCl2
Câu 9. Hòa tan 1 gam mẫu đá vôi có thành phần chính là CaCO3 và tạp chất Fe2O3 vào 100 ml dung dịch HCl vừa đủ sinh ra 0,1792 khí (đktc). Nồng độ mol của dung dịch axit đã dùng là
A. 0,16M
B. 0,235M
C. 0,25M
D. 0,2M
Câu 10. Rót dung dịch BaCl2 dư vào cốc đựng dung dịch MgSO4. Dung dịch lượng dư các chất theo thứ tự nào sao đây để tách riêng từng muối có trong dung dịch thu được?
A. Ba(OH)2, HCl
B. Na2CO3, HCl
C. Ca(OH)2, HCl
D. H2SO4, NaOH
Câu 11. Cho 8 gam hỗn hợp gồm Cu và Fe tác dụng với dung dịch HCl dư tạo thành 1,68 lít khí H2 thoát ra ở đktc . Tính % về khối lượng của từng kim loại Cu có trong hỗn hợp?
A. 47,5%
B. 52,5%
C. 42,6%
D. 57,4%
Câu 12. Nung a mol Fe và 0,15 mol Cu trong không khí một thời gian thu được 63,2 gam hỗn hợp chất rắn. Hoà tan hoàn toàn hỗn hợp chất rắn trên bằng H2SO4 đặc, nóng, dư thu được dung dịch Y và 6,72 lít khí SO2 (đktc). Giá trị của a mol là
A. 0,7 mol
B. 0,3 mol
C. 0,45 mol
D. 0,8 mol
Câu 13. Khi cho từ từ dung dịch K2CO3 vào dung dịch HCl khuấy đều, hiện tượng xảy ra là
A. xuất hiện chất khí bay ra ngay khi cho K2CO3 vào
B. sau 1 thời gian thấy xuất hiện chất khí bay ra, dung dịch trong suốt
C. không có khí thoát ra
D. có khí thoát ra và xuất hiện kết tủa
Câu 14. Hòa tan hết 3,53 gam hỗn hợp X gồm ba kim loại Mg, Al và Fe trong dung dịch HCl thu được 2,352 lít khí hiđro (đktc) và dung dịch Y. Cô cạn dung dịch Y, thu được m gam hỗn hợp muối khan. Giá trị của m là
A. 11,195.
B. 12,405.
C .7,2575.
D. 10,985.
Câu 15. Cho một lượng muối FeS2 tác dụng với lượng dư dung dịch H2SO4 loãng, sau khi kết thúc phản ứng, thấy còn lại một chất rắn. Chất rắn này là:
A. FeS
B. FeS2 chưa phản ứng hết
C. S
D. Fe2(SO4)3
Câu 16. Để nhận biết các dung dịch sau: H2SO4, NaOH, HCl, người ta dùng
A. quỳ tím và dung dịch Ba(OH)2.
B. quỳ tím và dung dịch KOH.
C. phenolphtalein.
D. phenolphtalein và dung dịch NaCl.
Câu 17. Có những bazơ sau: NaOH, Cu(OH)2, Ba(OH)2, Al(OH)3, Fe(OH)2. Những bazo bị nhiệt phân hủy là:
A. NaOH, Cu(OH)2, Ba(OH)2.
B. NaOH, Cu(OH)2, Fe(OH)2.
C. NaOH, Al(OH)3, Fe(OH)2.
D. Cu(OH)2, Al(OH)3, Fe(OH)2.Câu 18. Từ những chất có sẵn là K2O, BaO, MgO, CuO, Fe2O3, Li2O và H2O, có thể điều chế được bao nhiêu dung dịch bazơ?
A. 1
B. 2
C. 3
D. 4
Câu 19.
Câu 20.
2. Đáp án hướng dẫn giải chi tiết
| 1 C | 2 A | 3 B | 4 C | 5 D |
| 6 D | 7 B | 8 B | 9 B | 10 A |
| 11 A | 12 A | 13 A | 14 D | 15 C |
| 16 A | 17 D | 18 C |
Câu 7.
Thử với lượng nhỏ mỗi chất.
Cho nước vào các chất rắn, quan sát sau đó cho thêm quỳ tím:
Không tan → MgO
+ Tan, tạo thành dung dịch làm quỳ tím hóa đỏ → P2O5
P2O5 + 3H2O → 2H3PO4
+ Tan, tạo thành dung dịch làm quỳ tím hóa xanh → CaO
CaO + H2O → Ca(OH)2
Câu 11.
Vì Cu đứng sau H trong dãy các kim loại nên Cu không phản ứng với HCl.
Fe + 2HCl → FeCl2 + H2
0,075 mol
Theo phản ứng trên,nFe = nH2 = 0,075 mol.
Suy ra khối lượng Fe = 56.0,075 = 4,2 g.
Khối lượng Cu = 8 - 4,2 = 3,8 g.
Từ đó, %Fe = 4,2.100/8 = 52,5%; %Cu = 100 - 52,5 = 47,5%
Câu 12.
Xem hỗn hợp chất rắn là hỗn hợp của x mol Fe, 0,15 mol Cu và y mol O.
Ta có: mhh = 56x + 64.0,15 + 16y = 63,2 (1)
Bảo toàn e :
3.nFe + 2.nCu = 2.nO + 2.nSO2
=> 3x + 0,3 = 0,6 + 2y => 3x − 2y = 0,3 (2)
Giải hệ (1) và (2) => x = 0,7 mol, y = 0,9 mol
Câu 14.
nH2 = 2,352/22,4 = 0,105(mol)
Phương trình tổng quát: Kim loại + HCl → Muối + H2
Bảo toàn nguyên tố H → nHCl = 2nH2 = 2.0,105 = 0,21 (mol)
Bảo toàn khối lượng
→mmuoi = mX + mHCl − mH2 =3,53 + 0,21.36,5 − 0,105.2 = 10,985 (g)
Câu 16.
Để có thể nhận biết được 3 dung dịch trên ta sử dụng quỳ tím:
Chia được thành 2 nhóm:
Nhóm 1: NaOH làm quỳ chuyển màu xanh
Nhóm 2: H2SO4, HCl làm quỳ chuyển màu đỏ
Dùng Ba(OH)2 nhận biết 2 dung dịch axit nhóm 2
Xuất hiệnkết tủa trắng thì dung dịch axit ban đầu là H2SO4
H2SO4 + BaCl2 → BaSO4 +2HCl
Không có hiện tượng gì thì là axit HCl
Câu 18. Các oxit bazơ tan trong nước tạo thành dung dịch bazơ
K2O + H2O → 2KOH
BaO + H2O → Ba(OH)2
Li2O + H2O → 2LiOH
............................
>> Mời các bạn tham khảo thêm một số tài liệu liên quan:
- Hóa học 9 Bài 12: Mối quan hệ giữa các hợp chất vô cơ
- Giải bài tập trang 41 SGK Hóa lớp 9: Mối quan hệ giữa các loại chất vô cơ
Bảng hệ thống hóa các loại hợp chất vô cơ lớp 9
249,1 KB-
Tải tài liệu các hợp chất vô cơ lớp 9 định dạng .doc
171,5 KB
- Chia sẻ bởi:
 Đinh Thị Nhàn
Đinh Thị Nhàn

Có thể bạn quan tâm
Xác thực tài khoản!Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:
Số điện thoại chưa đúng định dạng! Xác thực ngay Số điện thoại này đã được xác thực! Bạn có thể dùng Sđt này đăng nhập tại đây! Lỗi gửi SMS, liên hệ Admin 1 Bình luận Sắp xếp theo Mặc định Mới nhất Cũ nhất-
 Hiếu Bùi
Hiếu Bùi sơ đồ hình1 saii r ad ơi
Thích Phản hồi 0 12/07/24
-
Chương 1: Các loại hợp chất vô cơ
- Bài 1: Thành phần nguyên tử
- Hóa 10 Bài 1: Thành phần nguyên tử
- Giải bài tập Hóa 10 Bài 1: Thành phần nguyên tử
- Trắc nghiệm Hóa 10 Bài 1: Thành phần nguyên tử
- Bài 2: Hạt nhân nguyên tử - Nguyên tố hóa học - Đồng vị
- Hóa 10 Bài 2: Hạt nhân nguyên tử - Nguyên tố hóa học - Đồng vị
- Giải bài tập Hóa 10 Bài 2: Hạt nhân nguyên tử, nguyên tố hoá học, đồng vị
- Trắc nghiệm Hóa học 10 bài 2: Hạt nhân nguyên tử. Nguyên tố hóa học. Đồng vị
- Bài 3: Luyện tập: Thành phần nguyên tử
- Hóa 10 Bài 3: Luyện tập Thành phần nguyên tử
- Giải bài tập Hóa 10 bài 3 trang 18 SGK: Luyện tập thành phần nguyên tử
- Trắc nghiệm Hóa học 10 bài 3: Luyện tập: Thành phần nguyên tử
- Bài 4: Cấu tạo vỏ nguyên tử
- Hóa học 10 Bài 4: Cấu tạo vỏ nguyên tử
- Giải bài tập Hóa 10 bài 4 trang 22 SGK: Cấu tạo vỏ nguyên tử
- Trắc nghiệm Hóa học 10 bài 4: Cấu tạo vỏ nguyên tử
- Bài 5: Cấu hình electron
- Hóa học 10 Bài 5: Cấu hình electron nguyên tử
- Giải bài tập Hóa 10 bài 5: Cấu hình electron của nguyên tử
- Cách viết cấu hình electron nguyên tử
- Bài tập về cấu hình electron
- Trắc nghiệm Hóa học 10 bài 5: Cấu hình electron nguyên tử
- Bài 6: Luyện tập: Cấu tạo vỏ nguyên tử
- Giải bài tập Hóa 10 bài 6 SGK trang 30: Luyện tập cấu tạo vỏ nguyên tử
- Bảng hệ thống hóa các loại hợp chất vô cơ
- Trắc nghiệm Hóa học 10 bài 6: Luyện tập: Cấu tạo vỏ nguyên tử
- Đề kiểm tra 1 tiết môn Hóa học lớp 10 chương 1 học kì 1
- Bài 1: Thành phần nguyên tử
-
Chương 2: Bảng tuần hoàn các nguyên tố hóa học và Định luật tuần hoàn
- Bài 7: Bảng tuần hoàn các nguyên tố hóa học
- Hóa học 10 Bài 7: Bảng tuần hoàn các nguyên tố hóa học
- Giải Hóa 10 Bài 7: Bảng tuần hoàn các nguyên tố hóa học
- Trắc nghiệm Hóa học 10 bài 7: Bảng tuần hoàn các nguyên tố hóa học
- Bài 8: Sự biến đổi tuần hoàn cấu hình electron nguyên tử của các nguyên tố hóa học
- Hóa học 10 Bài 8: Sự biến đổi tuần hoàn cấu hình electron nguyên tử của các nguyên tố hóa học
- Giải Hóa 10 bài 8: Sự biến đổi tuần hoàn cấu hình electron nguyên tử của các nguyên tố hóa học
- Trắc nghiệm Hóa học 10 bài 8: Sự biến đổi tuần hoàn cấu hình electron nguyên tử của các nguyên tố hóa học
- Bài 9: Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học. Định luật tuần hoàn
- Hóa 10 bài 9: Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học. Định luật tuần hoàn
- Giải Hóa 10 Bài 9: Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học
- Bài tập Hóa 10 bài 9: Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học. Định luật tuần hoàn
- Trắc nghiệm Hóa học 10 bài 9: Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học. Định luật tuần hoàn
- Bài 10: Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
- Hóa 10 bài 10: Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
- Giải Hóa 10 Bài 10: Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
- Bài tập Hóa 10 bài 10: Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
- Trắc nghiệm Hóa học 10 bài 10: Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
- Bài 11: Luyện tập: Bảng tuần hoàn, sự biến đổi tuần hoàn cấu hình electron nguyên tử và tính chất của các nguyên tố hóa học
- Hóa 10 Bài 11: Luyện tập
- Giải Hóa 10 Bài 11: Luyện tập bảng tuần hoàn, sự biến đổi tuần hoàn cấu hình electron nguyên tử và tính chất của các nguyên tố hóa học
- Trắc nghiệm Hóa học 10 bài 11: Luyện tập: Bảng tuần hoàn, sự biến đổi tuần hoàn cấu hình electron nguyên tử và tính chất của các nguyên tố hóa học
- Bài 7: Bảng tuần hoàn các nguyên tố hóa học
-
Chương 3: Liên kết hóa học
- Bài 12: Liên kết ion - Tinh thể ion
- Hóa 10 Bài 12: Liên kết ion - Tinh thể ion
- Giải Hóa 10 Bài 12: Liên kết ion - Tinh thể ion
- Trắc nghiệm Hóa học 10 bài 12: Liên kết ion - Tinh thể ion
- Bài 13: Liên kết cộng hóa trị
- Hóa 10 Bài 13: Liên kết cộng hóa trị
- Giải Hóa 10 Bài 13: Liên kết cộng hóa trị
- Trắc nghiệm Hóa học 10 bài 13: Liên kết cộng hóa trị
- Bài 14: Tinh thể nguyên tử và tinh thể phân tử
- Giải bài tập trang 70, 71 SGK Hóa học lớp 10: Tinh thể nguyên tử và tinh thể phân tử
- Bài 15: Hóa trị và số oxi hóa
- Hóa 10 bài 15: Hóa trị và số oxi hóa
- Giải Hóa 10 Bài 15: Hóa trị và số oxi hóa
- Trắc nghiệm Hóa học 10 bài 15: Hóa trị và số oxi hóa
- Bài 16: Luyện tập: Liên kết hóa học
- Tóm tắt lý thuyết Hóa học 10 - Chương 3: Liên kết hóa học
- 110 câu hỏi trắc nghiệm lý thuyết phần Cấu tạo nguyên tử, bảng tuần hoàn và liên kết hóa học
- Trắc nghiệm Hóa học 10 bài 16: Luyện tập: Liên kết hóa học
- Bài 12: Liên kết ion - Tinh thể ion
-
Chương 4: Phản ứng oxi hóa - khử
- Bài 17: Phản ứng oxi hóa khử
- Giải bài tập trang 113 SGK Hóa lớp 8: Phản ứng oxi hóa - khử
- Trắc nghiệm Hóa học 10 bài 17: Phản ứng oxi hóa khử
- Bài 18: Phân loại phản ứng trong hóa học vô cơ
- Giải Hóa 10 bài 18: Phân loại phản ứng trong hóa học vô cơ
- Trắc nghiệm Hóa học 10 bài 18: Phân loại phản ứng trong hóa học vô cơ
- Bài 19: Luyện tập: Phản ứng oxi hóa - khử
- Giải Hóa 10 Bài 19: Luyện tập Phản ứng oxi hóa - khử
- Trắc nghiệm Hóa học 10 bài 19: Luyện tập: Phản ứng oxi hóa - khử
- Bài 20: Bài thực hành số 1: Phản ứng oxi hóa khử
- Giải Hóa 10 Bài 20: Bài thực hành số 1 Phản ứng oxi hóa khử
- Trắc nghiệm Hóa học 10 bài 20: Bài thực hành số 1: Phản ứng oxi hóa khử
- Câu hỏi trắc nghiệm có đáp án Hóa học lớp 10: Phản ứng oxi hóa - khử, tốc độ phản ứng và cân bằng hóa học
- Bài 17: Phản ứng oxi hóa khử
-
Chương 5: Nhóm Halogen
- Bài 21: Khái quát về nhóm halogen
- Giải bài tập trang 96 SGK Hóa học lớp 10: Khái quát về nhóm halogen
- Trắc nghiệm Hóa học 10 bài 21: Khái quát về nhóm halogen
- Bài 22: Clo
- Hóa 10 bài 22: Clo
- Giải bài tập trang 101 SGK Hóa học lớp 10: Clo
- Trắc nghiệm Hóa học 10 bài 22: Clo
- Bài 23: Hiđro clorua - Axit clohiđric và muối clorua
- Hóa 10 Bài 23: Hiđro clorua - Axit clohiđric và muối clorua
- Giải bài tập Hóa 10 Bài 23: Hiđro clorua Axit clohiđric và muối clorua
- Trắc nghiệm Hóa học 10 bài 23: Hiđro clorua - Axit clohiđric và muối clorua
- Bài 24: Sơ lược về hợp chất có oxi của Clo
- Hóa 10 bài 24: Sơ lược về hợp chất có oxi của Clo
- Giải Hóa 10 bài 24: Sơ lược về hợp chất có oxi của clo
- Trắc nghiệm Hóa học 10 bài 24: Sơ lược về hợp chất có oxi của Clo
- Bài 25: Flo - Brom - Iot
- Hóa 10 Bài 25: Flo - Brom - Iot
- Giải bài tập Hóa 10 Bài 25: Flo - Brom - Iot
- Trắc nghiệm Hóa học 10 bài 25: Flo - Brom - Iot
- Bài 26: Luyện tập: Nhóm halogen
- Hóa 10 bài 26: Luyện tập nhóm Halogen
- Giải bài tập trang 118, 119 SGK Hóa học lớp 10: Luyện tập nhóm halogen
- Trắc nghiệm Hóa học 10 bài 26: Luyện tập nhóm halogen
- Bài 27: Bài thực hành số 2: Tính chất hóa học của khí clo và hợp chất của clo
- Bài thực hành số 2 hóa 10
- Giải bài tập Hóa 10 Bài 27: Bài thực hành số 2 Tính chất hóa học của khí clo và hợp chất của clo
- Trắc nghiệm Hóa học 10 bài 27: Bài thực hành số 2: Tính chất hóa học của khí clo và hợp chất của clo
- Bài 28: Bài thực hành số 3: Tính chất hóa học của brom và iot
- Giải Hóa 10 Bài 28: Bài thực hành số 3 Tính chất hóa học của brom và iot
- Bài thực hành số 3 hóa 10
- Trắc nghiệm Hóa học 10 bài 28: Bài thực hành số 3: Tính chất hóa học của brom và iot
- Bài tập chương Halogen: Clo và hợp chất của clo
- Bài 21: Khái quát về nhóm halogen
-
Chương 6: Oxi - Lưu huỳnh
- Bài 29: Oxi - Ozon
- Giải Hóa 10 bài 29: Oxi - Ozon
- Trắc nghiệm Hóa học 10 bài 29: Oxi - Ozon
- Bài 30: Lưu huỳnh
- Giải Hóa 10 Bài 30: Lưu huỳnh
- Trắc nghiệm Hóa học 10 bài 30: Lưu huỳnh
- Bài 31: Bài thực hành số 4. Tính chất của oxi, lưu huỳnh
- Giải Hóa 10 Bài 31: Bài thực hành số 4 Tính chất của oxi, lưu huỳnh
- Bài thực hành số 4 hóa 10
- Trắc nghiệm Hóa học 10 bài 31: Bài thực hành số 4, Tính chất của oxi, lưu huỳnh
- Bài 32: Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit
- Giải Hóa 10 Bài 32: Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit
- Trắc nghiệm Hóa học 10 bài 32: Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit
- Bài 33: Axit sunfuric - Muối sunfat
- Giải bài tập trang 143 SGK Hóa học lớp 10: Axit sunfuric - Muối sunfat
- Trắc nghiệm Hóa học 10 bài 33: Axit sunfuric - Muối sunfat
- Bài 34: Luyện tập: Oxi và lưu huỳnh
- Giải bài tập trang 146, 147 SGK Hóa học lớp 10: Luyện tập Oxi và lưu huỳnh
- Trắc nghiệm Hóa học 10 bài 34: Luyện tập: Oxi và lưu huỳnh
- Bài 35: Bài thực hành số 5. Tính chất các hợp chất của lưu huỳnh
- Giải Hóa 10 Bài 35: Bài thực hành số 5 Tính chất các hợp chất của lưu huỳnh
- Trắc nghiệm Hóa học 10 bài 35: Bài thực hành số 5. Tính chất các hợp chất của lưu huỳnh
- Bài tập trắc nghiệm Oxi - Lưu huỳnh
- 40 CÂU HỎI TRẮC NGHIỆM VỀ OXIT - AXIT - BAZƠ - MUỐI
- Bài 29: Oxi - Ozon
-
Chương 7: Tốc độ phản ứng và cân bằng hóa học
- Bài 36: Tốc độ phản ứng hóa học
- Giải bài tập trang 153, 154 SGK Hóa học lớp 10: Tốc độ phản ứng hóa học
- Trắc nghiệm Hóa học 10 bài 36: Tốc độ phản ứng hóa học
- Bài 37: Bài thực hành số 6. Tốc độ phản ứng hóa học
- Giải bài tập trang 155 SGK Hóa học lớp 10: Bài thực hành số 6 Tốc độ phản ứng hóa học
- Trắc nghiệm Hóa học 10 bài 37: Bài thực hành số 6, tốc độ phản ứng hóa học
- Bài 38: Cân bằng hóa học
- Bí quyết cân bằng nhanh các phản ứng hóa học
- Trắc nghiệm Hóa học 10 bài 38: Cân bằng hóa học
- Bài 39: Luyện tập: Tốc độ phản ứng và cân bằng hóa học
- Giải bài tập trang 166, 167 SGK Hóa học lớp 10: Luyện tập Tốc độ phản ứng và cân bằng hóa học
- Trắc nghiệm Hóa học 10 bài 39: Luyện tập: Tốc độ phản ứng và cân bằng hóa học
- Tốc độ phản ứng và cân bằng hóa học
- Câu hỏi trắc nghiệm có đáp án Hóa học lớp 10: Phản ứng oxi hóa - khử, tốc độ phản ứng và cân bằng hóa học
- Bài 36: Tốc độ phản ứng hóa học
-
 Lớp 9
Lớp 9 -
 Hóa 9 - Giải Hoá 9
Hóa 9 - Giải Hoá 9 -
 Chuyên đề Hóa học lớp 9
Chuyên đề Hóa học lớp 9 -
 Đề thi Khảo sát lớp 9
Đề thi Khảo sát lớp 9 -
 Đề thi giữa kì 1 lớp 9
Đề thi giữa kì 1 lớp 9 -
 Đề thi học kì 1 lớp 9
Đề thi học kì 1 lớp 9 -
 Đề thi giữa kì 2 lớp 9
Đề thi giữa kì 2 lớp 9 -
 Đề thi học kì 2 lớp 9
Đề thi học kì 2 lớp 9 -
 Đề thi học kì 2 lớp 9 môn Toán
Đề thi học kì 2 lớp 9 môn Toán -
 Đề thi học kì 2 lớp 9 môn Văn
Đề thi học kì 2 lớp 9 môn Văn -
 Đề thi học kì 2 lớp 9 môn Tiếng Anh
Đề thi học kì 2 lớp 9 môn Tiếng Anh -
 Đề thi học kì 2 lớp 9 môn Vật Lý
Đề thi học kì 2 lớp 9 môn Vật Lý -
 Đề thi học kì 2 lớp 9 môn Hóa
Đề thi học kì 2 lớp 9 môn Hóa -
 Đề thi học kì 2 lớp 9 môn Sinh Học
Đề thi học kì 2 lớp 9 môn Sinh Học -
 Đề thi học kì 2 lớp 9 môn Lịch Sử
Đề thi học kì 2 lớp 9 môn Lịch Sử
Tham khảo thêm
-
Chuỗi phản ứng hóa học hữu cơ lớp 9 Có đáp án
-
Chuỗi phản ứng Hóa học vô cơ
-
Bài tập Kim loại tác dụng với nước
-
Tuyển tập 30 đề thi học sinh giỏi Hóa lớp 9
-
Phản ứng tráng gương của glucose
-
100 đề thi học sinh giỏi Hóa lớp 9
-
Chuyên đề KHTN 9 phần Hóa học
-
Tài liệu bồi dưỡng học sinh giỏi môn Hóa lớp 9
-
Bảng hệ thống hóa các loại hợp chất vô cơ lớp 9
-
Các dạng bài tập Hóa 9 theo từng bài sách Kết nối tri thức
Chuyên đề Hóa học lớp 9
-
Chuyên đề KHTN 9 phần Hóa học
-
Chuỗi phản ứng Hóa học vô cơ
-
Chuỗi phản ứng hóa học hữu cơ lớp 9 Có đáp án
-
Các dạng bài tập Hóa 9 theo từng bài sách Kết nối tri thức
-
Phản ứng tráng gương của glucose
-
Bảng hệ thống hóa các loại hợp chất vô cơ lớp 9

Gợi ý cho bạn
-
Bộ đề kiểm tra cuối tuần Tiếng Việt lớp 4 Kết nối tri thức Tuần 20
-
Tổng hợp từ vựng tiếng Anh lớp 9 chương trình mới
-
Bài tập cuối tuần Tiếng Việt lớp 4 Kết nối tri thức Tuần 20 Nâng cao
-
Tổng hợp cấu trúc và từ vựng tiếng Anh lớp 3 Global Success
Từ khóa » Các Loại Hợp Chất Vô Cơ Bazơ
-
Các Loại Hợp Chất Vô Cơ Lớp 9
-
Hóa Học Lớp 9 - Chương 1 - Các Loại Hợp Chất Vô Cơ
-
Tính Chất Hóa Học Các Loại Hợp Chất Vô Cơ, Cách Phân Loại Các Hợp ...
-
Bảng Hệ Thống Hóa Các Loại Hợp Chất Vô Cơ - Lớp 9
-
Hợp Chất Vô Cơ Có Mấy Loại
-
[CHUẨN NHẤT] Hợp Chất Vô Cơ Có Mấy Loại? - TopLoigiai
-
Trình Bày Sự Phân Loại Hợp Chất Vô Cơ? - Top Lời Giải
-
Chương 1: Các Loại Hợp Chất Vô Cơ
-
Bài 13- Luyện Tập Chương 1- Các Loại Hợp Chất Vô Cơ
-
Các Loại Hợp Chất Vô Cơ: Oxit, Axit, Bazơ Và Muối Có Thể Chuyển Hóa ...
-
HK II Lớp 8 Chủ đề: CÁC LOẠI HỢP CHẤT VÔ CƠ - Tài Liệu Text
-
Các Loại Hợp Chất Vô Cơ - Thư Viện Đề Thi
-
Kể Tên Các Loại Hợp Chất Vô Cơ đã Học
































