Acid Carbonic – Wikipedia Tiếng Việt
Nội dung
chuyển sang thanh bên ẩn- Đầu
- Bài viết
- Thảo luận
- Đọc
- Sửa đổi
- Sửa mã nguồn
- Xem lịch sử
- Đọc
- Sửa đổi
- Sửa mã nguồn
- Xem lịch sử
- Các liên kết đến đây
- Thay đổi liên quan
- Liên kết thường trực
- Thông tin trang
- Trích dẫn trang này
- Tạo URL rút gọn
- Tải mã QR
- Tạo một quyển sách
- Tải dưới dạng PDF
- Bản để in ra
- Wikimedia Commons
- Khoản mục Wikidata
| Acid carbonic | |||
|---|---|---|---|
| |||
| Danh pháp IUPAC | Carbonic acid | ||
| Tên khác | Carbon dioxide solutionDihydrogen carbonateAcid of airAerial acidHydroxymethanoic acid | ||
| Nhận dạng | |||
| Số CAS | 463-79-6 | ||
| PubChem | 767 | ||
| KEGG | C01353 | ||
| ChEBI | 28976 | ||
| ChEMBL | 1161632 | ||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ
| ||
| InChI | đầy đủ
| ||
| ChemSpider | 747 | ||
| Thuộc tính | |||
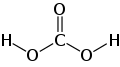
| Công thức phân tử | CH2O3 | ||
| Khối lượng mol | 62,02508 g/mol | ||
| Bề ngoài | dung dịch không màu | ||
| Khối lượng riêng | ≈ 1 g/cm³ (dung dịch loãng) | ||
| Điểm nóng chảy | N/A | ||
| Điểm sôi | |||
| Độ hòa tan trong nước | chỉ tồn tại trong dung dịch | ||
| Độ axit (pKa) | 6,35 (pKa1), 10,329 (pKa2) | ||
| Các nguy hiểm | |||
| Nguy hiểm chính | không ổn định | ||
| Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |||
Acid carbonic là một hợp chất vô cơ có công thức hóa học CH2O3. Đôi khi nó còn được gọi là dung dịch carbon dioxide trong nước, do dung dịch chứa một lượng nhỏ CH2O3. Acid carbonic tạo thành hai loại muối là carbonat và bicarbonat (HCO3)2. Nó là một acid yếu.[1]
Lịch sử
[sửa | sửa mã nguồn]Acid carbonic lần đầu tiên được biết đến trong nước khoáng vì vị chua. Năm 1597, Andreas Libavius đã công bố trong luận án của ông về các acid carbonic. Johan Baptista van Helmont đã tường thuật tỉ mỉ về quá trình lên men và tác dụng của acid khoáng sản trên đá carbon.
Điều chế và phản ứng[1][2]
[sửa | sửa mã nguồn]Acid carbonic là một acid yếu. Do vậy nó gần như không tồn tại được lâu và dễ phân hủy.
Phương trình:
+ Điều chế: H2O + CO2 → H2CO3
+ Phân hủy: H2CO3 → H2O + CO2
Úng dụng (tự nhiên)[3]
[sửa | sửa mã nguồn]H2CO3 có thể hòa tan đá vôi, dẫn đến sự hình thành calcium bicarbonat Ca(HCO3)2. Đây là lý do tạo nên nhiều đặc điểm của đá vôi như măng đá và nhũ đá.
Úng dụng (trong đời sống)[3]
[sửa | sửa mã nguồn]Acid carbonic (H2CO3) cũng được dùng trong nhiều loại nước uống, như cola.
Tham khảo
[sửa | sửa mã nguồn]- ^ a b "carbonic acid | Formula, Uses, & Facts | Britannica". www.britannica.com (bằng tiếng Anh). Truy cập ngày 2 tháng 1 năm 2022.
- ^ "Carbonic Acid - an overview | ScienceDirect Topics". Science Direct. Truy cập ngày 2 tháng 1 năm 2022.
- ^ a b "Carbonic Acid (H2CO3) - Structure, Properties, Preparation, Uses, and FAQs of Carbonic Acid". BYJUS (bằng tiếng Anh). Truy cập ngày 2 tháng 1 năm 2022.
Đọc thêm
[sửa | sửa mã nguồn]- "Tracer studies with radioactive oxygen-15. Exchange between carbon dioxide and water". J. Phys. Chem. Quyển 73 số 335. tr. 3351. doi:10.1021/j100844a033.
- Jolly, W. L. (1991). Modern Inorganic Chemistry (2nd Edn.). New York: McGraw-Hill. ISBN 0-07-112651-1.
- Moore, M. H.; Khanna, R. (1991). "Infrared and Mass Spectral Studies of Proton Irradiated H2O+Co2 Ice: Evidence for Carbonic Acid Ice: Evidence for Carbonic Acid". Spectrochimica Acta. Quyển 47A. tr. 255–262. doi:10.1016/0584-8539(91)80097-3.
- W. Hage, K. R. Liedl; Mayer, E.; Hallbrucker, A; Mayer, E (1998). "Carbonic Acid in the Gas Phase and Its Astrophysical Relevance". Science. Quyển 279 số 5355. tr. 1332–1335. doi:10.1126/science.279.5355.1332. PMID 9478889.
- Hage, W.; Hallbrucker, A.; Mayer, E. (1993). "Carbonic Acid: Synthesis by Protonation of Bicarbonate and Ftir Spectroscopic Characterization Via a New Cryogenic Technique". J. Am. Chem. Soc. Quyển 115. tr. 8427–8431. doi:10.1021/ja00071a061.
- Hage, W.; Hallbrucker, A.; Mayer, E. (1995). "A Polymorph of Carbonic Acid and Its Possible Astrophysical Relevance". J. Chem. Soc. Farad. Trans. Quyển 91. tr. 2823–2826. doi:10.1039/ft9959102823.
Liên kết ngoài
[sửa | sửa mã nguồn]- Ask a Scientist: Carbonic Acid Decomposition Lưu trữ ngày 21 tháng 11 năm 2010 tại Wayback Machine
- Why was the existence of carbonic acid unfairly doubted for so long?
- Carbonic acid/bicarbonate/carbonate equilibrium trong nước: pH of solutions, buffer capacity, titration and species distribution vs. pH computed with a free spreadsheet
- How to calculate concentration of Carbonic Acid trong nước[liên kết hỏng]
- https://www.sciencedirect.com/topics/earth-and-planetary-sciences/carbonic-acid
- https://www.sciencedirect.com/topics/earth-and-planetary-sciences/carbonic-acid
| |
|---|---|
|
- Hợp chất hydro
- Hóa chất
- Acid vô cơ
- Muối carbonat
- Hợp chất carbon
- Hợp chất carbon vô cơ
- Acid carboxylic
- Nguồn CS1 tiếng Anh (en)
- Bản mẫu webarchive dùng liên kết wayback
- Bài có liên kết hỏng
Từ khóa » Ctct Của H2co3
-
Viết Công Thức Cấu Tạo Của Các Chất: HNO3, H2CO3 - Hóa Học Lớp 10
-
Viết Công Thức Electron Và Công Thức Cấu Tạo Của ...
-
Top 12 Ctct Của H2co3
-
Tổng Hợp 20+ Công Thức Cấu Tạo Của H2co3 Hot Nhất Hiện Nay
-
Viết Công Thức Electron, Công Thức Cấu Tạo Của H2CO3? - Khánh Trăng
-
Top 14 Công Thức Cấu Tạo Của H2co3 - Ôn Thi HSG
-
Công Thức Electron Của Hno3 H2Co3, Viết Công Thức Cấu Tạo ...
-
Viết Công Thức Electron Và Công Thức Cấu Tạo Của ... - DocumenTV
-
Cách Viết Công Thức Cấu Tạo Hno3, H2Co3, Https://Hoidap247
-
1. Cho ZH = 1, ZC = 6, ZO = 8, ZN = 7. Viết Công Thức Cấu Tạo Của
-
Hóa 10 - Liên Kết Cộng Hóa Trị - HOCMAI Forum
-
Cách Viết Công Thức Electron Của Hno3, Viết Công Thức Cấu Tạo ...