Ammonio - Wikipedia
Indice
sposta nella barra laterale nascondi- Inizio
- Voce
- Discussione
- Leggi
- Modifica
- Modifica wikitesto
- Cronologia
- Leggi
- Modifica
- Modifica wikitesto
- Cronologia
- Puntano qui
- Modifiche correlate
- Link permanente
- Informazioni pagina
- Cita questa voce
- Ottieni URL breve
- Scarica codice QR
- Passa al parser legacy
- Crea un libro
- Scarica come PDF
- Versione stampabile
- Wikimedia Commons
- Elemento Wikidata
| Ione ammonio | |
|---|---|
 | |
  | |
| Nome IUPAC | |
| Ione ammonio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | H4N⁺ |
| Massa molecolare (u) | 18,04 g/mol |
| Numero CAS | 6684-80-6 [1] |
| PubChem | 223 e 16741146 |
| SMILES | [NH4+] |
| Indicazioni di sicurezza | |
| Modifica dati su Wikidata· Manuale | |

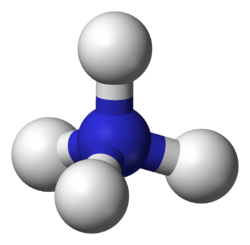
Il catione ammonio è uno ione poliatomico caricato positivamente, di formula chimica NH4+ dispari, risultato di una protonazione dell'ammoniaca.
L'atomo di azoto ha ibridazione sp3 e si trova al centro di un tetraedro regolare i cui vertici sono occupati dagli atomi di idrogeno. Esperimenti di tracciatura con il trizio hanno dimostrato che i quattro atomi di idrogeno sono equivalenti, ovvero che nella reazione inversa che ripristina l'ammoniaca uno qualsiasi dei quattro idrogeni può essere ceduto, non necessariamente quello proveniente dall'acido.
Ammonio e amminioni sono nomi comuni per ammine sostituite caricate positivamente (es. protonate) e per cationi ammonio quaternari N+R4, dove uno o più atomi di idrogeno sono rimpiazzati da radicali organici (simbolizzati dalla lettera R).
L'azoto caricato positivamente anziché formare tre legami covalenti, come nell'ammoniaca, ne forma quattro. Questa reazione chimica è reversibile. Lo ione ammonio funge da acido debole nel senso che può protonare una base più forte utilizzando uno dei quattro atomi di idrogeno e riconvertendosi in ammoniaca. Questo si traduce nel fatto che lo ione ammonio è l'acido coniugato della base ammoniaca. In una soluzione, il grado in cui dall'ammoniaca si formerà lo ione ammonio dipende dal pH della stessa.
Ricerca dello ione ammonio
[modifica | modifica wikitesto]Per il riconoscimento dello ione ammonio, in un dato miscuglio dalla composizione incognita, è necessario trattare la sostanza originale con una piccola quantità di NaOH o KOH in una provetta da laboratorio e riscaldarla a bagnomaria per ottenere la seguente reazione:
NH4+ + OH− —Δ→ NH3↑ + H2OLo ione ammonio presente in soluzione viene deprotonato dall'ambiente basico e si sviluppano vapori di ammoniaca rilevabili con cartina indicatrice universale del pH che assumerà una colorazione giallo-verde (la cartina dovrà essere precedentemente umidificata e posizionata all'imboccatura della provetta).
Altrimenti si può ricercare lo ione ammonio, in un dato miscuglio dalla composizione incognita, trattando la sostanza con 2-3 mL di NaOH in un vetrino ad orologio. In un secondo vetrino occorre posizionare la cartina indicatrice universale del pH, e successivamente usare quest'ultimo per coprire il primo (il quale ha all'interno la sostanza con NaOH). Nel giro di 30 secondi si avrà una colorazione blu della cartina indicatore, che confermerà la presenza dello ione ammonio.
NH4Cl + NaOH ⇄ NH4OH + NaCl
NH4OH —Δ→ NH3↑ + H2O
Cationi organici dell'ammonio
[modifica | modifica wikitesto]I cationi organici dell'ammonio sono specie ioniche di formula generale RR'R''R'''N+ (o più semplicemente R4N+) derivati dalla sostituzione di uno o più idrogeni dello ione ammonio NH4+ con dei radicali organici. A seconda del grado si sostituzione le forme ioniche si distinguono in primaria, secondaria, terziaria e quaternaria, analogamente alle ammine.
Ammonio primario
[modifica | modifica wikitesto]Gli ammonii primari sono ioni monosostituiti di formula RNH3+. Rappresentano gli acidi forti coniugati delle ammine primarie con le quali si trovano in equilibrio in ambiente acquoso
Ammonio secondario
[modifica | modifica wikitesto]Gli ammonii secondari sono ioni disostituiti di formula RR'NH2+ (oppure R2NH2+) in equilibrio in ambiente acquoso con le ammine secondarie di cui rappresentano gli acidi forti coniugati
Ammonio terziario
[modifica | modifica wikitesto]Gli ammonii terziari sono ioni trisostituiti di formula RR'R''NH+ (oppure R3NH+) in equilibrio con le ammine terziarie di cui rappresentano gli acidi forti coniugati
I cationi di ammonio terziario in acqua hanno una maggiore stabilità degli ammonii primari e secondari, fattore questo che comporta anche un minor carattere acido rispetto ai cationi mono e disostituiti. Tali caratteristiche fanno sì che gli ammonii terziari possano essere facilmente salificati, in genere con degli acidi alogenidrici, e quindi stabilizzati in forma solida cristallina; un esempio degno di nota sono i cloridrati delle ammine terziarie di formula generale R3NH+Cl−, sali spesso utilizzati a scopo terapeutico (ad esempio molti anestetici locali vengono somministrati sotto forma di cloridrato).
Ammonio quaternario
[modifica | modifica wikitesto]Gli ammonii quaternari sono ioni tetrasostituiti di formula R4N+. In ambiente acquoso sono stabili e non danno reazioni di dissociazione, mantenendo quindi una carica positiva netta dislocata sull'atomo di azoto. Anche i sali degli ammonii quaternari, come i terziari, possono avere utilizzi terapeutici (principalmente come farmaci colinergici). I Sali di ammonio quaternario inoltre, se opportunamente sostituiti, si comportano da tensioattivi e hanno proprietà battericida.
Sali di ammonio
[modifica | modifica wikitesto]- bicarbonato d'ammonio NH4 HCO3
- bicromato d'ammonio (NH4)2Cr2O7
- bromuro d'ammonio NH4Br
- carbammato d'ammonio NH4 H2NCO2
- carbonato d'ammonio (NH4)2CO3
- citrato di bismuto e ammonio (NH4)(BiOH) C6H5O7
- citrato di diammonio (NH4)2 C6H6O7
- cloruro d'ammonio (comunemente noto come sale d'ammonio) NH4Cl
- cromato d'ammonio (NH4)2CrO4
- fluoruro d'ammonio NH4F
- fosfato di ammonio (NH4)3PO4
- idrogenofosfato di ammonio e sodio NaNH4HPO4 · 4H2O
- diidrogenofosfato di ammonio NH4 H2PO4
- ioduro d'ammonio NH4I
- nitrato d'ammonio NH4 NO3
- ossalato di diammonio (NH4)2C2O4
- perclorato d'ammonio NH4 ClO4
- perossidisolfato d'ammonio (NH4)2S2O8
- solfato d'ammonio (NH4)2SO4
- solfito di ammonio (NH4)2SO3
- solfuro d'ammonio (NH4)2S
- tiocianato d'ammonio NH4 SCN
- tiosolfato d'ammonio (NH4)2S2O3
Note
[modifica | modifica wikitesto]- ↑ 6684-80-6, su tools.wmflabs.org, Wikimedia Tool Labs.
Voci correlate
[modifica | modifica wikitesto]- Protonazione
- Ammine
Altri progetti
[modifica | modifica wikitesto]Altri progetti
- Wikizionario
- Wikimedia Commons
 Wikizionario contiene il lemma di dizionario «ammonio»
Wikizionario contiene il lemma di dizionario «ammonio» Wikimedia Commons contiene immagini o altri file su ammonio
Wikimedia Commons contiene immagini o altri file su ammonio
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) ammonium ion, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.

| V·D·MSistematica organica | |
|---|---|
| Composti alifatici | Acetali · Acidi carbossilici · Alcani · Alcheni · Alchini · Alcoli · Aldeidi · Anidridi · Annuleni · Chetali · Chetoni · Cicloalcani · Cicloalcheni · Dioli · Enoli · Epossidi · Esteri · Eteri · Eteri corona · Lattoni · Lattoli · Perossidi · Perossiacidi · Polieni · Polioli |
| Composti aromatici | Arini · Ciclofani · Benzene · Fenoli · Eterocicli aromatici |
| Contenenti azoto | Alcaloidi · Ammonio · Ammidi · Ammine · Amminali · Azine · Azidi · Azocomposti · Azoli · Carbammati · Cianidrine · Diazocomposti · Idrazoni · Immidi · Immine · Isocianati · Isocianuri · Isotiocianati · Lattami · Nitrili · Nitrocomposti · Nitrosocomposti · Osazoni · Ossime |
| Contenenti zolfo | Acidi solfonici · Ditiani · Isotiocianati · Solfoni · Solfossidi · Tioesteri · Tioeteri · Tioli · Tioacetali · Tiochetali |
| Contenenti alogeni | Alogenuri acilici · Alogenuri alchilici |
| Contenenti silicio | Silani · Sililalchini · Sililalogenuri · Sililidruri · Silanoli · Alcossisilani · Silossani · Silazani |
| Altro | Alcossidi · Idrocarburi · Stannani · Terpeni |
| Vedi pure Nomenclatura IUPAC dei composti organici | |
| V·D·MIoni dell'azoto | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Ioni inorganici | pentazenio N5+· nitruri N3−· azoturo N3−· pentazoluro N5−
| ||||||||
| Ioni organici | nitrenio R2N+· ammonio R4N+· nitrilio RCN+R· imminio R2CN+R2· diazonio RN2+· diazenio R3N2+· benzendiazonio PhN2+ | ||||||||
| Controllo di autorità | Thesaurus BNCF 31172· LCCN (EN)sh85004546· BNF (FR)cb12406920p (data)· J9U (EN,HE)987007293893405171 |
|---|
- Cationi
- Senza fonti - ioni
- Senza fonti - aprile 2018
- P274 letta da Wikidata
- P231 differente su Wikidata
- P233 letta da Wikidata
- P662 letta da Wikidata
- P1417 letta da Wikidata
- Voci con codice Thesaurus BNCF
- Voci con codice LCCN
- Voci con codice BNF
- Voci con codice J9U
- Voci non biografiche con codici di controllo di autorità
Từ khóa » Nh Cos'è
-
NH Hoteles - Wikipedia
-
Cos'è Un Composto NH?
-
Ione Ammonio - Chimica-online
-
Ammoniemia, Ammoniaca Nel Sangue - My Personal Trainer
-
Linfoma Non Hodgkin: Sintomi, Prevenzione, Cause, Diagnosi - AIRC
-
Cos'è L'NH4 / NH3? - ACQUARIO PIANETA BLU
-
Ammoniaca - Ars.Toscana.It
-
Linfoma Non Hodgkin - Humanitas
-
Ammoniaca Nell'Enciclopedia Treccani
-
Linfoma Non Hodgkin: Sintomi E Cura - San Raffaele
![{\displaystyle {\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}\mathrm {H} {\vphantom {A}}^{+}{}\mathrel {\longrightarrow } {}\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{4}}{\vphantom {A}}^{+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/40744ec1455202eeaa814d85380193030c588dcf)
![{\displaystyle {\mathrm {RNH} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longleftrightarrow } {}\mathrm {RNH} {\vphantom {A}}_{\smash[{t}]{3}}{\vphantom {A}}^{+}{}+{}\mathrm {OH} {\vphantom {A}}^{-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a0886d1b504169df8d6da0c17b28ed8e7b572980)
![{\displaystyle {\mathrm {R} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {NH} {}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightleftharpoons } {}\mathrm {R} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{2}}{\vphantom {A}}^{+}{}+{}\mathrm {OH} {\vphantom {A}}^{-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/aae4ca51b7dc90feeb7cda684a763082dc106859)
![{\displaystyle {\mathrm {R} {\vphantom {A}}_{\smash[{t}]{3}}\mathrm {N} {}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightleftharpoons } {}\mathrm {R} {\vphantom {A}}_{\smash[{t}]{3}}\mathrm {NH} {\vphantom {A}}^{+}{}+{}\mathrm {OH} {\vphantom {A}}^{-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/47267f8d080d1027630d9ad054f9d21a1abf7934)