Axetilen Là Gì? Tính Chất Hóa Học & điều Chế Axetilen C2H2
Có thể bạn quan tâm
Axetilen là gì? Tính chất, cách điều chế và ứng dụng của axetilen ra sao? Nó có nguy hiểm đối với sức khỏe con người hay không? Cần làm gì để bảo đảm an toàn khi sử dụng loại chất khí này? Đây là những câu hỏi nhiều người đang thắc mắc khi tìm hiểu về các loại khí có vai trò quan trọng trong cuộc sống của con người. Hãy cùng tìm lời giải cho các câu hỏi trên qua bài tổng hợp sau của VietChem.
Mục lục- Axetilen là gì?
- Cấu tạo phân tử của axetilen
- Tính chất vật lý của axetilen
- Tính chất hóa học của axetilen
- 1. Phản ứng oxi hóa (cháy)
- 2. Phản ứng cộng
- 3. Phản ứng trùng hợp
- 4. Phản ứng hiđrat hóa
- Điều chế axetilen
- Ứng dụng của axetilen
- Axetilen nguy hiểm thế nào?
- Cách bảo quản khí axetilen an toàn
- Giải bài tập về axetilen
Axetilen là gì?
Axetilen hay acetylene (tên hệ thống là Ethylne) là một hidrocacbon không no nằm trong dãy đồng đẳng ankin. Đây là một chất khí không màu, không mùi với công thức hóa học là C2H2.
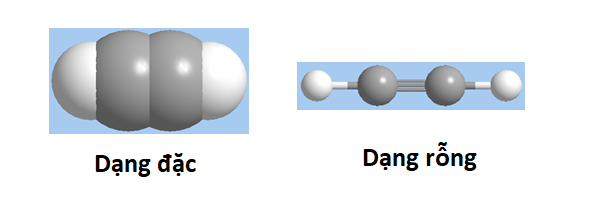
Axetilen là gì?
Cấu tạo phân tử của axetilen
Axetilen có công thức hóa học là C2H2 với một liên kết ba giữa hai nguyên tử cacbon trong một phân tử axetilen.
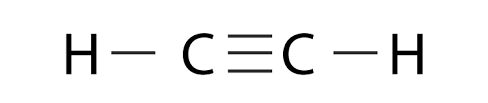
Cấu tạo phân tử của axetilen C2H2
Tính chất vật lý của axetilen
- Là một chất khí không màu, không mùi, dễ bắt cháy và nhẹ hơn không khí. Nó không tồn tại ở dạng tinh khiết hoàn toàn mà thường được để trong một dung dịch do tính không ổn định ở dạng tinh khiết.
- Là chất ít tan trong nước.
- Khối lượng riêng: 1.097 kg m-3
- Điểm nóng chảy: - 80.8 oC (192.4 K, -113.4 oF)
- Điểm sôi: - 84 oC (189 K, -119 oF)
Tính chất hóa học của axetilen
1. Phản ứng oxi hóa (cháy)
- Khi đốt axetilen trong không khí, nó sẽ cháy với ngọn lửa sáng và tỏa ra nhiều nhiệt
2C2H2 + 5O2 → 4CO2 + 2H2O
2. Phản ứng cộng
- Phản ứng cộng brom: tương tự như etilen, axetilen cũng làm mất màu dung dịch brom. Sản phẩm mới sinh ra do có liên kết đôi trong phân tử nên có thể cộng thêm một phân tử brom nữa:
HC ≡ CH (k) + Br – Br (dd) → Br – CH ≡ CH – Br (l)
Br – CH ≡ CH – Br (l) + Br – Br (dd) → Br2CH – CHBr2
- Trong những điều kiện thích hợp, axetilen còn có phản ứng cộng với hidro cùng một số chất khác:
CH ≡ CH + 2H2 → CH3 – CH3 (Ni, to)
CH ≡ CH + H2 → CH2 = CH2 (Pb/PbCO3)
CH ≡ CH + HCl → CH2 = CH – Cl (HgCl2, to: 150 - 200 oC)
CH2 = CH – Cl + HCl → CH3 – CHCl2
3. Phản ứng trùng hợp
- Cũng như ankin, anken có liên kết pi nên có khả năng tham gia phản ứng trùng hợp tạo ra polyme.
- Hai phân tử axetilen có thể cộng hợp lại với nhau tạo ra vinylaxetilen
2CH ≡ CH CH2 → CH – C ≡ CH (xt, to)
4. Phản ứng hiđrat hóa
- Axetilen có phản ứng cộng nước
HC ≡ CH + H – OH → [CH2 = CH – OH] → CH3 – CH = O
♻️♻️♻️ Etilen là gì? Công thức, tính chất hóa học của Etilen C2H4
Điều chế axetilen
Có thể điều chế axetilen bằng các phương pháp sau:
- Cho canxi cacbua tác dụng với nước
CaC2 + 2H2O → C2H2 + Ca(OH)2
- Cho cacbon tác dụng với hidro trong điều kiện có hồ quang điện
2C + H2 → C2H2
- Nhiệt phân metan ở nhiệt độ cao và làm lạnh nhanh sau đó
2CH4 → C2H2 + 3H2 (1500 oC)
Ứng dụng của axetilen
- Ứng dụng trong hàn xì: là một thành phần trong đèn oxi – axetilen dùng trong hàn và cắt kim loại. Từ đó giúp cho quá trình xây dựng, lắp ráp cùng việc sử dụng kim loại và uốn cắt kim loại trở nên dễ dàng hơn.
- Trong công nghiệp: nó là nguyên liệu trong sản xuất poli (viny clorua) (được dùng để sản xuất nhựa PVC), cao su, axit axetic và nhiều loại hóa chất quan trọng khác.

Axetilen là gì? Ứng dụng axetilen trong hàn xì
Axetilen nguy hiểm thế nào?
- Axetilen là một chất không gây độc hại với con người nếu sử dụng ở ngưỡng cho phép. Tuy nhiên, nếu vượt quá mức cho phép có thể gây một số ảnh hưởng đến cơ thể con người như:
- Có thể xảy ra một số hiện tượng buồn nôn, đau ngực, khó thở, nhức đầu, đi loạng choạng, da tái xanh, ngạt thở, đau phổi, hôn mê khi hít phải hí axetilen C2H2
- Nếu tiếp xúc qua da xuất hiện triệu chứng bị phát ban
- Khi sử dụng không đúng cách hay không có kiến thức cũng có thể gây ra một số hậu quả nghiêm trọng như tính dễ cháy, gây nổ của loại khí này cần đặc biệt thận trọng trong sử dụng và bảo quản. Nồng độ axetilen trong không khí từ 2,5% trở lên có thể gây ra cháy nổ.
☢️☢️☢️ Chất độc Kali Xyanua KCN là gì? Mua xyanua ở đâu giá RẺ?
Cách bảo quản khí axetilen an toàn
- Hạn chế các hư hại vật lý
- Bảo quản ở khu riêng, cách xa các chất khác, tránh các nguồn nhiệt, nguồn bắt cháy,…
- Bảo quản nơi khô ráo, thoáng mát và thông thoáng
- Có rào chắn che đậy và bảng hiệu cảnh báo.
Giải bài tập về axetilen
Bài tập 1: Cần sử dụng bao nhiêu ml dung dịch brom 0,1M để có thể tác dụng vừa đủ với 0,224 lít axetilen tại điều kiện tiêu chuẩn.
Lời giải:
Từ đề ra, ta có: nC2H2 = V/22,4 = 0,244/22,4 = 0,01 (mol)
PTPƯ:
C2H2 + 2Br2 → C2H2Br4
1 mol 2 mol 1 mol
0,01 mol ?mol
Theo PTPƯ ta được: nBr2 = 2.nC2H2 = 2.0,01 = 0,02 (mol)
VBr2 = n/CM = 0,02/0,1 = 0,2 (lít)
Bài tập 2: Biết rằng với 0,1 lít khí etilen (đktc) sẽ làm mất màu 50ml dung dịch brom. Vậy nếu dùng 0,1 lít khí axetilen (đktc) thì có thể làm mất màu bao nhiêu ml dung dịch brom trên?
Lời giải:
PTPƯ:
C2H4 + Br2 → C2H4Br2 (1)
C2H2 + 2Br2 → C2H2Br4 (2)
Từ PTPƯ (1) và (2) ta thấy được
Tỷ lệ nC2H4 : nBr2 = 1:1
nC2H2 : nBr2 = 1:2
Vậy số mol của brom phản ứng với C2H2 sẽ gấp 2 lần C2H4 nên thể tích tối đa của dung dịch brom mà C2H2 có thể làm mất màu sẽ gấp 2 lần so với thể thích dịch brom đã bị mất màu bởi C2H4:
Thể tích brom tối đa bị mất màu bởi C2H2 là: 50 x 2 = 100ml
Bài tập 3: Đốt cháy 28ml hỗn hợp khí metan cùng axetilen cần phải sử dụng 67,2 ml khí oxi. Hãy:
a) Tính phần trăm thể tích của mỗi loại khí trong hỗn hợp
b) Tính thể tích của khí CO2 sinh ra
(Thể tích các khí đều được đo ở cùng điều kiện nhiệt độ và áp suất)
Lời giải:
a) Gọi thể tích của CH4 và C2H2 lần lượt là a và b (ml)
Từ bài ra, ta có: a + b = 28 (ml) (*)
PTPƯ:
CH4 + 2O2 → CO2 + 2H2O (1)
1ml 2ml 1ml 2ml
aml 2aml aml
2C2H2 + 5O2 → 4CO2 + 2H2O (2)
2ml 5m 4ml 2ml
bml 2,5bml 2bml
Theo PTPƯ (1) ta được: VO2 = 2.VCH4 = 2a
Từ PTPƯ (2): VO2 = 2,5.VC2H2 = 2,5b
Như vậy, tổng thể tích oxi cần dùng là VO2 = 2a + 2,5b
Mà theo bài ra, ta có được: VO2 = 67,2 (ml)
2a + 2,5b = 67,2 (ml) (**)
Giải hệ phương trình (*) và (**) ta được a = 5,6 (ml) và b = 22,4 (ml)
%VCH4 = (5,6/28).100% = 20%
%VC2H2 = (22,4/28).100% = 80%
b) Từ PTPƯ (1), ta có: VCO2 = a
PTPƯ (2) thì VCO2 = 2b
Vậy thể tích của khí CO2 là: VCO2 = a +2b = 5,6 + (2.22,4) = 50,4 (ml)
Trên đây là những thông tin cơ bản về axetilen là gì và một số bài tập củng cố, mong rằng đã giúp ích cho bạn khi tìm hiểu về loại khí này. Nếu còn thắc mắc về bất kỳ vấn đề gì hay có bài tập cần giải đáp, bạn đọc hãy để lại bình luận ngay phía dưới bài viết, VietChem sẽ hỗ trợ quý bạn đọc một cách nhanh nhất. Thường xuyên truy cập hoachat.com.vn để đón xem nhiều bài viết hấp dẫn khác.
??? Potassium là gì? Potassium có trong thực phẩm nào, tác dụng ra sao?
Từ khóa » Tính Chất Hóa Học Của Axetilen
-
Tính Chất Hóa Học Của Axetilen C2H2 | Tính Chất Vật Lí, Nhận Biết ...
-
[CHUẨN NHẤT] Tính Chất Hóa Học Của Axetilen - TopLoigiai
-
Lý Thuyết Axetilen | SGK Hóa Lớp 9
-
Cấu Tạo Phân Tử, Tính Chất Vật Lý Và Hóa Học Của Axetilen (C2H2)
-
Tính Chất Vật Lý, Tính Chất Hóa Học, Cấu Tạo Phân Tử Axetilen C2H2 Và ...
-
Axetilen (C2H2): Khái Niệm, Tính Chất Và ứng Dụng - Monkey
-
Axetilen C2H2 Là Gì? - Đặc điểm Nổi Bật Của Axetilen - VietChem
-
Công Thức Cấu Tạo Của Axetilen C2H2. Tính Chất Hoá Học Của ...
-
Nêu Tính Chất Hóa Học Của Axetilen? - Đại Học Đông Đô Hà Nội
-
Axetilen C2H2 Cấu Tạo Phân Tử, Tính Chất Hoá Học Của ... - HayHocHoi
-
Axetilen Là Gì? Tính Chất Hoá Học, điều Chế Và ứng Dụng
-
Nêu Tính Chất Hóa Học Của Axetilen,Etilen - Selfomy Hỏi Đáp
-
Axetilen Là Gì? Tầm Quan Trọng Của Axetilen đối Với đời Sống Con ...
-
Hãy Viết 2 Phản ứng đặc Trưng Cho Tính Chất Hóa Học Của Axetilen