Axit Clohidric HCl 30 - 35% - VietChem
 Vietnamese Hệ thống chi nhánh
Vietnamese Hệ thống chi nhánh 
- Trang chủ
- Giới thiệu
- Sản phẩm
-
 Hóa chất công nghiệp
Hóa chất công nghiệp -
 Hóa chất xử lý nước
Hóa chất xử lý nước -
 Dung môi công nghiệp
Dung môi công nghiệp -
 Hóa chất cơ bản
Hóa chất cơ bản -
 Hóa chất Nabakem
Hóa chất Nabakem -
 Hóa chất tẩy cáu cặn
Hóa chất tẩy cáu cặn -
 Phụ gia thực phẩm
Phụ gia thực phẩm -
 Hóa chất dệt nhuộm
Hóa chất dệt nhuộm -
 Hóa chất xi mạ
Hóa chất xi mạ -
 Hoá chất thí nghiệm
Hoá chất thí nghiệm -
 Thiết bị thí nghiệm
Thiết bị thí nghiệm -
 Dụng cụ thí nghiệm
Dụng cụ thí nghiệm
-
- Dịch vụ
-
 Vận chuyển hoá chất
Vận chuyển hoá chất -
 Tẩy cáu cặn lò hơi
Tẩy cáu cặn lò hơi
-
- Tin tức
- Liên hệ
- Trang chủ
- › Hóa chất công nghiệp
- › Hóa chất cơ bản công nghiệp
- › Axit Clohidric HCl 30 - 35%
 Axit Clohidric HCl 30 - 35% 2 Đánh giá
Axit Clohidric HCl 30 - 35% 2 Đánh giá Mã code: 7647-01-0
Thương hiệu: Việt Nam
Mô tả nhanh
Axit clohidric HCl được sử dụng phổ biến trong nhiều lĩnh vực công nghiệp và sản xuất. Axit clohiđric là gì, những chất tác dụng với HCl, thí nghiệm điều chế axit clohiđric,... hãy cùng VietChem tìm hiểu nhé.
Liên hệ
Thêm vào giỏ hàngĐặt hàng qua điện thoại: 0963029988
Hoặc để lại số điện thoại, Chúng tôi sẽ gọi ngay cho bạn !!!
Gọi lại cho tôiHoặc tải về Catalogue sản phẩm
Mô tả sản phẩm| Tên sản phẩm | Axit clohidric |
| Tên gọi khác | Clohydric acid, Hydro clorua |
| Công thức hóa học | HCl |
| CAS | 7647-01-0 |
| Hàm lượng | 30% - 35% |
| Xuất xứ | Vietchem - Việt Nam |
| Tính chất | - Chất lỏng màu trong suốt, ánh vàng. - Tan hoàn toàn trong nước. - Là axít vô cơ mạnh, làm cháy da, hoà tan phần lớn các kim loại thường tạo thành muối Clorua kim loại |
| Thông số kĩ thuật | - Hàm lượng: ≥ 35% - Fe : ≤ 5.0 ppm - SO42- ≤ 200.0 ppm - Cl2 tự do ≤ 30 ppm |
| Ứng dụng | – Dùng trong công nghiệp sản xuất các hợp chất vô cơ – Tẩy rỉ kim loại trước khi hàn – Dùng để xử lý nước (kiểm soát và trung hòa độ pH, tái sinh bằng cách trao đổi ion) – Dùng trong công nghiệp khai thác dầu – Dùng trong công nghiệp sản xuất thực phẩm – Dùng trong công nghiệp thuộc da nhuộm, mạ điện, tổng hợp hữu cơ… |
| Quy cách | 30 kg/can, 250 kg/phuy, 1000 kg/tank hoặc xe bồn |
| Bảo quản | - Bảo quản và pha chế dùng các thiết bị như thép không rỉ, nhựa, composit - Bảo quản nơi khô ráo, thoáng mát - Tuyệt đối không cho nước vào axit |
| Liều lượng sử dụng | Phụ thuộc vào pH đầu vào và yêu cầu đầu ra của nước thải. |
| Phiếu an toàn hóa chất | MSDS Axit Clohidric HCl |
Được biết đến là một trong những hóa chất hàng đầu, axit clohidric HCl được sử dụng phổ biến trong nhiều lĩnh vực công nghiệp. Vậy axit clohiđric là gì? Nó có tính chất vật lý và hóa học ra sao? Ứng dụng cụ thể như thế nào? Cùng tham khảo bài viết sau của VietChem để biết thêm về loại hóa chất thông dụng này.
Mục lục- Sơ lược về axit clohidric HCl
- 1. Axit clohiđric là gì?
- 2. Nguồn gốc
- 3. Cấu tạo phân tử, công thức hóa học
- 4. Tính chất vật lý
- 5. Tính chất hóa học của HCl
- 6. Điều chế và sản xuất
- Ứng dụng của axit clohidric
- Hướng dẫn sử dụng an toàn và bảo quản axit clohidric
- 1. Lưu ý khi sử dụng
- 2. Trong bảo quản
- Mua axit clohidric HCl ở đâu? Giá HCl bao nhiêu?
Sơ lược về axit clohidric HCl
1. Axit clohiđric là gì?
Axit clohidric hay còn được biết đến với tên gọi axit clohydric, axit muriatic, cloran hoặc axit hidrocloric, là một hợp chất vô cơ với tính axit mạnh. Nó được tạo ra từ sự hòa tan của khí hidro clorua trong nước và tồn tại dưới hai dạng là lỏng và khí.
2. Nguồn gốc
Vấn đề về lịch sử phát hiện Axit clohiric vẫn còn nhiều tranh cãi. Có tài liệu (tuy không nhiều và rõ ràng) cho thấy Axit clohiric được điều chế từ thời Trung cổ, cái khác lại chỉ ra nguồn gốc đầu tiên vào thế kỷ 15 và 16. Nhiều tác giả cho rằng nó được phát hiện vào thể kỷ 15 bởi Basil Velentine bằng cách nung muối cùng axit sunfuric lục.
Năm 1977 hydro clorua tinh khiết đã được tạo ra bởi Joseph Priestley (người Anh) và được chứng minh nó có thành phần hóa học bao gồm hydro cùng clo bởi Humphry Davy vào năm 1818.
Sau một thời gian dài nghiên cứu và phát triển, ngày nay Axit clohiric đã trở thành một trong những loại hóa chất hàng đầu sử dụng trong nhiều ngành công nghiệp như dược phẩm, hóa học, chế phẩm,…
3. Cấu tạo phân tử, công thức hóa học
Axit clohiđric kỳ hiệu là HCl
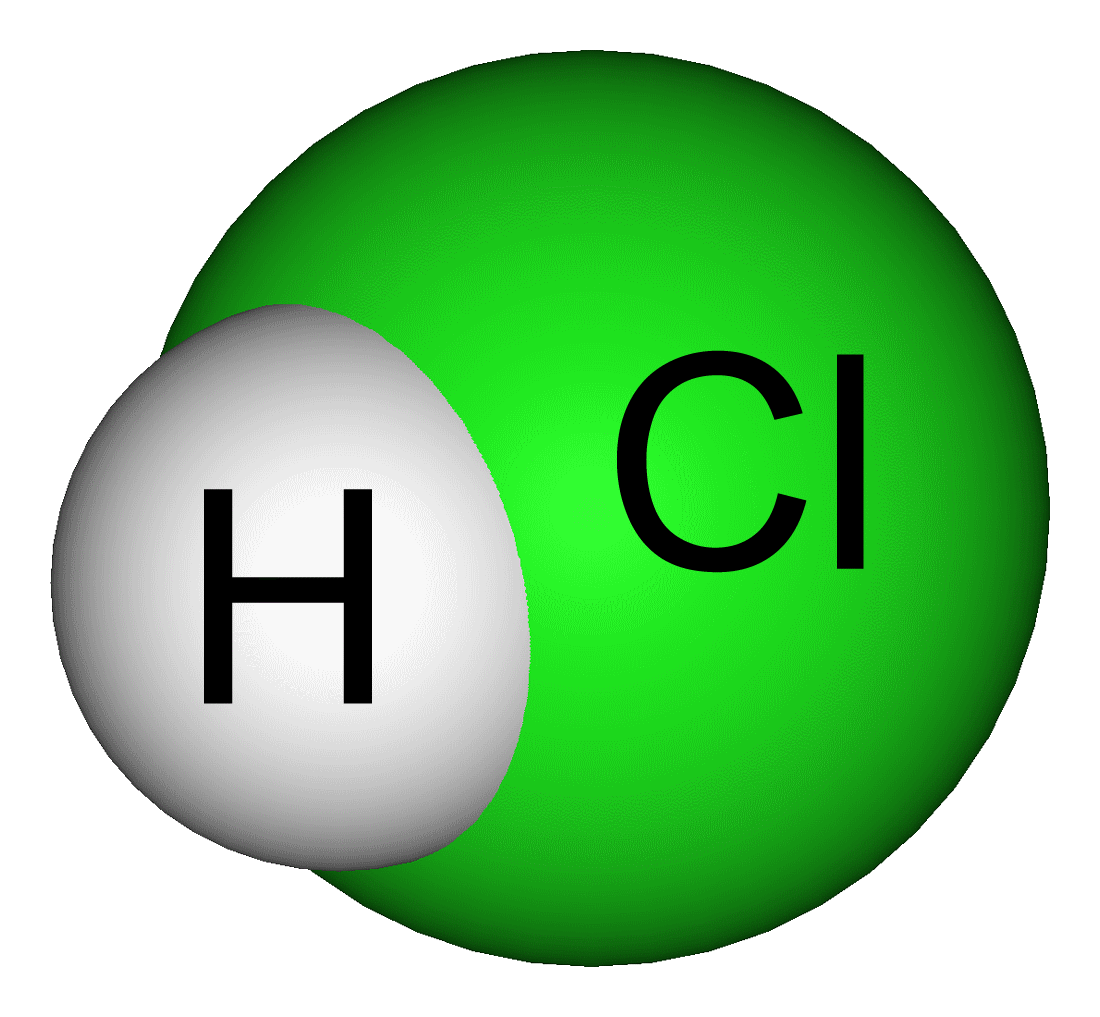
Axit clohidric là gì? Công thức cấu tạo
4. Tính chất vật lý
- Axit clohiric không màu khi tồn tại ở dạng khí, có mùi xốc, tan nhiều trong nước tạo ra dung dịch axit mạnh, nó nặng hơn không khí
- Đối với dạng dung dịch: Không màu khi ở dung dịch loãng, ở nồng độ tối đa 40% dung dịch có màu vàng ngả xanh lá và có thể tạo thành các sương mù axit
- Trọng lượng phân tử: 36.5 g/mol
- Khối lượng riêng: 1.18 g/cm3 (tỷ trọng của dung dịch 36 – 38%)
- Điểm nóng chảy: -27.32 oC (dung dịch 38%)
- Điểm sôi: 48 oC (dung dịch 38%)
- Độ hòa tan trong nước: 725 g/l (ở 20 oC)
- Là một dung dịch dễ bay hơi
5. Tính chất hóa học của HCl
- Làm quỳ tím hóa đỏ
- Tác dụng với bazo tạo ra muối và nước
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
Al(OH)3 + 3HCl → AlCl3 + 3H2O
- Tác dụng với oxit kim loại cho ra sản phẩm muối va nước, trong đó kim loại giữ nguyên hóa trị
Fe3O4 + 8HCl → 4H2O + Fel2 + 2FeCl3
CuO + 2HCl → CuCl2 + H2O
- Phản ứng với kim loại đứng trước H trong dãy hoạt động hóa học (trừ Pb) tạo nên muối và giải phóng khí Hydro
Fe + 2HCl → FeCl2 + H2
- Tạo ra muối mới và axit mới khi tác dụng với muối
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
AgNO3 + HCl → AgCl + HNO3
- Tính oxy hóa: tác dụng với các kim loại đứng trước H2:
MgO + 2HCl → MgCl2 + H2O
- Tính khử: tác dụng với các chất có tính oxy hóa mạnh như KMn (đặc), MnO2, KClO3 để giải phóng khí clo:
2KMnO4 (đặc) + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Thí nghiệm những chất tác dụng của HCl
6. Điều chế và sản xuất
6.1. Trong phòng thí nghiệm
Trong phòng thí nghiệm HCl được điều chế bằng phương pháp sunfat (nồng độ dung dịch có thể lên đến 40%)
NaCl (rắn) + H2SO4 (đặc) → NaHSO4 + HCl (< 250 oC)
2NaCl (rắn) + H2SO4 (đặc) → Na2SO4 + 2HCl (> 400 oC)
6.2. Trong công nghiệp
HCl trong công nghiệp được điều chế bằng phương pháp tổng hợp với nồng độ 32 – 34% là chủ yếu
H2 + Cl2 → 2HCl
Ứng dụng của axit clohidric
HCl được ứng dụng rộng rãi trong nhiều ngành công nghiệp:
- Trong tẩy gỉ thép: chủ yếu sử dụng HCl nồng độ 18%
Fe2O3 + Fe + 6HCl → 3FeCl2 + 3H2O
- Dùng trong sản xuất các hợp chất hữu cơ như vinyl clorua, dicloroetan để làm ra PVC hay than hoạt tính.
- Sản xuất ra các hợp chất vô co khác để dùng làm chất keo tụ hay chất dông tụ ứng dụng trong quá trình xử lý nước thải, sản xuất nước uống, giấy, trong công nghiệp mạ cùng sản xuất pin
- Ứng dụng trong công nghiệp yêu cầu độ tinh khiết như thực phẩm, dược phẩm: Sử dụng axit HCl dể kiểm soát và trung hòa pH của nước.
- Trong công nghiệp hóa, sản xuất nước uống hay thực phẩm: dùng để tẩy các cation từ các loại nhựa tạo ra nước đã được khử khoáng.
- Trong sinh vật: HCl được tìm thấy trong axit gastric tiết ra từ dạ dày, giúp tạo môi trường axit trong dạ dày với độ pH từ 1 -2
- Một số phản ứng hóa học liên quan đến axit HCl còn được dùng trong sản xuất thực phẩm làm nguyên liệu hay phụ gia thực phẩm.
- Ngoài ra, nó còn được sử dụng trong công nghệ xử lý da, giúp vệ sinh nhà cửa hay xây dụng nhà. Trong khai thác dầu, HCl còn được dùng để bơm vào tầng đá của giếng dầu để hòa tan một phần đá (rửa giếng) và tạo ra các lỗ rỗng lớn hơn.

Ứng dụng của axit clohidric trong sản xuất nước uống
Hướng dẫn sử dụng an toàn và bảo quản axit clohidric
1. Lưu ý khi sử dụng
- HCl có khả năng an mòn các mô con người và gây tổn thương các cơ quan hô hấp, mắt, da và ruột vì vậy không được tiếp xúc trực tiếp với hóa chất này, cần trang bị đầy dủ bảo hộ lao động chuyên dụng.
- Tránh xảy ra tình trạng rơi vãi hóa chất. Nếu có cần dùng nước để rửa sạch.
- Nếu bj bắn loại axit này vào người cần rửa ngay bằng nước sạch đến khi hết ngứa, nếu không tác dụng hoặc bị bắn vào mắt, uống phải cần đến ngay cơ sở y tế gần nhất

Rửa sạch với nước khi dính phải axit clohidric
2. Trong bảo quản
- Bảo quản nơi khô thoáng tránh ánh nắng trực tiếp, ẩm ướt, mưa
- Kho bãi cần có các phương pháp phòng tránh nguy cơ gây đỗ vỡ, rò rỉ hóa chất. Nền kho chứa phải đươc làm bằng vật liệu có khả năng chịu axit.
- Không được để chung, gần các chất dễ cháy và oxy hóa đặc biệt là HNO3 và hơp chất clorat
- Đựng trong vật chứ chuyên dụng, đóng kín khi không cần sử dụng
- Tránh để HCl tiếp xúc với kim loại
Mua axit clohidric HCl ở đâu? Giá HCl bao nhiêu?
Nếu bạn cần tìm mua các sản phẩm axit clohidric chất lượng, uy tín trên thì trường thì VietChem là một trong những lựa chọn hàng đầu. VietChem là đơn vị chuyên cung cấp axit clohidric nói riêng và các loại hóa chất nói chung, được nhiều khách hàng tin tưởng, chọn lựa. Sản phẩm ở đây luôn được kiểm tra chặt chẽ , đảm bảo chất lượng tuyệt đối đến tay khách hàng.
Tùy thuộc vào định lượng và xuất xứ mà HCL sẽ có giá thành khác nhau. Để biết thêm chi tiết về sản phẩm hay giá của axit clohidric, quý khách vui lòng liên hệ trực tiếp đến số hotline hoặc inbox qua websiten, quý khách hàng sẽ được hỗ trợ nhanh nhất từ các chuyên viên của chúng tôi.
Đến đây bạn đọc có lẽ đã hiểu thêm được axit clohidric là gì, ứng dụng cũng như lưu ý để sử dụng một cách an toàn, hiệu quả. Thường xuyên truy cập hoachat.com.vn để cập nhật những thông tin mới khác.
Tìm kiếm liên quan:
- Những chất tác dụng với HCl
- Axit clohiđric viết tắt
Bình luận, Hỏi đápQuy định đăng bình luận
Gửi 
 Dung Dịch Amoniac NH4OH - Amoni Hydroxit
Dung Dịch Amoniac NH4OH - Amoni Hydroxit Liên hệ
 Kali Hydro Photphat K2HPO4 98% Trung Quốc
Kali Hydro Photphat K2HPO4 98% Trung Quốc Liên hệ
 Axit Boric H3BO3
Axit Boric H3BO3 Liên hệ
 Xút Vảy NaOH 99% - Hoá Chất NaOH
Xút Vảy NaOH 99% - Hoá Chất NaOH Liên hệ
 Kali Dicromat K2Cr2O7 99,7% Trung Quốc
Kali Dicromat K2Cr2O7 99,7% Trung Quốc Liên hệ
Sản phẩm mới Kali Cacbonat K2CO3 | Potassium Cacbonate
Kali Cacbonat K2CO3 | Potassium Cacbonate Liên hệ
 Hoá Chất Hydrazine Hydrate N2H4
Hoá Chất Hydrazine Hydrate N2H4 Liên hệ
 Glycerine C3H8O3
Glycerine C3H8O3 Liên hệ
 Methyl ethyl ketone (MEK) C4H8O Trung Quốc
Methyl ethyl ketone (MEK) C4H8O Trung Quốc Liên hệ
 Potassium Hydroxide KOH 90%
Potassium Hydroxide KOH 90% Liên hệ
Hỗ trợ
HÀ NỘI & CÁC TỈNH MIỀN BẮC
Đinh Phương Thảo
0963 029 988
Nhận ưu đãi từVIETCHEM
Đăng ký ngay
CÔNG TY CỔ PHẦN XUẤT NHẬP KHẨU HÓA CHẤT VÀ THIẾT BỊ KIM NGƯU (VietChem). GPĐKKD: 0101515887 do Sở KH & ĐT TP Hà Nội cấp ngày 30/06/2004. Là đơn vị cung cấp HOÁ CHẤT CÔNG NGHIỆP hàng đầu tại Việt Nam.
Thông tin liên hệ
- Đ/c: Số 9 Ngõ 51 Lãng Yên, phường Vĩnh Tuy, Tp Hà Nội
- Hotline: 096 302 9988
- Fax:
- Email: [email protected]
SẢN PHẨM BÁN CHẠY
- Potassium Hydroxide KOH 90%
- Kali Cacbonat K2CO3
- Glycerine C3H8O3
- Butyl Acetate C6H12O2
CHÍNH SÁCH & LIÊN HỆ
- Chính Sách
- Điều Khoản Sử Dụng
- Hệ Thống Chi Nhánh
- Liên Hệ
© 2018 by Vietchem All Right Reserved.
 ᐱ
ᐱ 
Một sản phẩm mới được thêm vào giỏ hàng của bạn
Số lượng:
Đi đến giỏ hàng 0963029988Từ khóa » D Của Hcl
-
Acid Hydrochloric – Wikipedia Tiếng Việt
-
Axit HCl 31%-35% - CÔNG TY CỔ PHẦN HÓA CHẤT VIỆT TRÌ
-
Axit Clohidric Là Gì? Tính Chất, Cách điều Chế, ứng Dụng & Lưu ý Khi ...
-
D Của Hcl | Cơ-khí.vn
-
Axit Clohydric HCl Là Gì? Công Thức Tính Chất Hóa Học Của HCL
-
Hướng Dẫn Sử Dụng Axit HCL Hydroclorua Acid | DANAHYG
-
Cách Pha HCl 37% Ra HCl 7.5 % [Lưu Trữ] - Diễn đàn Thế Giới Hoá ...
-
Tính Chất Hóa Học Của HCl (Axit Clohiric) Là Gì? TÌM HIỂU TOÀN BỘ!!!
-
AXIT CLOHYDRIC, HCL Giá Rẻ - Hóa Chất Công Nghiệp Việt Quang
-
A) Dd Axit HCl Nồng độ 37% Có D=1,19g/ml .tính Nồng độ Mol Của Dd
-
Khí Hidroclorua Có độc Hại Không, Những Lưu ý Khi Sử Dụng.
-
Tính Khối Lượng Riêng Của Dd HCl - Anh Nguyễn - Hoc247
-
Tính Chất Hóa Học Của HCl Axit Clohiđric Và ứng Dụng - VOH
-
[PDF] PHIẾU AN TOÀN HÓA CHẤT HYDROCHLORIC ACID (HCl ... - Vedan
-
Axit Clohidric Là Gì? Tính Chất Hóa Học Của HCl [CHI TIẾT]
-
Axit Clohydric HCL 37% Cấp điện Tử - Hydrochloric Acid Electronic ...


