Axit Clohiđric HCl, Axit Sunfuric H2SO4 Tính Chất Hóa Học Và Ứng Dụng
Có thể bạn quan tâm
Sau khi học xong bài này, các em có thể trả lời các câu hỏi như: Axit Clohiđric (HCl) hay axit sunfuric (H2SO4) có những tính chất hóa học và tính chất vật lý gì? các axit này có ứng dụng gì quan trọng và vai trò như thế nào trong đời sống?
A. Axit Clohiđric (HCl)
I. Tính chất của axit clohidric (HCl)
1. Tính chất vật lý của axit clohiđric
- Khi hòa tan khí HCl vào nước ta thu được dung dịch HCl
- Dung dịch HCl đậm đặc là dung dịch bão hòa hiđroclorua, có nồng độ khoảng 37%, từ đây ta có thể pha chế thành dung dịch HCl có nồng độ khác nhau.
2. Tính chất hóa học của axit clohiđric
- Axit HCl là một axit mạnh, có đầy đủ tính chất của một axit mạnh như:
a) Axit HCl làm đổi màu quỳ tím thành đỏ.
b) Axit HCl tác dụng với nhiều kim loại đứng trước hidro (Mg, Al, Zn, Fe,...) tạo thành muối clorua và giải phóng khí hiđro
* Ví dụ: Mg+ 2HCl → MgCl2 + H2↑
Fe + 2HCl → FeCl2 + H2↑
c) Axit HCl tác dụng với bazơ tạo thành muối clorua và nước.
* Ví dụ: HCl + KOH → KCl + H2O
2HCl + Cu(OH)2 → CuCl2 + 2H2O
d) Axit HCl tác dụng với oxit bazơ tạo thành muối clorua và nước.
* Ví dụ: 2HCl + CuO → CuCl2 + H2O
e) Tác dụng với một số muối.
* Ví dụ: 2HCl + Na2CO3 → 2NaCl + H2O + CO2↑
2. Ứng dụng của axit clohiđric
Axit Clohidric được ứng dụng để:
- Điều chế các muối clorua.
- Làm sạch bề mặt kim loại trước khi hàn.
- Tẩy gỉ kim loại trước khi sơn, tráng, mạ kim loại.
- Dùng trong chế biến thực phẩm, dược phẩm.
B. Axit Sunfuric (H2SO4)
I. Tính chất của axit sunfuric (H2SO4)
1. Tính chất vật lý của axit sunfuric (H2SO4)
- Axit sunfuric là chất lỏng sánh, không màu, nặng gấp hai lần nước, không bay hơi, tan dễ dàng trong nước và tỏa nhiều nhiệt.
> Lưu ý: Khi pha loãng dung dịch axit sunfuric đặc, taphari rót từ từ axit đặc vào lọ đựng sẵn nước rồi khuấy đều (làm ngược lại rất nguy hiểm vì axit sunfuric đặc có tính háo nước sẽ gây nổ).
2. Tính chất hóa học của axit sunfuric (H2SO4)
Axit sunfuric đặc và axit sunfuric loãng có một số tính chất hóa học khác nhau.
a) Tính chất hóa học của axit H2SO4 loãng:
• Axit sunfuric loãng có đầy đủ tính chất của một axit mạnh.
- Axit sunfuric loãng làm đổi màu quỳ tím thành đỏ
- Axit sunfuric loãng tác dụng với nhiều kim loại đứng trước hidro (Mg, Al, Zn, Fe,...) tạo thành muối sunfat và giải phóng khí hiđro.
* Ví dụ: Zn + H2SO4 → ZnSO4 + H2↑
- Axit sunfuric loãng tác dụng với bazơ tạo thành muối sunfat và nước.
* Ví dụ: Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
- Axit sunfuric loãng tác dụng với oxit bazơ tạo thành muối sunfat và nước.
* Ví dụ: FeO + H2SO4 → FeSO4 + H2O
- Ngoài ra, axit sunfuric loãng tác dụng với một số muối.
b) Tính chất hóa học riêng của axit sunfuric đặc.
- Axit sunfuric đặc tác dụng với kim loại
Axit H2SO4 đặc tác dụng với nhiều kim loại nhưng không giải phóng khí hiđro. Khí nóng tạo thành muối sunfat (ứng với hóa trị cao của kim loại nếu kim loại có nhiều hóa trị) và khí sunfurơ.
* Ví dụ: 2Fe + 6H2SO4 (đặc, nóng) → Fe2(SO4)3 + 3SO2↑ + 6H2O
- Axit sunfuric đặc có tính háo nước
C12H22O11 12C + 11H2O
3. Ứng dụng của axit sunfuric
- Axit H2SO4 là nguyên liệu của nhiều ngành sản xuất hóa học như sản xuất phân bón, phẩm nhuộm, chế biến dầu mỏ,... Hàng năm, thế giới sản xuất gần 200 triệu tấn axit H2SO4.
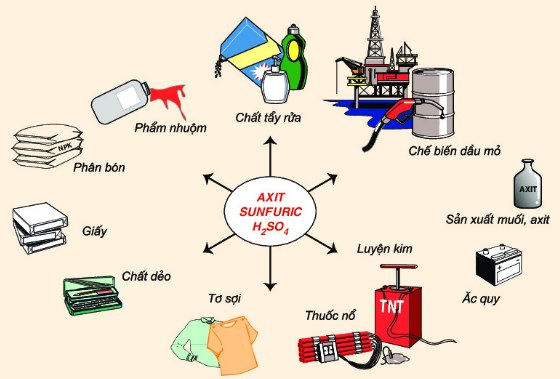 Ứng dụng của axit sunfuric
Ứng dụng của axit sunfuric
IV. Sản xuất axit sunfuric H2SO4
Trong công nghiệp, axit sunfuric được sản xuất bằng phương pháp tiếp xúc. Nguyên liệu là lưu huỳnh (hoặc quặng pirit sắt), không khí và nước.
Quá trình sản xuất axit H2SO4 gồm 3 công đoạn sau:
– Sản xuất lưu huỳnh đi oxit bằng cách đốt lưu huỳnh hoặc pirit sắt trong không khí;
S + O2 → SO2
4FeS2 + 11O2 → 8SO2 + 2Fe2O3
– Sản xuất lưu huỳnh trioxit bằng cách oxi hóa SO2, có xúc tác là V2O5 ở 4500C
2SO2 + O2 2SO3
Sản xuất axit H2SO4 bằng cách cho SO3 tác dụng với nước:
SO3 + H2O → H2SO4
Từ khóa » Tính Chất H2so4 Hcl
-
Tính Chất Và ứng Dụng Của Axit Clohidric HCl Và Axit Sunfuric H2SO4
-
So Sánh HCl Và H2SO4 Về Tính Chất Hóa Học - Mai Đào
-
Nêu Tính Chất Hoá Học Của Axit HCl, H2SO4 Loãng ...
-
SO Sánh Tính Chất Vật Lý Của HCl Và H2SO4 - Xây Nhà
-
So Sánh Tính Axit Của HCl Và H2SO4 - Thả Rông
-
Trình Bày Tính Chất Vật Lý, Tính Chất Hóa Học Của HCL, H2SO4
-
SO Sánh Tính Chất Vật Lí Của H2SO4 Và HCl - Blog Của Thư
-
Một Số Axit Quan Trọng, Axit Sunfuric H2SO4 đặc Loãng, Axit Clohidric ...
-
So Sánh HCl Và \(H_2SO_4\) Về Tính Chất Hóa Học - Hoc24
-
Nêu Tính Chất Hóa Học Của H2SO4. Viết Phương Trình. Nêu ...
-
Tính Chất Hóa Học Của Đồng Và Bài Tập Vận Dụng - Kiến Guru
-
Tính Chất Của Axit Clohidric Và Axit Sunfuric - Hóa Học 24H
-
Dạng Bài: Kim Loại Tác Dụng Với Axit (HCl, H2SO4 Loãng) | Hóa Học 9
-
Axit Là Gì? Tính Chất Và ứng Dụng Của Acid Trong Công Nghiệp