Axit Clohiđric Là Gì? Tính Chất đặc Trưng - Điều Chế - Ứng Dụng - Bilico
Có thể bạn quan tâm

Axit Clohiđric là gì?
Axit Clohidric (tên gọi bắt nguồn từ tiếng Pháp acide chlorhydrique) là hợp chất có ký hiệu hóa học là HCl và là một axit vô cơ mạnh. HCl được tạo thành từ sự hòa tan của khí hydro clorua (HCl) trong nước. Ban đầu axit này được sản xuất từ axit sulfuric và muối ăn vào thời Phục Hưng, thậm chí từ thời Trung Cổ, sau đó được các nhà hóa học Glauber, Priestley và Davy sử dụng trong các nghiên cứu khoa học của họ. Axit clohydric được tìm thấy trong dịch vị, và cũng là một trong những yếu tố gây bệnh loét dạ dày khi hệ thống tự bảo vệ của dạ dày hoạt động không hiệu quả. Một số tên hóa học khác của HCl (IUPAC) như Axit clohyđric, Axit hiđrocloric, Axit muriatic, Cloran, … Theo Wikipedia
Do tính axit mạnh nên hợp chất có khả năng ăn mòn các mô của con người. Ngoài ra còn có thể ảnh hưởng tới mắt, mũi hoặc hệ hô hấp nếu khi sử dụng không có đồ bảo hộ.
Hóa chất này được sử dụng phổ biến trong các ngành công nghiệp, hóa học, dược phẩm hoặc chế phẩm.
Axit clohiđric có tính chất như thế nào?
Hiểu rõ tính chất vật lý và hóa học của axit clohiđric giúp người sử dụng có thể nhận biết được hóa chất. Từ đó sử dụng đúng cách, đúng mục đích đảm bảo an toàn và hiệu quả nhất.
Tính chất vật lý
Là loại hóa chất có tính chất vật lý cơ bản như sau:
- Ở dạng khí, hóa chất không màu, có mùi xốc, nặng hơn không khí và tan nhiều trong nước để tạo thành dung dịch.
- Ở dạng dung dịch, ở dạng loãng không có màu, dung dịch HCl đậm đặc có nồng độ cao nhất là 40%. Ở nồng độ ấy, HCl có màu hơi vàng xanh. Dạng đậm đặc có thể tạo thành sương mù axit.
- Hòa tan trong nước: 725 g / L ở 20 ° C.
- Trọng lượng của phân tử: 36,5 g / mol.
- Khối lượng riêng của HCl là 1,18 g/cm3
- Dung dịch dễ bay hơi nhưng không dễ bốc cháy.
- HCl là dung dịch không dễ bốc cháy nhưng dễ bay hơi
Tính chất hóa học của HCl
Axit clohiđric có tính chất hóa học của một axit mạnh. Chi tiết như sau.
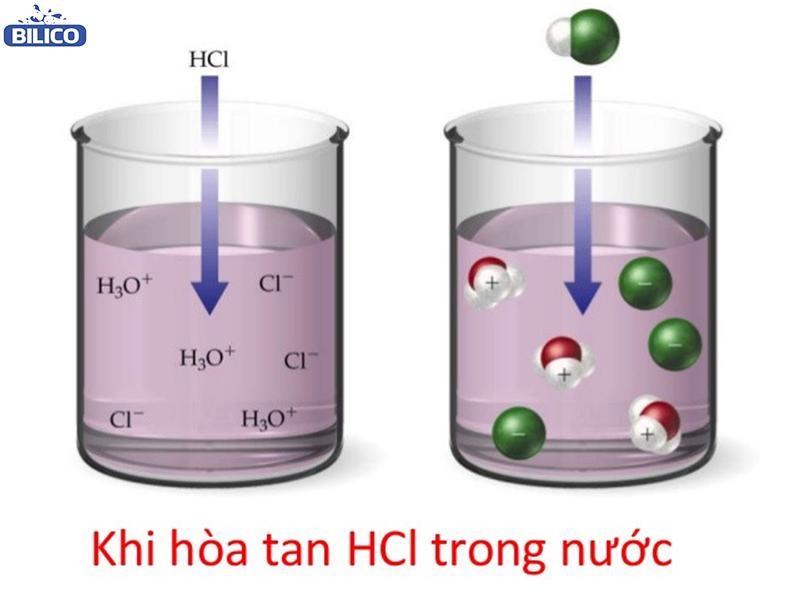
HCl + H2O → H3O + Cl
Đổi màu chất chỉ thị
Đây là tính chất hóa học của Axit Clohidric giúp nhận biết dung dịch HCl dễ dàng và nhanh chóng nhất. Khi cho quỳ tím vào dung dịch HCl, quỳ tím sẽ đổi sang đỏ.
Tác dụng với bazơ tạo thành muối và nước
Phương trình phản ứng diễn ra như sau:
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Tác dụng với 1 oxit kim loại sẽ tạo ra muối với nước
Phương trình phản ứng diễn ra như sau:
Fe3O4 + 8HCl → 4H2O + FeCl2 + 2FeCl3
CuO+ 2HCl → CuCl2 + H2O
HCl vừa mang tính axit vừa mang tính khử
Tính axit khi tác dụng với kim loại đứng trước H ở dãy hoạt động hóa học ( trừ Pb)
Phương trình phản ứng như sau:
Fe + 2HCl → FeCl2 + H2
Hcl có tính khử khi tác dụng với chất có tính oxi hóa mạnh như KMnO4, K2Cr2O7, MnO2, KClO3, …
Phương trình phản ứng như sau:
2HCl +MnO2 → MnCl2 +Cl2 +H2O
Tác dụng với muối tạo ra muối clo mới và axit mới
Phương trình phản ứng:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
AgNO3 + HCl → AgCl + HNO3
Cách điều chế Axit Clohidric
Trong phòng thí nghiệm điều chế Clohiđric là sử dụng phương pháp sunfat bằng cách cho tinh thể NaCl phản ứng với H2SO4 đặc, nung nóng (< 250oC hoặc >400oC):
NaCl + H2SO4 → NaHSO4 + HCl (< 250oC)
2NaCl + H2SO4 → Na2SO4 + 2HCl (> 400oC)
Trong công nghiệp người ta điều chế HCl phương pháp tổng hợp dưới hình thức đun nóng Hidro và Clo hoặc ở nhiệt độ phòng với điều kiện có ánh sáng. Phương trình phản ứng như sau:
H2 + Cl2 → 2HCl
- Có thể bạn quan tâm: Sodium Hypochlorite Là Gì? Ứng Dụng Của Natri Hypochlorite
Từ khóa » Sử Dụng Axit Clohiđric
-
Ứng Dụng Của Axit Clohidric Như Thế Nào Và Mua ở đâu Giá Tốt
-
Axit Clohidric Là Gì? Tính Chất, Cách điều Chế, ứng Dụng & Lưu ý Khi ...
-
Axit HCl Và Những ứng Dụng Trong đời Sống
-
Axit Clohidric Là Gì? Tính Chất, điều Chế Và ứng Dụng Của Axit ...
-
Axit Clohidric Là Gì? Tính Chất, ứng Dụng Và Mua ở đâu ... - VietChem
-
Tác Dụng Của Axit HCl Với đời Sống Của Con Người - LabVIETCHEM
-
5 Lợi ích Của Axit Clohydric đối Với Cơ Thể Ai Cũng Nên Biết
-
Axit Clohidric Là Gì? Tính Chất Hóa Học Của HCl [CHI TIẾT]
-
Công Dụng Của Axit Clohydric: Các ứng Dụng Phổ Biến Và Công Nghiệp
-
Axit Clohidric Là Gì? Ứng Dụng Của Axit HCL Trong đời Sống
-
Axit Clohiđric Có ứng Dụng Gì Trong đời Sống? - TopLoigiai
-
Tính Chất Hóa Học Axit HCL - Axit Clohidric
-
Acid Hydrochloric – Wikipedia Tiếng Việt
-
AXIT CLOHIDRIC DÙNG ĐỂ LÀM GÌ, CÁCH NHẬN BIẾT AXIT ...