Bạc ( Ag ) Hóa Trị Mấy? Cấu Tạo Của Nguyên Tử Và Tính Chất Của Ag
Có thể bạn quan tâm
Như đã biết, trong cuộc sống hiện tại xung quanh chúng ta Bạc là kim loại rất quý có giá trị lâu dài, được sử dụng làm đồng tiền xu, đồ trang sức, chén đũa và các đồ dùng trong gia đình và như một khoản đầu tư ở dạng tiền xu và nén. Bạc còn là đơn vị tiền tệ trong xã hội phong kiến Á Đông gọi là ngân lượng hay lượng bạc. Vậy Ag hóa trị mấy, Cấu tạo phân tử và tính chất của Ag ra sao. Ở Kim loại bạc còn được dùng trong công nghiệp làm chất dẫn và tiếp xúc, trong gương và trong điện phân của các phản ứng hóa học. Các hợp chất của nó được dùng trong phim ảnh và bạc nitrat pha loãng được dùng làm chất tẩy khuẩn, Thế nhưng bạn đã hiểu rõ về nguyên tử Ag này chưa, ở bài này chúng ta cùng nhau tìm hiểu kỹ về nó nhé.
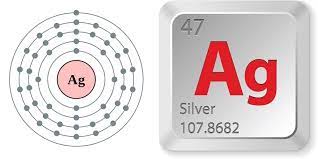
Ag hóa trị mấy?
– Bạc (Ag) có hóa trị I.
Bạc (Ag) là gì?
– Bạc đã được biết đến từ thời tiền sử, các đống xỉ chứa bạc đã được tìm thấy ở Tiểu Á và trên các đảo thuộc biển Aegean chứng minh rằng bạc đã được tách ra khỏi chì từ thiên niên kỷ thứ 4 trước công nguyên.
– Bạc là kim loại có khả năng dẫn điện và nhiệt tốt nhất trong mọi kim loại, hơn cả vàng, hơn cả đồng. Nguyên nhân của sự khác biệt này có lẽ do sự sắp xếp cấu hình electron trong phân tử. Đồng, bạc, vàng đều thuộc nhóm 11 trong bảng tuần hoàn, đều có 1 electron lớp ngoài cùng, và hơn cả là đều có liên kết kim loại rất mạnh. Điều đó khiến cho cả khối phần tử bạc hay vàng có mật độ electron chuyển động cao, tạo ra khả năng dẫn điện và nhiệt tốt hơn các kim loại chuyển tiếp khác.
Vị trí và cấu tạo của nguyên tử:
– Ký hiệu hóa học: Ag
– Nguyên tử khối: 107,87 g/mol (thường lấy là 108 g/mol).
– Số đơn vị điện tích hạt nhân: Z = 47.
– Độ âm điện: 1,93.
– Số oxi hóa: +1; +2; +3.
![]()
– Cấu hình: [Kr]4d105s1.
=> Bạc thuộc nhóm kim loại chuyển tiếp ô số 47, nhóm IB, chu kì 5.
– Tạo nên hợp chất chủ yếu gồm liên kết cộng hóa trị.
– Dạng tinh thể lập phương tâm diện.
Tính chất của Bạc :
Tính chất vật lí – Là kim loại nặng (khối lượng riêng 10,5 g/cm3), mềm, dẻo ( dễ kéo sợi và dát mỏng) và có ánh kim. Có màu trắng bạc.
– Dẫn điện, dẫn nhiệt tốt nhất trong các kim loại.
- Nhôm hóa trị mấy? kí hiệu và nguyên tử khối của Al
- Magie có hóa trị mấy ( Mg )? Tính chất hóa học và nguyên tử khối của Mg
- Natri có hóa trị mấy ( Na ) ? nguyên tử khối của Natri
– Nóng chảy ở 960,5oC; nhiệt độ sôi: 2167oC.
Tính chất hóa học:
Là kim loại kém hoạt động. Bạc có tính khử yếu nhưng ion Ag+ thì có tính oxi hóa mạnh. – Không bị oxi hóa trong không khí (kể cả nhiệt độ cao).
– Nếu không khí hoặc hơi nước có chứa 1 ít khí H2S thì bạc màu trắng trở nên xám xịt (do tạo Ag2S):
4Ag + 2H2S + O2 → 2Ag2S↓(đen) + 2H2O

– Tác dụng với Cl2 khi đun nóng → muối clorua
![]()
– Ngoài ra, Ag còn tác dụng được với P, As, S, C khi đun nóng…
– Không bị hòa tan trong dung dịch HCl, H2SO4 loãng, nhưng tác dụng được với axit có tính oxi hóa mạnh(HNO3 hay H2SO4 đặc nóng):
Ag + 2HNO3 đặc, nóng → AgNO3 + H2O + NO2
2Ag + 2H2SO4 đặc, nóng → Ag2SO4 + SO2 + 2H2O
– Tan trong muối xianua của kim loại kiềm: NaCN… khi có mặt của oxi không khí→ những anion phức bền dạng [Ag(CN)2]
4Ag + 8NaCN + 2H2O + O2 → 4Na[Ag(CN)2] + 4 NaOH
– Tạo thành hỗn hống rắn, màu trắng với thủy ngân.
Điều chế:
1. Trong phòng thí nghiệm: có sẵn
2. Trong công nghiệp:
– Bạc thô được tinh chế bằng phương pháp điện phân.
– 20% lượng bạc được điều chế từ quặng nghèo chứ Ag2S dung phương pháp xianua.
(1) nghiền khô, nghiền ướt quặng với dung dịch NaCN → bùn nhão
Ag2S + 4NaCN ⇌ 2Na[Ag(CN)2] + Na2S
(2) Na2S tác dụng với NaCN (có không khí) → quặng tan nhiều hơn:
2NaCN + 2Na2S + 2H2O + O2 ⇌ 2NaSCN + 4NaOH
(3) Dùng kẽm bụi để kết tủa bạc:
2Na[Ag(CN)2] + Zn → Na2[Zn(CN)4] + 2Ag
(4) Hòa tan Zn dư trong H2SO4 thu được bạc.
Trạng thái tự nhiên:
– Có 2 đồng vị bền là 107Ag (chiếm 51,9%) và 109Ag (chiếm 48,1%)
– Trữ lượng bạc ở vỏ trái đất chiếm 2.10-6 % tổng số nguyên tử.
– Tồn tại ở dạng tự do – những hạt kim loại tự do này gọi là kim loại tự sinh, tuy nhiên thì Bạc tự sinh rất ít. Khoáng vật chính của bạc là acgentit (Ag2S) chứa 87,1% Ag, thường lẫn trong các quặng đa kim chứa Cu, Pb, Zn.
– Bạc có trong các mỏ đa kim ở Ngân Sơn, Chợ Điền…
Ứng dụng:
– Dùng để chế tạo đồ trang sức, vật trang trí, mạ bạc cho vật liệu bằng kim loại, chế tạo linh kiện ký thuật vô tuyến, chế tạo ắc quy…
– Chế tạo hợp kim; Ag – Cu; Ag – Au… → dung làm đồ trang sức, bộ đồ ăn…
– Ion Ag+ có khả năng sát khuẩn.
Xem thêm bảng hóa trị và hóa trị của các nguyên tố :
Bảng Hóa Trị Lớp 8, Cách Học Thuộc Bằng Bài Ca Hóa Trị Hóa Học.
NO3 hóa trị mấy? Cấu tạo phân tử NO3 chuẩn
Lưu huỳnh ( S ) có mấy hóa trị, nguyên tử khối của S
Photpho ( P ) hóa trị mấy? ứng dụng và tính chất của P
Silic ( Si ) hóa trị mấy? Tính chất hóa học và ứng dụng của Silic
Từ khóa » Tính Chất Của Nguyên Tố Bạc
-
Bạc – Wikipedia Tiếng Việt
-
Tính Chất Hóa Học Của Bạc – Ảnh Hưởng Sức Khỏe Của Bạc
-
TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA BẠC (Ag)
-
Bạc Là Gì? Tính Chất Hoá Học Của Bạc Và Sự ảnh Hưởng Sức Khoẻ
-
Bạc Là Gì? Những ứng Dụng Của Bạc Trong Cuộc Sống - LabVIETCHEM
-
Tìm Hiểu Khối Lượng Riêng Của Bạc Và Những ứng Dụng Quan Trọng
-
Lý Thuyết Về Bạc Và Hợp Chất - Học Hóa Online
-
Nguyên Tử Khối Của Bạc (Ag) - Bierelarue
-
Bạc – Những điều Cần Biết - Vật Lý 360 độ
-
Đi Tìm 'bí Mật' Của Kim Loại Bạc - Tuổi Trẻ Online
-
Bạc- Kim Loại Quý ứng Dụng Trong Y Học - Báo Sức Khỏe & Đời Sống
-
Bài Tiểu Luận Tìm Hiểu Nguyên Tố Bạc Ag - Tài Liệu Text - 123doc
-
20 Sự Thật Về Nguyên Tố Hóa Học Bạc