Bài Tập Về Oxit Axit Tác Dụng Dunh Dịch Kiềm, Oxit Bazơ Tác Dụng Với ...
Có thể bạn quan tâm
- Trang chủ
- Tin tức mới
- Kiến thức THCS
- Trung học CS lớp 9
- Môn Hoá 9
- Bài tập về Oxit axit tác dụng dunh dịch kiềm, Oxit bazơ tác dụng với Axit - Hóa 9 chuyên đề
Oxit Axit và Oxit bazơ là những chất hóa học quan trọng, tham gia vào rất nhiều quá trình phản ứng khi các em học hóa học vô cơ, vì vậy đây là nội dung mà các em nên dành nhiều thời gian để học thật kỹ.
Nội dung bài viết này chúng ta sẽ cùng ôn lại một số kiến thức về Oxit, hệ thống lại các dạng bài tập về Oxit axit tác dụng với dung dịch kiểm, và ngược lại bài tập Oxit bazơ tác dụng với dung dịch axit để các em hiểu rõ hơn.
I. Kiến thức cần nhớ về Oxit, phân loại oxit
1. Oxit bazơ là những oxit tác dụng với dung dịch axit tạo thành muối và nước.
* Ví dụ: Na2O, BaO, MgO,...
2. Oxit axit là những oxit tác dụng với dung dịch bazơ tạo thành muối và nước.
* Ví dụ: CO2, SO2, SO3,...
3. Oxit lưỡng tính là những oxit tác dụng với dung dịch axit và tác dụng với dung dịch bazơ tạo thành muối và nước.
* Ví dụ: Al2O3, ZnO, SnO, PbO
4. Oxit trung tính hay còn gọi là oxit không tạo muối là những oxit không tác dụng với axit, bazơ, nước
* Ví dụ: CO, NO,...
II. Các dạng bài tập Oxit
° Dạng 1: Bài toán Oxit bazơ tác dụng với dung dịch axit
* Phương pháp giải:
Để giải bài tập dạng này ta thực hiện các bước sau:
- Bước 1: Viết phương trình phản ứng: Oxit bazo + axit → muối + H2O
* Ví dụ: CaO + HCl → CaCl2 + H2O
Fe2O3 + H2SO4 → Fe2(SO4)3 + H2O
- Bước 2: Xác định số mol lượng chất đề bài cho sẵn
- Bước 3: Từ phương trình hóa học, áp dụng thêm một số định luật khác như: bảo toàn khối lượng, bảo toàn nguyên tố để giải quyết yêu cầu của đề bài
* Bài tập 1: Hòa tan vừa đủ 5,6 gam CaO vào dung dịch HCl 14,6% . Khối lượng dung dịch HCl đã dùng là bao nhiêu?
Xem lời giải
• Đề bài: Hòa tan vừa đủ 5,6 gam CaO vào dung dịch HCl 14,6% . Khối lượng dung dịch HCl đã dùng là bao nhiêu?
• Lời giải:
- Theo bài ra, ta có: nCaO = m/M = 5,6/56 = 0,1 (mol).
- PTHH: CaO + 2HCl → CaCl2 + H2O
1 mol 2mol
0,1 mol → x mol
- Theo PTPƯ ta có nHCl = 2nCaO = 2.0,1 = 0,2(mol)
⇒ mHCl = n.M = 0,2.36,5 = 7,3 (g)
Từ công thức: 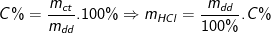
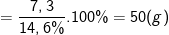
⇒ Khối lượng dung dịch HCl đã dùng là 50(g).
* Bài tập 2: Hòa tan hoàn toàn 10 gam MgO cần dùng vừa đủ 400 ml dung dịch HCl aM thu được dung dịch X. Giá trị của a là bao nhiêu?
Xem lời giải
• Đề bài: Hòa tan hoàn toàn 10 gam MgO cần dùng vừa đủ 400 ml dung dịch HCl aM thu được dung dịch X. Giá trị của a là bao nhiêu?
• Lời giải:
- Theo bài ra, ta có: nMgO = m/M = 10/40 = 0,25 (mol).
- PTHH: MgO + 2HCl → MgCl2 + H2O
1 mol 2mol
0,25 → x? mol
⇒ Theo PTPƯ: nHCl = 2nMgO = 2.0,25 = 0,5(mol).
- Nồng độ của dung dịch HCl là: 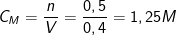
* Bài tập 3: Hòa tan hoàn toàn 14,4 gam FeO cần vừa đủ V ml dung dịch HCl 2M. Giá trị của V là bao nhiêu?
Xem lời giải
• Đề bài: Hòa tan hoàn toàn 14,4 gam FeO cần vừa đủ V ml dung dịch HCl 2M. Giá trị của V là bao nhiêu?
• Lời giải:
- Theo bài ra, ta có: nFeO = m/M = 14,4/72 = 0,2(mol).
- PTPƯ: FeO + 2HCl → FeCl2 + H2O
1mol 2mol
0,2 → x? mol
- Theo PTPƯ, ta có: nHCl = 2nFeO = 2.0,2 = 0,4(mol).
- Từ công thức: 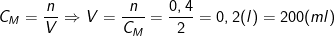
⇒ Thể tích dung dịch HCl 2M cần dùng để hòa tan hoàn toàn 14,4 gam FeO là 200(ml).
° Dạng 2: Bài toán Oxit axit tác dụng với dung dịch kiềm
- Dung dịch kiềm là dung dịch bazo tan gồm có: NaOH, KOH, Ba(OH)2, Ca(OH)2,...
* Phương pháp giải:
Tương tự như dạng 1, ta thực hiện các bước sau:
- Bước 1: Viết PTHH: Oxit axit + dung dịch kiềm ⇒ muối + H2O
*Ví dụ: CO2 + Ca(OH)2 → H2O + CaCO3↓
- Bước 2: Xác định số mol lượng chất đề bài cho sẵn
- Bước 3: Từ phương trình hóa học, áp dụng thêm một số định luật khác như: bảo toàn khối lượng, bảo toàn nguyên tố để giải quyết yêu cầu của đề bài
* Bài tập 1: Cho 1,68 lít CO2 (đktc) sục vào bình đựng 250 ml dung dịch KOH dư. Biết thể tích dung dịch trước và sau phản ứng không thay đổi Nồng độ mol/lit của muối thu được sau phản ứng là bao nhiêu?
Xem lời giải
• Đề bài: Cho 1,68 lít CO2 (đktc) sục vào bình đựng 250 ml dung dịch KOH dư. Biết thể tích dung dịch trước và sau phản ứng không thay đổi Nồng độ mol/lit của muối thu được sau phản ứng là bao nhiêu?
• Lời giải:
- Theo bài ra: ta có: nCO2 = V/22,4 = 1,68/22,4 = 0,075 (mol).
- Vì KOH dư nên phản ứng tạo ra muối trung hòa
CO2 + 2KOH → K2CO3 + H2O
1mol 1mol
0,075 → x?mol
- Theo PTPƯ: nK2CO3 = nCO2 = 0,075(mol)
- Vì thể tích dung dịch trước và sau không thay đổi ⇒ Vdd = 250 ml = 0,25 lít
⇒ Nồng độ muối thu được sau phản ứng là: 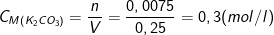
* Bài tập 2: Dùng 400ml dung dịch Ba(OH)2 0,1M hấp thụ hoàn toàn V lít khí SO2 (đktc). Sau phản ứng thu được muối BaSO3 không tan. Giá trị bằng số của V là bao nhiêu?
Xem lời giải
• Đề bài: Dùng 400ml dung dịch Ba(OH)2 0,1M hấp thụ hoàn toàn V lít khí SO2 (đktc). Sau phản ứng thu được muối BaSO3 không tan. Giá trị bằng số của V là bao nhiêu?
• Lời giải:
- Theo bài ra, ta có: VBa(OH)2 = 400(ml) = 0,4(l).
⇒ nBa(OH)2 = CM.V = = 0,1.0,4 = 0,04 (mol).
- Có PTPƯ:
SO2 + Ba(OH)2 → BaSO3 + H2O
1(mol) 1(mol)
x?mol 0,04 mol
- Theo PTPƯ: nSO2= nBa(OH)2 = 0,04 (mol).
⇒ VSO2 = nCO2.22,4 = 0,04 . 22,4 = 0,896(lít).
° Dạng 3: Bài toán giữa các Oxit
* Phương pháp giải:
Vận dụng các phương trình phản ứng:
- Nhiều oxit axit tác dụng với nước tạo thành dung dịch axit.
* Ví dụ: SO3 + H2O → H2SO4
- Một số oxit bazơ tác dụng với nước tạo thành dung dịch bazơ (kiềm).
* Ví dụ: Na2O + H2O → 2NaOH
- Oxit axit tác dụng với một số oxit bazơ (tan) tạo thành muối.
* Ví dụ: CO2 + BaO → BaCO3
* Bài tập 1: Cho 8 gam lưu huỳnh trioxit (SO3) tác dụng với H2O, thu được 250 ml dung dịch axit sunfuric (H2SO4). Nồng độ mol của dung dịch axit thu được là bao nhiêu?
Xem lời giải
• Đề bài: Cho 8 gam lưu huỳnh trioxit (SO3) tác dụng với H2O, thu được 250 ml dung dịch axit sunfuric (H2SO4). Nồng độ mol của dung dịch axit thu được là bao nhiêu?
• Lời giải:
- Theo bài ta, ta có: nSO3 = 8/80 = 0,1(mol).
- Có PTHH:
SO3 + H2O → H2SO4
1(mol) 1mol
0,1 → x? mol
- Theo PTPƯ thì nH2SO4 = nSO3 = 0,1 (mol).
⇒ Nồng độ mol của dd axit sunfuric H2SO4 thu dược là:
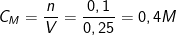
* Bài tập 2: Cho 20 gam hỗn hợp Na2O và CuO tác dụng hết với 3,36 lít SO2(đktc). Sau phản ứng thấy thu được một chất rắn không tan. Thành phần phần trăm theo khối lượng của 2 oxit trong hỗn hợp lần lượt là bao nhiêu?
Xem lời giải
• Đề bài: Cho 20 gam hỗn hợp Na2O và CuO tác dụng hết với 3,36 lít SO2(đktc). Sau phản ứng thấy thu được một chất rắn không tan. Thành phần phần trăm theo khối lượng của 2 oxit trong hỗn hợp lần lượt là bao nhiêu?
• Lời giải:
PTPƯ: Na2O + SO2 → Na2SO3
nNa2O = nSO2=3,36:22,4=0,15(mol)
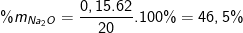
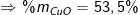
> Lưu ý: CuO không phản ứng được với SO2.
Như vậy, với 3 dạng toán điểm hình: Oxit axit tác dụng với dụng dịch kiểm, Oxit bazo tác dụng với dung dịch axit và bài tập phản ứng giữa các oxit với nhau. Hy vọng các em sẽ hiểu rõ và vận dụng tốt để chuẩn bị cho các bài học tiếp theo. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để ghi nhận và hỗ trợ, chúc các em học tốt.
¤ Xem thêm các bài viết khác tại:
» Mục lục bài viết SGK Hóa 9 Lý thuyết và Bài tập
» Mục lục bài viết SGK Vật lý 9 Lý thuyết và Bài tập
TweetTags:
- Hóa học 9 chương 1
- Các loại hợp chất vô cơ
- Bài tập hóa 9
- Chuyên đề hóa 9
- Các dạng bài tập hóa 9
- Oxit axit
- Oxit bazo
Đánh giá & nhận xét
-
 Tính chất hoá học của Oxide, Acid, Base và Muối - Hoá lớp 9
Tính chất hoá học của Oxide, Acid, Base và Muối - Hoá lớp 9 -
 Giải KHTN 9 trang 134 Chân trời sáng tạo SGK
Giải KHTN 9 trang 134 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 132 Chân trời sáng tạo SGK
Giải KHTN 9 trang 132 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 131 Chân trời sáng tạo SGK
Giải KHTN 9 trang 131 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 130 Chân trời sáng tạo SGK
Giải KHTN 9 trang 130 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 129 Chân trời sáng tạo SGK
Giải KHTN 9 trang 129 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 128 Chân trời sáng tạo SGK
Giải KHTN 9 trang 128 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 127 Chân trời sáng tạo SGK
Giải KHTN 9 trang 127 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 126 Chân trời sáng tạo SGK
Giải KHTN 9 trang 126 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 125 Chân trời sáng tạo SGK
Giải KHTN 9 trang 125 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 124 Chân trời sáng tạo SGK
Giải KHTN 9 trang 124 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 123 Chân trời sáng tạo SGK
Giải KHTN 9 trang 123 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 122 Chân trời sáng tạo SGK
Giải KHTN 9 trang 122 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 121 Chân trời sáng tạo SGK
Giải KHTN 9 trang 121 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 120 Chân trời sáng tạo SGK
Giải KHTN 9 trang 120 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 119 Chân trời sáng tạo SGK
Giải KHTN 9 trang 119 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 118 Chân trời sáng tạo SGK
Giải KHTN 9 trang 118 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 117 Chân trời sáng tạo SGK
Giải KHTN 9 trang 117 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 116 Chân trời sáng tạo SGK
Giải KHTN 9 trang 116 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 115 Chân trời sáng tạo SGK
Giải KHTN 9 trang 115 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 114 Chân trời sáng tạo SGK
Giải KHTN 9 trang 114 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 113 Chân trời sáng tạo SGK
Giải KHTN 9 trang 113 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 112 Chân trời sáng tạo SGK
Giải KHTN 9 trang 112 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 111 Chân trời sáng tạo SGK
Giải KHTN 9 trang 111 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 110 Chân trời sáng tạo SGK
Giải KHTN 9 trang 110 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 109 Chân trời sáng tạo SGK
Giải KHTN 9 trang 109 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 108 Chân trời sáng tạo SGK
Giải KHTN 9 trang 108 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 107 Chân trời sáng tạo SGK
Giải KHTN 9 trang 107 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 106 Chân trời sáng tạo SGK
Giải KHTN 9 trang 106 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 105 Chân trời sáng tạo SGK
Giải KHTN 9 trang 105 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 104 Chân trời sáng tạo SGK
Giải KHTN 9 trang 104 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 103 Chân trời sáng tạo SGK
Giải KHTN 9 trang 103 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 102 Chân trời sáng tạo SGK
Giải KHTN 9 trang 102 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 100 Chân trời sáng tạo SGK
Giải KHTN 9 trang 100 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 99 Chân trời sáng tạo SGK
Giải KHTN 9 trang 99 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 98 Chân trời sáng tạo SGK
Giải KHTN 9 trang 98 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 97 Chân trời sáng tạo SGK
Giải KHTN 9 trang 97 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 96 Chân trời sáng tạo SGK
Giải KHTN 9 trang 96 Chân trời sáng tạo SGK -
 Giải KHTN 9 trang 95 Chân trời sáng tạo SGK
Giải KHTN 9 trang 95 Chân trời sáng tạo SGK
| » Giải Toán 6 SGK Cánh Diều tập 2 » Giải Toán 6 SGK Chân trời tập 2 » Giải Toán 6 SGK Kết nối tập 2 |
| » Giải Toán 7 SGK Cánh Diều tập 2 » Giải Toán 7 SGK Chân trời tập 2 » Giải Toán 7 SGK Kết nối tập 2 |
| » Giải Toán 8 SGK Cánh Diều tập 2 » Giải Toán 8 SGK Chân trời tập 2 » Giải Toán 8 SGK Kết nối tập 2 |
| » Giải Toán 10 SGK Cánh Diều tập 2 » Giải Toán 10 SGK Chân trời tập 2 » Giải Toán 10 SGK Kết nối tập 2 |
| » Giải Toán 11 SGK Cánh Diều tập 2 » Giải Toán 11 SGK Chân trời tập 2 » Giải Toán 11 SGK Kết nối tập 2 |
| » Giải Bài tập Vật Lí 10 SGK Chân trời sáng tạo » Lý thuyết Vật Lí 10 SGK Chân trời sáng tạo |
| » Giải Bài tập Hóa học 10 SGK Chân trời sáng tạo » Lý thuyết Hóa học 10 SGK Chân trời sáng tạo |
 Bài 18 trang 58 Toán 9 tập 1 Chân trời sáng tạo
Bài 18 trang 58 Toán 9 tập 1 Chân trời sáng tạo  Bài 17 trang 58 Toán 9 tập 1 Chân trời sáng tạo
Bài 17 trang 58 Toán 9 tập 1 Chân trời sáng tạo  Bài 16 trang 58 Toán 9 tập 1 Chân trời sáng tạo
Bài 16 trang 58 Toán 9 tập 1 Chân trời sáng tạo  Bài 15 trang 58 Toán 9 tập 1 Chân trời sáng tạo
Bài 15 trang 58 Toán 9 tập 1 Chân trời sáng tạo  Bài 14 trang 58 Toán 9 tập 1 Chân trời sáng tạo Tin cùng chuyên mục
Bài 14 trang 58 Toán 9 tập 1 Chân trời sáng tạo Tin cùng chuyên mục  Tính chất hoá học của Oxide, Acid, Base và Muối - Hoá lớp 9
Tính chất hoá học của Oxide, Acid, Base và Muối - Hoá lớp 9  Giải KHTN 9 trang 134 Chân trời sáng tạo SGK
Giải KHTN 9 trang 134 Chân trời sáng tạo SGK  Giải KHTN 9 trang 132 Chân trời sáng tạo SGK
Giải KHTN 9 trang 132 Chân trời sáng tạo SGK  Giải KHTN 9 trang 131 Chân trời sáng tạo SGK
Giải KHTN 9 trang 131 Chân trời sáng tạo SGK  Giải KHTN 9 trang 130 Chân trời sáng tạo SGK Tin xem nhiều nhất
Giải KHTN 9 trang 130 Chân trời sáng tạo SGK Tin xem nhiều nhất  Các dạng toán về phương trình đường thẳng trong mặt phẳng, bài tập vận dụng - Toán lớp 10
Các dạng toán về phương trình đường thẳng trong mặt phẳng, bài tập vận dụng - Toán lớp 10  Cách tìm giá trị lớn nhất (GTLN) và giá trị nhỏ nhất (GTNN) của biểu thức - Toán lớp 9
Cách tìm giá trị lớn nhất (GTLN) và giá trị nhỏ nhất (GTNN) của biểu thức - Toán lớp 9  Toán 11 - Giới hạn của hàm số, cách tính và bài tập áp dụng
Toán 11 - Giới hạn của hàm số, cách tính và bài tập áp dụng  Chuyển động tròn đều, Công thức tính Tốc độ góc, Tốc độ dài và Gia tốc hướng tâm - Vật lý 10 bài 5
Chuyển động tròn đều, Công thức tính Tốc độ góc, Tốc độ dài và Gia tốc hướng tâm - Vật lý 10 bài 5  Các dạng toán về phương trình đường thẳng trong không gian oxyz và bài tập - Toán lớp 12 Tuyển sinh
Các dạng toán về phương trình đường thẳng trong không gian oxyz và bài tập - Toán lớp 12 Tuyển sinh  Phổ điểm khối D07 (D7) 2025 thi tốt nghiệp THPT Ngày 15/7 Bộ Giáo dục và Đào tạo công bố phổ điểm...
Phổ điểm khối D07 (D7) 2025 thi tốt nghiệp THPT Ngày 15/7 Bộ Giáo dục và Đào tạo công bố phổ điểm...  Phổ điểm khối C03 (C3) 2025 thi tốt nghiệp THPT
Phổ điểm khối C03 (C3) 2025 thi tốt nghiệp THPT  Phổ điểm khối C01 (C1) 2025 thi tốt nghiệp THPT Xem thêm Kiến thức THPT
Phổ điểm khối C01 (C1) 2025 thi tốt nghiệp THPT Xem thêm Kiến thức THPT  Bài 7.15 trang 43 Toán 11 tập 2 Kết nối tri thức Bài tập 7.15, trang 43 SGK Toán 11 Tập 2 (Kết nối tri...
Bài 7.15 trang 43 Toán 11 tập 2 Kết nối tri thức Bài tập 7.15, trang 43 SGK Toán 11 Tập 2 (Kết nối tri...  Bài 7.14 trang 43 Toán 11 tập 2 Kết nối tri thức
Bài 7.14 trang 43 Toán 11 tập 2 Kết nối tri thức  Bài 7.13 trang 43 Toán 11 tập 2 Kết nối tri thức Xem thêm Kiến thức THCS
Bài 7.13 trang 43 Toán 11 tập 2 Kết nối tri thức Xem thêm Kiến thức THCS  Bài 7.6 trang 32 Toán 8 Tập 2 Kết nối tri thức Bài tập 7.6, trang 32 SGK Toán 8 Tập 2 (Kết nối tri...
Bài 7.6 trang 32 Toán 8 Tập 2 Kết nối tri thức Bài tập 7.6, trang 32 SGK Toán 8 Tập 2 (Kết nối tri...  Bài 7.5 trang 32 Toán 8 Tập 2 Kết nối tri thức
Bài 7.5 trang 32 Toán 8 Tập 2 Kết nối tri thức  Bài 7.4 trang 32 Toán 8 Tập 2 Kết nối tri thức Xem thêm Trắc nghiệm online
Bài 7.4 trang 32 Toán 8 Tập 2 Kết nối tri thức Xem thêm Trắc nghiệm online  Toán 6 - Luỹ thừa
Toán 6 - Luỹ thừa  Toán 7 - số hữu tỉ
Toán 7 - số hữu tỉ  Toán THPT QG 2017 Xem thêm Tin học
Toán THPT QG 2017 Xem thêm Tin học  Cách so sánh 2 file Word nhanh bằng lệnh Compare để tìm sự khác biệt giữa 2 văn bản Nếu đã làm việc với máy tính, có lẽ việc soạn...
Cách so sánh 2 file Word nhanh bằng lệnh Compare để tìm sự khác biệt giữa 2 văn bản Nếu đã làm việc với máy tính, có lẽ việc soạn...  Cách sử dụng hàm index và match - how to use index and match in...
Cách sử dụng hàm index và match - how to use index and match in...  Cách sử dụng hàm IF nhiều điều kiện - How to use IF function... Xem thêm Ngoại ngữ
Cách sử dụng hàm IF nhiều điều kiện - How to use IF function... Xem thêm Ngoại ngữ  Cách dùng say và tell trong câu gián tiếp, Sự khác nhau giữa tell và say trong câu gián tiếp Trong tiếng Anh, việc sử dụng đúng các động từ thể...
Cách dùng say và tell trong câu gián tiếp, Sự khác nhau giữa tell và say trong câu gián tiếp Trong tiếng Anh, việc sử dụng đúng các động từ thể...  Cách dùng thì hiện tại đơn, công thức và bài tập áp...
Cách dùng thì hiện tại đơn, công thức và bài tập áp...  Cách dùng thì hiện tại tiếp diễn, công thức và bài tập... Xem thêm Hướng nghiệp
Cách dùng thì hiện tại tiếp diễn, công thức và bài tập... Xem thêm Hướng nghiệp  Trí Tuệ Nhân Tạo (AI) – Ngành Học Triển Vọng Trong Kỷ Nguyên Số AI (Artificial Intelligence) là ngành khoa học phát triển...
Trí Tuệ Nhân Tạo (AI) – Ngành Học Triển Vọng Trong Kỷ Nguyên Số AI (Artificial Intelligence) là ngành khoa học phát triển...  Ngành Công Nghệ Thông Tin – Học Gì? Làm Gì? Cơ Hội Nghề...
Ngành Công Nghệ Thông Tin – Học Gì? Làm Gì? Cơ Hội Nghề...  Ưu và nhược điểm của 5 ngành học Hot hiện nay Xem thêm Góc chia sẻ - giải trí
Ưu và nhược điểm của 5 ngành học Hot hiện nay Xem thêm Góc chia sẻ - giải trí  16 Best Places to visit in Ho Chi Minh City in 3 days Ho Chi Minh City is one of the most dynamic spots in Vietnam. There...
16 Best Places to visit in Ho Chi Minh City in 3 days Ho Chi Minh City is one of the most dynamic spots in Vietnam. There...  Mục lục Ngữ Văn 11 Cánh Diều Tập 2 SGK
Mục lục Ngữ Văn 11 Cánh Diều Tập 2 SGK  Mục lục Ngữ Văn 11 Cánh Diều Tập 1 SGK Xem thêm Video Xem thêm
Mục lục Ngữ Văn 11 Cánh Diều Tập 1 SGK Xem thêm Video Xem thêm 





Từ khóa » Chuyên đề Oxit Axit Tác Dụng Với Bazo
-
Oxit Axit Tác Dụng Với Bazo - Chuyên đề Hóa Học Lớp 9
-
Dạng Bài: Oxit Axit Tác Dụng Với Dung Dịch Bazơ | Hóa Học 9 - Tech12h
-
Bài Tập Oxit Axit Tác Dụng Với Bazơ Ôn Tập Hóa Học 9
-
Các Dạng Bài Tập Oxit Axit Tác Dựng Với Oxit Bazo Hóa 9 - TopLoigiai
-
Các Dạng Bài Tập Oxit Axit Tác Dụng Với Oxit Bazo - TopLoigiai
-
Chuyên đề Oxit Axit Tác Dụng Với Dung Dịch Kiềm Môn Hóa Học 9
-
Chuyên đề 3:Oxit Axit Tác Dụng Với Dung Dịch Bazo (P1) - YouTube
-
Oxit Axit Tác Dụng Với Dung Dịch Kiềm- Bồi Dưỡng Học Sinh Giỏi Hóa ...
-
Chuyên đề. Oxit Axit Tác Dụng Với Dung Dịch Bazơ - Tài Liệu Text
-
Chuyên đề Giải Bài Tập Oxit Axit Tác Dụng Với ... - Thư Viện Hỏi Đáp
-
Phương Pháp Giải Dạng Bài Tập Oxit Axit Tác Dụng Với Bazơ Môn Hóa ...
-
[DOC] I- Cơ Sở Lý Thuyết Về Phản ứng Oxit Axit Tác Dụng Với Kiềm
-
Dạng Bài: Oxit Axit Tác Dụng Với Dung Dịch Bazơ
-
Chuyên đề Giải Bài Tập Oxit Axit Tác Dụng Với Bazơ Môn ... - Ôn Thi HSG