Cách Tính PH Ra Kết Quả Chính Xác - Bilico
Có thể bạn quan tâm
- Tính Nồng độ Dung Dịch Sau Phản ứng
- Tính Nồng độ đương Lượng
- Tính Nồng độ đương Lượng Của Dd H2so4 Có Nồng độ 0 10 M Trong Phản ứng H2so4 + 2naoh → Na2so4 + H2o
- Tính Nồng độ đương Lượng Của Dung Dịch H2so4 20 Biết D = 1 14g/ml
- Tính Nồng độ đương Lượng Của Dung Dịch H2so4 98 D = 1 84g/ml Trong Phản ứng Với Kiềm Naoh

pH là gì?
Theo Wikipedia, pH là một đại lượng chỉ mức hoạt độ của ion H+ (hidro). Dựa vào thang đo pH chúng ta có thể biết được dung dịch có tính kiềm (pH>7) hay là tính axit (pH<7). Một dung dịch có độ pH càng nhỏ thì tính axit của nó càng cao và ngược lại thì tính kiềm của nó sẽ càng lớn. Để xác định được độ pH, chúng ta cùng tham khảo qua một số cách tính pH dưới đây.
Độ pH xuất phát từ thuật ngữ tiếng Pháp “pouvoir hydrogène”. Trong tiếng Anh, pH có thể là viết tắt của từ “hydrogen power”, “power of hydrogen”, hoặc “potential of hydrogen”. Tất cả các thuật ngữ này đều đúng về mặt kỹ thuật.
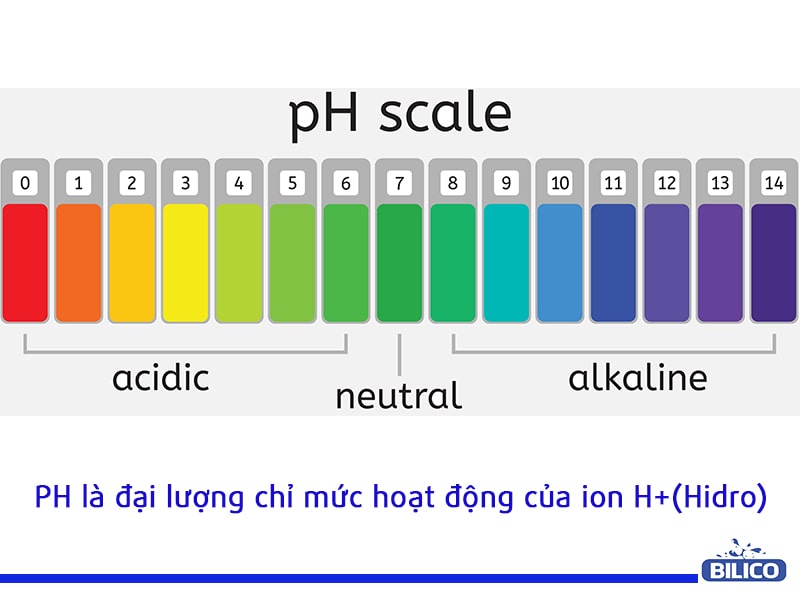
Trong các hệ dung dịch nước, hoạt độ của ion hiđrô được quyết định bởi hằng số điện ly của nước (Kw) = 1,008 × 10−14 ở 25 °C) và tương tác với các ion khác có trong dung dịch. Do hằng số điện ly này nên một dung dịch trung hòa có pH xấp xỉ 7. Các dung dịch nước có giá trị pH nhỏ hơn 7 được coi là có tính axít. Trong khi các giá trị pH lớn hơn 7 được coi là có tính kiềm. (Theo: wikipedia)
Công thức tính PH
Cách tính pH hóa 11 được thực hiện bởi công thức sau:
- Tính pH của dung dịch axit bằng cách xác định nồng độ mol/l của H+ trong dung dịch ở trạng thái cân bằng, cụ thể như sau:
pH= −lg([H+])
- Tính pH của dung dịch bazo bằng cách xác định nồng độ mol/l của ion OH- trong dung dịch ở trạng thái cân bằng:
pH = 14 – pOH
Trong dung môi nước luôn có:
pH + pOH = 14 hay [H+][OH–] = 10-14
Trong đó:
[H+] là biểu thị hoạt độ của các ion H+ (hay chính xác hơn là [H3O+], được đo theo mol/lít (còn gọi là phân tử gam). Trong các dung dịch loãng (như nước sông hay từ vòi nước) thì hoạt động xấp xỉ bằng nồng độ của ion H+.
[OH–] là biểu thị hoạt độ của các ion OH– (ion hydroxit) cũng được đo theo đơn vị mol/l.
– Log là biểu thị lôgarit cơ số 10, và pH được định nghĩa là thang đo lôgarit của tính axít.
Nói cách khác pH là chỉ số biểu thị độ hoạt động của các ion H+ trong dung dịch, thang đo pH có giá trị từ 1 – 14.
Vì vậy, căn cứ vào chỉ số trên thang đo pH để xác định dung dịch có tính axit hay tính bazơ. Mức pH của nước là 7 thường được dùng làm mức chuẩn. Như vậy, nếu giá trị <7 thì dung dịch đó có tính axit, ngược lại nếu giá trị đo được >7 thì dung dịch có tính bazơ (kiềm).
Ví dụ: Hòa tan hoàn toàn 3,65 gam HCl vào nước thu được 1 lít dung dịch: Tính pH của dung dịch đó:
Cách giải:
Số mol của HCl là:
nHCl = m/M = 3,65/36,5 = 0,1 (mol)
Phương trình điện ly
HCl → H+ + Cl–
Từ khóa » Tính Nồng độ Dựa Vào Ph
-
Công Thức Tính PH - Các Cách Tính Nồng độ PH [Chính Xác Nhất]
-
Cách Tính PH - Công Thức Tính Nồng độ PH (CHUẨN NHẤT) - Tafuma
-
Nồng độ Ph Là Gì? Công Thức Tính Nồng độ Ph Trong Các Loại Dung Dịch
-
Cong Thuc Tinh PH - Các Công Thức Tính Nồng độ PH “hay Nhất”
-
Công Thức Tính PH (TOÀN BỘ) Cách Tính Nồng Bộ PH Chuẩn
-
Công Thức Tính PH Và Hướng Dẫn Giải Bài Tập Về độ PH
-
Tính Nồng độ H+, OH- Và PH Của Dung Dịch
-
PH Là Gì? Công Thức Tính PH - Bài Tập Về PH Có đáp án
-
Tính Nồng độ Mol/l Khi Biết PH [đã Giải] - Học Hóa Online
-
Từ Ph Suy Ra Nồng độ Mol - Daihoangde
-
Cong Thuc Tinh PH – Các Công Thức Tính Nồng độ PH “hay Nhất”
-
Độ PH Là Gì? Cách Tính độ PH & Độ PH Của Một Số Dung Dịch
-
Công Thức Tính độ PH Của Dung Dịch CHÍNH XÁC NHẤT - Tafuma
-
Cách Tính Nồng độ Ion H+ - Hỏi Đáp