Cấu Tạo Phân Tử, Tính Chất Vật Lý Và Hóa Học Của Benzen (C6H6)
Benzen (C6H6) là một hidrocacbon thơm có nhiều ứng dụng trong đời sống và trong công nghiệp. Ngoài ra, nó là một dung môi hữu cơ được sử dụng khá phổ biến. Nó có cấu tạo khác với metan, etilen hay axetilen. Vậy benzen có cấu tạo phân tử như thế nào? Những tính chất vật lý và hóa học của benzen có gì đặc biệt? Chúng ta sẽ cùng tìm hiểu chúng trong bài viết hôm nay nhé!
benzen-c6h6
Xem thêm:
- Tính chất vật lý và hóa học của metan
- Tính chất vật lý và hóa học của etilen
- Tính chất vật lý và hóa học của axetilen
Tóm tắt nội dung
- Tính chất vật lý và hóa học của Benzen
- I. Tính chất vật lý của benzen
- II. Cấu tạo phân tử của benzen
- III. Tính chất hóa học của benzen
- 1. Phản ứng cháy của benzen
- 2. Phản ứng thế của benzen
- 3. Phản ứng cộng của benzen
- IV. Ứng dụng của benzen
- V. Điều chế của benzen
- Giải bài tập về của benzen
Tính chất vật lý và hóa học của Benzen
I. Tính chất vật lý của benzen
Benzen (C6H6) là một chất lỏng không màu, nhẹ hơn nước và không tan trong nước. Benzen hòa tan được nhiều chất như: dầu ăn, cao su, nến, iot… và nhiều dung môi hữu cơ khác. Benzen độc và dể cháy.
C6H6 có khối lượng riêng bằng 0,8786 kg/m3, nóng chảy ở 5,5 °C, sôi ở 80,1 °C.
II. Cấu tạo phân tử của benzen
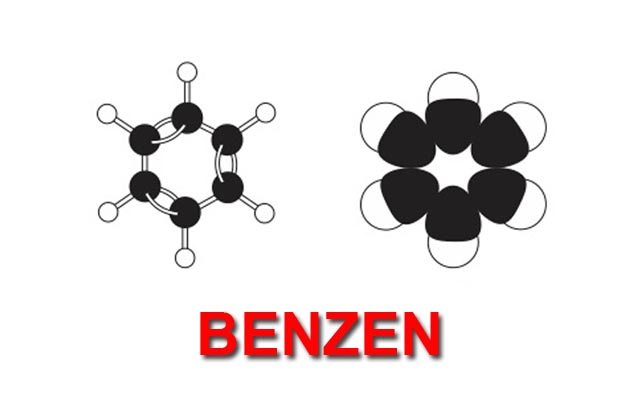
Benzen là một hidrocacbon mạch vòng có công thức phân tử là C6H6 và phân tử khối bằng 78 g/mol. Công thức cấu tạo của C6H6 là:
tinh-chat-vat-ly-va-hoa-hoc-cua-benzen
Trong công thức cấu tạo của benzen, 6 nguyên tử C liên kết với nhau tạo nên cấu trúc phân tử vòng 6 cạnh. Trong phân tử C6H6 có 3 liên kết đơn xen kẻ 3 liên kết đôi.
III. Tính chất hóa học của benzen
Benzen có những phản ứng hóa học đặc trưng như phản ứng cháy, phản ứng thế, phản ứng cộng. C6H6 vừa có phản ứng thế vừa có phản ứng cộng nhưng phản ứng cộng xảy ra khó hơn so với C2H4 và C2H2.
1. Phản ứng cháy của benzen
Tương tự các hidrocacbon khác như, benzen cháy trong oxi tạo ra CO2 và hơi nước. Tuy nhiên, khi benzen cháy trong không khí, ngoài CO2 và hơi nước thì còn có muội than sinh ra.
2C6H6 + 15O2 (t°) → 12CO2 + 6H2O
2. Phản ứng thế của benzen
Benzen cho phản ứng thế với halogen khi có mặt của bột sắt và đun nóng.
C6H6 + Br2 (t°, Bột Fe) → C6H5Br (không màu) + HBr
3. Phản ứng cộng của benzen
Benzen không có phản ứng cộng với dung dịch Br2 như C2H4 và C2H2. Trong điều kiện t° và xúc tác thích hợp, C6H6 tham gia phản ứng cộng với một số chất như H2,…
C6H6 + 3H2 (t°, Ni) → C6H12
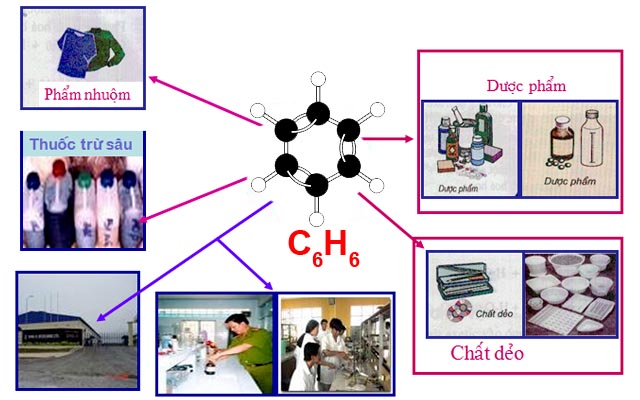
IV. Ứng dụng của benzen
Benzen là một nguyên liệu quan trọng trong nhành công nghiệp chất dẻo, phẩm nhuộm, dược phẩm, thuốc trừ sâu…
Một số ứng dụng của benzen
ung-dung-cua-benzen-c6h6
Ngoài ra, benzen còn được sử dụng để làm dung môi trong công nghiệp và phòng thí nghiệm.
V. Điều chế của benzen
C6H6 được điều chế bằng cách trùng hợp C2H2 trong điều kiện thích hợp hoặc cho axit benzoic tác dụng với NaOH.
3C2H2 (t°, Ni) → C6H6
C6H5COOH + NaOH → C6H6 + Na2CO3
Giải bài tập về của benzen
Câu 1. Cấu tạo đặc biệt của phân tử benzen C6H6 là:
a) Phân tử có vòng 6 cạnh
b) Phân tử có 3 liên kết đôi
c) Phân tử có vòng 6 cạnh chứa 3 liên kết đôi xen kẽ 3 liên kết đơn
d) Phân tử có vòng 6 cạnh chứa liên kết đôi và liên kết đơn
Đáp án đúng: C
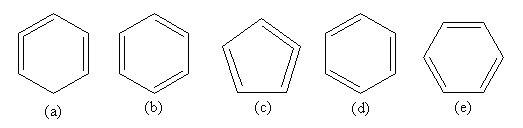
Câu 2. Một số học sinh viết CTCT của benzen như sau:
bai-tap-benzen
Hãy cho biết CTCT nào viết đúng, viết sai? Tại sao?
Bài làm:
– Công thức cấu tạo của C6H6 được viết đúng là: (b), (d) và (e). Vì các CTCT này diễn tả được cấu tạo của benzen là phân tử có vòng 6 cạnh và chứa 3 liên kết đôi xen kẽ 3 liên kết đơn.
– Công thức cấu tạo viết sai là: (a) – 2 liên kết đôi nằm cạnh nhau; (c) – vòng có 5 cạnh.
Câu 3. Cho benzen tác dụng với brom tạo ra brombenzen:
a) Viết PTHH (ghi rõ điều kiện của phản ứng).
b) Tính khối lượng benzen cần dùng để điều chế 15,7 g brombenzen. Biết hiệu suất phản ứng đạt 80%.
Bài làm:
a) PTHH của phản ứng:
C6H6 + Br2 (t°, Bột Fe) → C6H5Br + HBr
b) Theo đề ra, ta có:
nC6H5Br = 15,7/157 = 0,1 (mol)
Theo PTHH, ta có: nC6H6 = nC6H5Br = 0,1 (mol)
Khối lượng benzen cần dùng là:
mC6H6 = 0,1 x 78 = 7,8 g
Do hiệu suất của phản ứng là 80% nên lượng benzen thực tế cần dùng là:
mC6H6 thực tế = 7,8 x 100/80 = 9,75 g
Câu 4. Hãy cho biết chất nào trong các chất sau đây có thể làm mất màu dd brom. Giải thích và viết PTHH (nếu có).
a) C6H6
b) CH2=CH–CH=CH2
c) CH3–C≡CH
d) CH3–CH3
Bài làm:
Những chất tác dụng được với dd Br2 là những chất có liên kết đôi hoặc liên kết ba trong phân tử. Những chất này có phản ứng cộng với dung dịch Br2 và làm mất màu dd Br2.
CH2=CH–CH=CH2 + 2Br2 → Br–CH2–CHBr–CHBr–CH2–Br
CH3–C≡CH + Br2 → CH3–CBr=CHBr
CH3–CBr=CHBr + Br2 → CH3–CBr2–CHBr2
Riêng benzen, do có cấu trúc mạch vòng đặc biệt hơn và mặc dù có liên kết đôi trong phân tử nhưng nó không tham gia phản ứng cộng với dd Br2. Benzen chỉ tam gia phản ứng thế và làm mất màu dd Br2 khi nung nóng và có mặt bột sắt.
C6H6 + Br2 (t°, Bột Fe) → C6H5Br + HBr
5 / 5 ( 1 bình chọn )Từ khóa » Ctct Của C6h6
-
Benzen C6H6 Tính Chất Hóa Học, Công Thức Cấu Tạo Và Bài Tập Benzen
-
Công Thức Cấu Tạo Của C6H6 Và Gọi Tên Và Gọi Tên
-
Tính Chất Hóa Học Của Benzen C6H6. Công Thức Cấu Tạo Benzen Và ...
-
Tổng Hợp Benzen C6H6 Tính Chất Hoá Học, đồng đẳng Toluen Và ...
-
Đồng Phân Của Công Thức Cấu Tạo Của C 6 H 6 Và Gọi Tên Và Gọi Tên
-
Benzen – Wikipedia Tiếng Việt
-
Tính Chất Vật Lý, Tính Chất Hóa Học, Cấu Tạo Phân Tử Của Benzen ...
-
Công Thức Cấu Tạo Của C6H6, C3H6 Trong Chương Trình Lớp 9 E đã ...
-
C6H6 Tính Chất Hóa Học, Công Thức Cấu Tạo Và Bài Tập Benzen
-
Benzen C6H6 Tính Chất Hóa Học, Công Thức ...
-
Top 8 Công Thức Cấu Tạo C6h6 - Interconex
-
Công Thức Cấu Tạo C6h6 - X
-
Benzen C6H6 Tính Chất Hóa Học, Công Thức Cấu Tạo ...