Chẩn độ Axit - Bazo
Có thể bạn quan tâm
- Học Trực Tuyến
- Hỏi đáp
- Tài liệu học tập
- Tuyển sinh
- Trường học
- Mật ngữ 12 chòm sao
- Nhìn hình đoán chữ
- Hướng dẫn sử dụng
- + Kiến thức Toán học Vật lý Hóa học Sinh học Tiếng anh Ngữ văn Lịch sử Địa lý Giáo dục công dân
 Đăng nhập Quên mật khẩu? Đăng ký Tìm kiếm thông tin Nâng cấp tài khoản
Đăng nhập Quên mật khẩu? Đăng ký Tìm kiếm thông tin Nâng cấp tài khoản - Toán học
- Vật lý
- Hóa học
- Sinh học
- Địa lý
- Lịch sử
- Giáo dục công dân
- Tiếng anh
- Ngữ văn
- IQ Test
- Tin học
- Funy Test
- Giao thông
- Tất cả đề thi
- Toán tiếng anh
Phương pháp phân tích chuẩn độ là phương pháp hóa học định lượng, dựa trên sự đo thể tích dung dịch thuốc thử có nồng độ đã biết phản ứng với một thể tích xác định dung dịch của chất có nồng độ chưa biết cần xác định. Cách xác định nồng độ của dung dịch đó gọi là sự chuẩn độ. Trong phương pháp phân tích chuẩn độ, người ta dùng nhiều loại phản ứng hóa học như phản ứng trung hòa, phản ứng oxi hóa - khử và lấy tên của các loại phản ứng đó đặt tên cho các phương pháp, nên ta có phương pháp chuẩn độ axit - bazơ, phương pháp chuẩn độ hóa - khử. Chú ý: Mỗi phép chuẩn độ tiến hành ba lần để lấy kết quả trung bình của ba lần đó.
+) Sự chuẩn độ. Các dụng cụ trong phương pháp chuẩn độ
Trong phân tích chuẩn độ, dung dịch thuốc thử đã biết chính xác nồng độ gọi là dung dịch chuẩn. Khi chuẩn độ người ta thêm từ từ dung dịch chuẩn đựng trong buret vào dung dịch cần xác định nồng độ đựng trong bình tam giác. Thời điểm mà chất cần xác định nồng độ vừa tác dụng hết với dung dịch chuẩn gọi là điểm tương đương. Để nhận biết điểm tương đương, người ta dùng những chất gây ra những hiện tượng mà ta dễ quan sát được bằng mắt như sự đổi màu, sự xuất hiện kết tủa có màu hoặc làm đục dung dịch xảy ra tại điểm tương đương hoặc sát điểm tương đương, những chất đó gọi là chất hiển thị. Chất chỉ thị cho phép ta ngừng thêm dung dịch chuẩn vào để kết thúc chuẩn độ. Thời điểm kết thúc chuẩn độ là điểm cuối. Dựa vào phương trình hóa học của phản ứng chuẩn độ, thể tích, nồng độ dung dịch chuẩn đã dùng và thể tích dung dịch cần xác định nồng độ ta xác định được nồng độ mol của nó +) Dụng cụ trong phân tích Buret: là một ống thủy tinh hình trụ nhỏ được khắc độ theo chiều dài, đầu dưới của nó được thắt lại và được lắp một khóa thủy tinh điều khiển cho dung dịch chuẩn chảy ra từ từ theo từng giọt nối tiếp nhau. Pipet: Để lấy một thể tích chính xác dung dịch chất cần phân tích (chất cần chuẩn độ), người ta dùng một dụng cụ gọi là pipet. Pipet là ống thủy tinh dài, bé được chế tạo phình ra ở khoảng giữa, một đầu được kéo dài. Ống có vạch mức. Một số pipet có dạng xilanh. Thể tích chất lỏng chứa trong pipet được biểu diễn bằng ml và được ghi trên thành ngoài ở chỗ phần phình ra. Các pipet dạng xilanh được khắc độ chính xác tới 0,1ml. Chuẩn độ Axit - Bazo : +) Nguyên tắc chung Chuẩn độ axit - bazơ, hay còn gọi là chuẩn độ trung hòa, là phương pháp phân tích chuẩn độ được sử dụng rất rộng rãi để xác định nồng độ các dung dịch axit hoặc các dung dịch bazơ. Trong phương pháp này người ta dùng dung dịch kiềm (NaOH hoặc KOH) đã biết chính xác nồng độ làm dung dịch chuẩn để chuẩn độ dung dịch axit hoặc dùng dung dịch axit mạnh (HCl, H2SO4, HNO3) đã biết chính xác nồng độ để chuẩn độ dung dịch bazơ. Thực chất các phản ứng chuẩn độ là phản ứng trung hòa. Thí dụ, chuẩn độ dung dịch HCl chưa biết nồng độ bằng dung dịch chuẩn NaOH: HCl + NaOH → NaCl + H2O (1)Chuẩn độ dung dịch CH3COOH bằng dung dịch chuẩn NaOH:
CH3COOH + NaOH → CH3COONa + H2O (2) Chuẩn độ dung dịch NH3 bằng dung dịch chuẩn HCl: NH3 + HCl → NH4Cl (3) Trong quá trình chuẩn độ, pH của dung dịch thay đổi liên tục. Tại điểm tương đương, tức là thời điểm mà dung dịch chuẩn vừa trung hòa hết dung dịch axit hoặc bazơ cần chuẩn độ, pH của dung dịch phụ thuộc vào bản chất của axit hoặc bazơ cần chuẩn độ và nồng độ của chúng. Với phản ứng (1),pH tại thời điểm tương đương là pH của dung dịch NaCl bằng 7,0 và không phụ thuộc vào nồng độ của NaCl.pH tại thời điểm tương đương của phản ứng (2) là pH của dung dịch CH3COONa (bazơ yếu), nên pH đó lớn hơn 7.pH tại thời điểm tương đương của phản ứng (3) là pH của dung dịch NH4Cl (là axit yếu), nên pH đó nhỏ hơn 7. Để nhận ra điểm tương đương của phản ứng chuẩn độ, người ta dùng chất chỉ thị gọi là chất chỉ thị axit - bazơ hay chất chỉ thị pH. Đó là axit hữu cơ hoặc bazơ hữu cơ yếu mà màu sắc của dạng phân tử và của dạng ion khác nhau, nên màu của chất chỉ thị phụ thuộc vào pH của dung dịch. Bảng sau đây ghi khoảng pH đổi màu của 3 chất chỉ thị thường được sử dụng nhiều trong chuẩn độ axit - bazơ.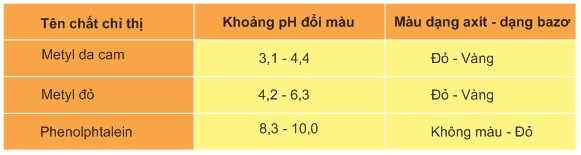 Với mỗi phản ứng chuẩn độ axit - bazơ ta chọn chất chỉ thị nào có khoảng pH đổi màu trùng hoặc rất sát với pH của điểm tương đương của sự chuẩn độ đó. Khi chuẩn độ để tránh những sai số lớn, người ta dùng các dung dịch chuẩn có nồng độ gần với nồng độ của dung dịch chất cần xác định. Thí dụ, giả sử phải chuẩn độ 20,00ml dung dịch HCl0,100M bằng dung dịch chuẩn NaOH. Trong trường hợp này ta không nên dùng dung dịch NaOH có nồng độ lớn, thí dụ 1,00M. Trong trường hợp này điểm tương đương sẽ đạt được khi thêm vào \(20,000x{ 0,100 \over 1,00}\) = 2,00(ml) dung dịch NaOH1,00M. Trong trường hợp đó, nếu khi cho dư 1 giọt dung dịch chuẩn có thể tích 0,05ml thì sai số sẽ là \(0,05 \over 2\).100 = 2,5%. Vì thế, ta nên dùng dung dịch NaOH0,100M để chuẩn độ thì không mắc các sai số lớn. +) Chuẩn độ dung dịch HCl bằng dung dịch chuẩn NaOH Trước hết ta hãy xét sự biến thiên pH trong quá trình chuẩn độ. Giả sử ta chuẩn độ V0ml dung dịch HCl nồng độ C0mol/l bằng dung dịch chuẩn NaOH nồng độ Cmol/l. Phản ứng chuẩn độ: HCl + NaOH → NaCl + H2O (1) Trước điểm tương đương, khi thêm Vml dung dịch NaOH vào, nồng độ ion H+ được tính theo công thức: [H+] = \(C_0V_0 - CV \over V + V_0\) (2) Tại điểm tương đương, ta có dung dịch NaCl có pH = 7. Sau điểm tương đương, tức là khi đã thêm vào lượng dư dung dịch NaOH, thì: [OH−] = \( CV - C_0V_0 \over V_0 + V \) (3) pOH = −lg[OH−] ; pH =14 − pOH (4) Ví dụ: áp dụng công thức trên, khi chuẩn độ 100ml dung dịch HCl0,100M bằng dung dịch chuẩn NaOH0,100M, ta tính được pH trong quá trình thêm dần dung dịch chuẩn NaOH vào và các kết quả được ghi trong bảng sau:
Với mỗi phản ứng chuẩn độ axit - bazơ ta chọn chất chỉ thị nào có khoảng pH đổi màu trùng hoặc rất sát với pH của điểm tương đương của sự chuẩn độ đó. Khi chuẩn độ để tránh những sai số lớn, người ta dùng các dung dịch chuẩn có nồng độ gần với nồng độ của dung dịch chất cần xác định. Thí dụ, giả sử phải chuẩn độ 20,00ml dung dịch HCl0,100M bằng dung dịch chuẩn NaOH. Trong trường hợp này ta không nên dùng dung dịch NaOH có nồng độ lớn, thí dụ 1,00M. Trong trường hợp này điểm tương đương sẽ đạt được khi thêm vào \(20,000x{ 0,100 \over 1,00}\) = 2,00(ml) dung dịch NaOH1,00M. Trong trường hợp đó, nếu khi cho dư 1 giọt dung dịch chuẩn có thể tích 0,05ml thì sai số sẽ là \(0,05 \over 2\).100 = 2,5%. Vì thế, ta nên dùng dung dịch NaOH0,100M để chuẩn độ thì không mắc các sai số lớn. +) Chuẩn độ dung dịch HCl bằng dung dịch chuẩn NaOH Trước hết ta hãy xét sự biến thiên pH trong quá trình chuẩn độ. Giả sử ta chuẩn độ V0ml dung dịch HCl nồng độ C0mol/l bằng dung dịch chuẩn NaOH nồng độ Cmol/l. Phản ứng chuẩn độ: HCl + NaOH → NaCl + H2O (1) Trước điểm tương đương, khi thêm Vml dung dịch NaOH vào, nồng độ ion H+ được tính theo công thức: [H+] = \(C_0V_0 - CV \over V + V_0\) (2) Tại điểm tương đương, ta có dung dịch NaCl có pH = 7. Sau điểm tương đương, tức là khi đã thêm vào lượng dư dung dịch NaOH, thì: [OH−] = \( CV - C_0V_0 \over V_0 + V \) (3) pOH = −lg[OH−] ; pH =14 − pOH (4) Ví dụ: áp dụng công thức trên, khi chuẩn độ 100ml dung dịch HCl0,100M bằng dung dịch chuẩn NaOH0,100M, ta tính được pH trong quá trình thêm dần dung dịch chuẩn NaOH vào và các kết quả được ghi trong bảng sau: 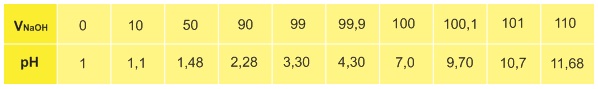
Như vậy, xung quanh điểm tương đương có một sự thay đổi pH rất đột ngột: Khi thêm 99,9mlNaOH vào tức là khi đã chuẩn độ 99,9% lượng axit thì pH của dung dịch bằng 4,3. Khi thêm vào 100,1mlNaOH tức là khi đã chuẩn độ quá 0,1% thì pH của dung dịch bằng 9,7 tức là ''bước nhảy pH là 5,4 đơn vị pH''. Nếu ta chọn các chất chỉ thị nào có khoảng đổi màu nằm trong khoảng từ 4,3 đến 9,7 để kết thúc chuẩn độ thì sao số không vượt quá 0,1%. Ta thấy trong trường hợp này có thể dùng một trong 3 chất chỉ thị metyl da cam, metyl đỏ và phenolphtalein làm chất chỉ thị. - Cách chuẩn độ: Lấy dung dịch chuẩn NaOH vào buret. Lấy dung dịch HCl cần xác định nồng độ vào bình tam giác sạch (dùng pipet). Thêm vào đó 1 − 2 giọt chất chỉ thị, thí dụ phenolphtalein. Thêm từ từ dung dịch chuẩn vào đến khi dung dịch chất chỉ thị chuyển màu từ không màu sang màu hồng thì kết thúc. Đọc thể tích dung dịch chuẩn đã tiêu tốn. - Cách tính: Nồng độ mol của dung dịch HCl được tính theo công thức :
\(C_{HCl} = {{V_{NaOH}.C_{NaOH}}\over V_{HCl}}\)
Bài viết khác :
- • Vàng
- • Thiếc
- • Sắt
- • Nike
- • Một số hợp chất của sắt
- • Một số hợp chất của đồng
- • Một số hợp chất của Crom
- • Kẽm
- • Hợp kim của sắt
- • Đồng
Top điểm cao trong 7 ngày qua
-

Lan, Bài thi số 583881 Lớp 11, môn Lịch sử. 80 điểm vào 12:03:36, 11/01/2026
-

Cao Kim Dung, Bài thi số 583857 Lớp 6, môn Tiếng anh. 73.3 điểm vào 13:10:49, 08/01/2026
-

An, Bài thi số 583852 Lớp 3, môn Toán học. 60 điểm vào 22:01:43, 07/01/2026
-

hoang dinh quan, Bài thi số 583841 Lớp 11, môn Lịch sử. 50 điểm vào 20:46:32, 06/01/2026
-

LÊ VĂN LỢI, Bài thi số 583837 Lớp 11, môn Lịch sử. 50 điểm vào 22:40:14, 05/01/2026
-

Trần Tuấn Anh, Bài thi số 583856 THPT Quốc gia, môn Lịch sử. 45 điểm vào 13:07:47, 08/01/2026
-

mai mai, Bài thi số 583868 Lớp 11, môn Lịch sử. 41.7 điểm vào 21:03:01, 09/01/2026
-

Nguyễn Minh Huy, Bài thi số 583855 Lớp 11, môn Lịch sử. 41.7 điểm vào 22:58:08, 07/01/2026
-

PHẠM Văn Hoàng, Bài thi số 583883 THPT Quốc gia, môn Địa lý. 40 điểm vào 20:33:24, 11/01/2026
-

Sùng Mạnh, Bài thi số 583833 Lớp 8, môn Toán học. 40 điểm vào 15:31:02, 05/01/2026
-

lê anh vinh, Bài thi số 583885 Lớp 11, môn Địa lý. 35 điểm vào 20:11:50, 11/01/2026
-

trần đăng khoa, Bài thi số 583870 Lớp 8, môn Tiếng anh. 30 điểm vào 23:06:16, 09/01/2026
Đề thi trắc nghiệm mới
- ĐÁP ÁN ĐỀ THI THPT QUỐC GIA 2021 MÔN ĐỊA MÃ 302
- ĐÁP ÁN MÃ ĐỀ 308 SỬ 2021: ĐỀ THI THPT QUỐC GIA 2021 MÔN SỬ 308
- Đề thi thử chuẩn cấu trúc minh họa số 02 Kỳ thi tốt nghiệp THPT môn Toán năm 2021
- Đề thi thử chuẩn cấu trúc minh họa số 01 Kỳ thi tốt nghiệp THPT môn Toán năm 2021
- Đề thi thử minh hoạ số 65 Kỳ thi THPT năm 2021 môn Lịch sử THPT Nguyễn Hiền Quảng Nam lần 2
- Đề thi thử minh hoạ số 63 Kỳ thi THPT năm 2021 môn Lịch sử Trường THPT Phan Ngọc Hiền Cà Mau lần 1
- Đề thi thử minh hoạ số 64 Kỳ thi THPT năm 2021 môn Lịch sử Trường THPT Mỏ Trạng Bắc Giang lần 2
- Đề thi thử minh hoạ số 62 Kỳ thi THPT năm 2021 môn Lịch sử Trường THPT Ngọc Lặc Thanh Hóa
- Đề thi thử minh hoạ số 59 Kỳ thi THPT năm 2021 môn Lịch sử Trường THPT Nguyễn Trung Thiện - Hà Tĩnh
- Đề thi thử minh hoạ số 60 Kỳ thi THPT năm 2021 môn Lịch sử Sở GDĐT Hòa Bình
Tài liệu mới trên Matran.vn
- Tài liệu ôn tập địa lí ôn thi THPT Quốc gia 2020 Môn: Môn địa lý; lượt xem (11,248); lượt tải (2,419); Cập nhật 09:49:58, 29/06/2020
- 50 dạng bài toán ôn thi THPT Quốc gia năm 2020 Môn: Toán học; lượt xem (5,325); lượt tải (1,009); Cập nhật 09:53:17, 15/06/2020
- Tài liệu ngữ pháp tiếng Anh lớp 12 nhất định phải đọc Môn: Tiếng anh; lượt xem (5,568); lượt tải (1,209); Cập nhật 10:39:21, 10/06/2020
- Tài liệu ôn thi Sử 12 - Ôn thi THPT Quốc gia (phần 1) Môn: Môn lịch sử; lượt xem (7,757); lượt tải (2,708); Cập nhật 10:24:58, 03/06/2020
- Tài liệu Toán ôn thi THPT Quốc gia 2020 phần HÀM SỐ Môn: Môn toán; lượt xem (4,165); lượt tải (647); Cập nhật 09:20:23, 26/05/2020
- Tổng hợp tài liệu Ngữ Văn cô Thu Trang - phần 1 (sưu tầm) Môn: Môn văn học; lượt xem (6,585); lượt tải (1,080); Cập nhật 20:09:16, 15/05/2020
Học trực tuyến
-
 Phép Trừ có nhớ trong phạm vi 100 Video bài giảng Phép Trừ có nhớ trong phạm vi 100 trong chương trình Toán lớp 2.
Phép Trừ có nhớ trong phạm vi 100 Video bài giảng Phép Trừ có nhớ trong phạm vi 100 trong chương trình Toán lớp 2. -
 100 bài toán lớp 4 điển hình - (Bài 56): Tìm 2 số khi biết Hiệu số và Tỉ số của nó
100 bài toán lớp 4 điển hình - (Bài 56): Tìm 2 số khi biết Hiệu số và Tỉ số của nó -
 Viết nhanh phương trình đường thẳng qua các điểm cực trị của hàm số bậc 3
Viết nhanh phương trình đường thẳng qua các điểm cực trị của hàm số bậc 3 -
 100 bài toán lớp 4 điển hình - (Bài 65): Dạng toán tính tuổi
100 bài toán lớp 4 điển hình - (Bài 65): Dạng toán tính tuổi -
 Tìm 2 số - Cách giải toán dùng sơ đồ đoạn thẳng
Tìm 2 số - Cách giải toán dùng sơ đồ đoạn thẳng
• Thi thử trực tuyến Toán học
• Thi thử trực tuyến Vật lý
• Thi thử trực tuyến Hóa học
• Thi thử trực tuyến Sinh học
• Thi thử trực tuyến Địa lý
• Thi thử trực tuyến Lịch sử
• Thi thử trực tuyến Giáo dục công dân
• Thi thử trực tuyến Tiếng anh
• Thi thử trực tuyến Ngữ văn
• Thi thử trực tuyến IQ Test
• Thi thử trực tuyến Tin học
• Thi thử trực tuyến Funy Test
• Thi thử trực tuyến Giao thông
• Đề thi thử Lớp 3
• Đề thi thử Lớp 4
• Đề thi thử Lớp 5
• Đề thi thử Lớp 6
• Đề thi thử Lớp 7
• Đề thi thử Lớp 8
• Đề thi thử Lớp 9
• Đề thi thử Lớp 10
• Đề thi thử Lớp 11
• Đề thi thử Lớp 12
• Đề thi thử THPT Quốc gia
• Đề thi thử Thi cao học
• Đề thi thử Level 1
• Đề thi thử Level 2
• Đề thi thử Level 3
• Đề thi thử Thi oto
• Đề thi thử Thi xe máy
• Đề thi thử Đại cương
• Đề thi thử Văn phòng
• Kiến thức toán học
• Kiến thức hóa học
• Kiến thức vật lý
• Kiến thức sinh học
• Kiến thức tiếng anh
• Kiến thức ngữ văn
• Kiến thức địa lý
• Kiến thức lịch sử
• Kiến thức GDCD
• Hỏi đáp kiến thức
• Tài liệu học tập
• Địa điểm trường học...
• Nhìn hình đoán chữ
• Tin tức giáo dục
Công cụ trực tuyến hỗ trợ giáo dục - MaTran.edu.vn Copyright © 2014-2021. All rights reserved. Bản quyền thuộc VinaGon Email: [email protected] Hotline: 086.924.3838 • Liên hệ hỗ trợ • Quy định chung • Chính sách bảo mật • Phương thức thanh toánMa trận EduScroll
Từ khóa » Nguyên Tắc Phương Pháp Chuẩn độ Axit Bazo
-
Khái Niệm Chuẩn độ, đường Cong, Phương Trình Nồng độ Mol ...
-
GIỚI THIỆU CÁCH CHUẨN ĐỘ AXIT – BAZƠ - EMIN
-
PHƯƠNG PHÁP CHUẨN ĐỘ AXIT – BAZƠ - Học Để Thi
-
Phương Pháp Chuẩn độ Axit Bazo - 123doc
-
Chương 4. Phương Pháp Chuẩn Về độ Axit Bazo - SlideShare
-
Chuẩn độ Axit-bazơ | Khái Niệm Hoá Học
-
[PDF] CHƯƠNG III CHUẨN ĐỘ ACID BAZ
-
(PDF) Chuẩn độ Axit Bazo | Đạo Bá
-
Các Phương Pháp Chuẩn độ - Nghiên Cứu Khoa Học
-
[PDF] Cơ Bản Về Chuẩn độ - Xylem Analytics Vietnam
-
(PPT) PHƯƠNG PHÁP CHUẨN ĐỌ ACID-BAZ
-
Bài Giảng Tiết 78: Chuẩn độ Axit-Bazơ - Giáo Án Mẫu
-
Chuẩn độ điện Thế Là G?