Chụp Cắt Lớp Vi Tính Phổ: Nguyên Lý Và ứng Dụng Trong Tim Mạch
Có thể bạn quan tâm
Nguyễn Xuân Trình*
Nguyễn Tuấn Vũ*
Phan Thanh Hải*
*Khoa Tim mạch – Trung tâm Y Khoa Medic
Tác giả liên lạc: BS.CKII. Nguyễn Xuân Trình
Tóm tắt.
Do tính sẵn có rộng rãi, dễ áp dụng lâm sàng, độ nhạy tuyệt vời để phát hiện bệnh động mạch vành (ĐMV) và bản chất không xâm lấn, CT đã trở thành một công cụ có giá trị trong trang thiết bị của bác sĩ tim mạch. Trong vài năm gần đây, đã có nhiều tiến bộ công nghệ trong CT, bao gồm CT đa mức năng lượng (multienergy CT) hoặc CT phổ (spectral CT) hoặc CT hai mức năng lượng (dual-energy CT), trong đó dữ liệu có đậm độ khác nhau từ các mức năng lượng khác nhau được sử dụng để mô tả các vật chất, điều này vượt quá khả năng của CT thông thường hay CT một mức năng lượng.
Các công nghệ hiện tại cho CT phổ là dựa trên đầu đèn hoặc dựa trên đầu thu và phân tách chất xảy ra trong hình ảnh. Bằng cách khai thác những tiến bộ trong công nghệ, CT tim đã vượt qua sự đánh giá đơn thuần của hẹp ĐMV thành một phương tiện hình ảnh cho phép xác định chính xác mảng xơ vữa, đánh giá tưới máu cơ tim, viêm cơ tim, bệnh cơ tim không do thiếu máu cục bộ (TMCB), tái hẹp trong stent mạch vành hay xảo ảnh, rò bên trong stentgraft ở động mạch chủ (ĐMC), phát hiện cả thuyên tắc phổi cấp tính và mạn tính (CTEPH). Ngoài ra, liều thuốc tương phản và liều bức xạ ion hóa giảm 50-60%, thậm chí có vài nghiên cứu cho thấy liều bức xạ ion hóa giảm đến 90% .
Từ khóa: CT hai mức năng lượng, CT phổ, CT đa mức năng lượng, phổ tia X, mức năng lượng liên kết lớp K, vật chất, nguyên tử Z hữu hiệu.
Abstract
Spectral CT: Principles and Cardiovascular Applications
Due to its widespread availability, ease of clinical application, superb sensitivity for detection of CAD, and non-invasive nature, CT has become a valuable tool in the equipment of the cardiologist. In recent years, many technological advances in CT have occurred including dual energy CT (DECT) or Multienergy CT or spectral CT is a relatively recent advance in which attenuation data from different energies are used to characterize materials beyond what is possible at conventional CT. Current technologies for multienergy CT are either source based or detector based and material-based decomposition occurs in either image. By harnessing the advances in technology, cardiac CT has advanced beyond the mere assessment of coronary stenosis to an imaging modality tool that permits accurate plaque characterization, assessment of myocardial perfusion , acute myocarditis , non-ischemic dilated cardiomyopathy, determining if shadowing inside a stent is artifact or restenosis, better delineation of aortic stent graft endoleaks, detection of both acute and chronic pulmonary embolisms. Also, lower contrast and radiation dose 50-60% and even 90% in some studies.
Keywords: Dual energy CT, Spectral CT, Multienergy CT, X-Ray Spectrum, K-Shell Binding Energy, materials. Effective atomic number (Zeff) .
- Mở đầu:
Gần đây, những tiến bộ trong công nghệ chụp cắt lớp vi tính cho phép thời gian chụp nhanh hơn, cải thiện độ phân giải không gian và thời gian, và giảm liều bức xạ cùng với những bằng chứng phát triển nhanh chóng từ các thử nghiệm lâm sàng đã xác định chụp cắt lớp vi tính (CT) như một phương tiện chẩn đoản hình ảnh quan trọng trong đánh giá các rối loạn tim mạch(1). Không thể tưởng tượng được trong thực hành lâm sàng hiện tại mà không có hình ảnh CT. Do tính sẵn có phổ biến rộng rãi, dễ áp dụng lâm sàng, độ nhạy tuyệt vời để phát hiện bệnh động mạch vành (ĐMV) và bản chất không xâm lấn, CT đã trở thành một công cụ có giá trị trong trang thiết bị của bác sĩ tim mạch. Trong vài năm gần đây, nhiều tiến bộ công nghệ trong CT đã xảy ra, bao gồm: CT đa mức năng lượng hoặc CT hai mức năng lượng còn gọi là CT phổ, trong đó dữ liệu có đậm độ khác nhau từ các mức năng lượng khác nhau được sử dụng để mô tả các vật chất, điều này vượt quá khả năng của CT thông thường hay CT một mức năng lượng (SECT)(1,2) . Bằng cách khai thác những tiến bộ trong công nghệ, CT tim đã vượt qua sự đánh giá đơn thuần của hẹp ĐMV thành một phương tiện hình ảnh cho phép xác định chính xác mảng xơ vữa, đánh giá tưới máu cơ tim, viêm cơ tim, tái hẹp trong stent ĐMV hay xảo ảnh, rò bên trong stent graft ở ĐMC, phát hiện cả thuyên tắc phổi cấp tính và mãn tính. Cuộc cách mạng mới trong chất tương phản CT và các thiết bị CT phổ tiền lâm sàng đã mở đường cho hình ảnh phân tử dựa trên CT(2). CT phổ được quan tâm nhiều trong vài năm trở lại đây và cũng là một trong những chủ đề được quan tâm nhất tại cuộc họp thường niên của hội CT tim Hoa kỳ 2019 (SCCT 2019). DECT đại diện cho sự tiến bộ đáng kể mới nhất trong lĩnh vực chụp cắt lớp vi tính. Lần đầu tiên được nghiên cứu vào cuối những năm 1970 mãi đến năm 2006, DECT lần đầu tiên được áp dụng trong thực hành lâm sàng(3). DECT không những phát hiện hình thái mà còn giúp phân biệt thành phần hóa học của các cấu trúc mô khảo sát. Kỹ thuật mới này đã đưa CT vào lĩnh vực đánh gía chức năng của các cơ quan. Phương pháp này thu được hình ảnh xảy ra cùng lúc hay gần cùng lúc ở mức năng lượng (kilovolt peaks) cao và thấp (80 kVp và 140kVp). Việc sử dụng các mức năng lượng khác nhau cho phép kiểm soát được 2 phổ đa sắc để phân biệt được đậm độ của 2 vật chất cơ bản khác nhau.
II. Nguyên lý hoạt động của CT phổ:1. Tạo hai mức năng lượng:
Các phương pháp tạo hai mức năng lượng (Hình 1): Chụp CT hai đầu đèn với 2 dãy đầu thu tương ứng (Dual-Source Scanner with Dual Detector Arrays), Chụp CT hai mức năng lượng với một đầu đèn chuyển đổi kilovoltage (KV) nhanh giữa KV cao và thấp (Single-Source Scanner with Fast Kilovoltage Switching) và Chụp CT hai mức năng lượng với một đầu đèn nhưng có 2 lớp đầu thu (Single-Source Scanner with Dual Detector Layers) hay 2 dãy đầu thu phụ thuộc năng lượng ( Energy-dependent dual detectors)(4,5). Những đầu thu(detector) thế hệ mới, không chỉ phân tích độ hấp thu tia X đến đầu thu, mà còn có khả năng đếm được số photon đến “ Photon-counting hay quantum-counting ”, giúp phân tích thành phần vật chất tốt hơn DECT đơn thuần(6). Ba loại máy chụp CT hai mức năng lượng có sẵn khác nhau về kỹ thuật sử dụng để thu được bộ dữ liệu CT ở mức năng lượng cao và năng lượng thấp(7):
Chụp CT hai mức năng lượng với hai đầu đèn với hai dãy đầu thu (Dual-Source Scanner with Dual Detector Arrays)(7):
Chụp MSCT hai mức năng lượng với hai đầu đèn (DSCT-Dual Source CT) (Somatom;Siemens,Đức) đặt vuông gốc nhau với 2 mức năng lượng khác nhau: một đầu đèn với mức năng lượng cao 120kVp hay 140 kVp tương ứng với dãy đầu thu (detector) A có thể bao phủ toàn bộ trường khảo sát(field of View) với đường kính 50cm và một đầu đèn với mức năng lượng thấp 80 kVp hay 100 kVp tương ứng với dãy đầu thu (detector) B có trường khảo sát nhỏ hơn hay ở trung tâm (central field of View) với đường kính 26cm. Như vậy 2 đầu đèn chỉ cần xoay ¼ vòng tròn là toàn bộ hình ảnh của tim có thể thu được với độ phân giải thời gian là 75mili giây. Các bộ dữ liệu hình ảnh khác nhau thu được cùng lúc từ hai đầu đèn hoạt động ở hai mức năng lượng khác nhau. Việc sử dụng hai nguồn tia X riêng biệt cho phép lọc chùm tia và điều chỉnh hướng chùm tia trong mỗi đầu đèn để tối ưu hóa chất lượng hình ảnh. Hình ảnh CT hai mức năng lượng với hai đầu đèn có phần hạn chế về độ phân giải thời gian vì bộ dữ liệu hình ảnh thu được ở mức năng lượng thấp và cao có thời gian hơi khác nhau. Hơn nữa, trường khảo sát có giới hạn (33 cm) để sử dụng trong phân tích hình ảnh có thể cản trở việc đánh giá toàn bộ một số cơ quan vùng bụng ở những bệnh nhân có cơ thể lớn.
Chụp CT hai mức năng lượng với một đầu đèn chuyển đổi nhanh Kilovoltage (Single-Source Scanner with Fast Kilovoltage Switching)(7):
Chụp CT một đầu đèn với một lớp đầu thu duy nhất (Discovery CT 750HD; GE Healthcare, Milwaukee, Wis) dựa vào một nguồn tia x duy nhất với chuyển đổi nhanh giữa hai mức năng lượng kilovoltage (80kVp và 140 kVp) trong khoảng 0,5 mili giây trong một vòng xoay của đầu đèn để tạo ra phổ tia X mức năng lượng cao và thấp. Đầu đèn không thể thay đổi cùng lúc, nó vẫn không đổi trong cả mức năng lượng cao và thấp. Để phát hiện mức năng lượng đầu ra cao hơn 140 kVp, tỷ lệ thời gian phơi nhiễm tia được thay đổi giữa 80 kVp và 140 kVp để tối đa hóa tỷ lệ tương phản và xảo ảnh (contrast-to-noise ratio): điển hình là 65% thời gian phơi nhiễm được sử dụng cho 80kVp và 35% cho 140 kVp. Một hệ thống đầu thu với đáp ứng nhanh về mức năng lượng và hệ thống thu thập dữ liệu với tính năng lấy mẫu nhanh được sử dụng để thu được dữ liệu ở mức năng lượng cao xen kẻ với mức năng lượng thấp. Ưu điểm của CT hai mức năng lượng với tốc độ chuyển đổi kilovoltage nhanh là độ phân giải thời gian tốt giữa bộ dữ liệu ở mức năng lượng cao và thấp thu được gần như đồng thời, và tính khả dụng của trường khảo sát 50 cm đầy đủ cho sử dụng trong phân tích hình ảnh. Tuy nhiên, vì một nguồn tia x được sử dụng, sự biến đổi riêng lẻ các chùm tia X năng lượng cao và năng lượng thấp rất khó (sẽ có trên các máy CT có sẵn trên thị trường)và chồng chéo phổ được tăng lên.
Chụp CT hai mức năng lượng với một đầu đèn và một dãy đầu thu có 2 lớp (Single-Source Scanner with Dual Detector Layers)(7):
Mẫu đầu tiên cho chụp CT hai mức năng lượng với một đầu đèn (Brilliance CT; Philips Healthcare, Andover, Mass) có dãy đầu thu biến đổi với hai tầng lấp lánh (scintillation) được sắp xếp trước. Lớp đầu thu bên dưới ghi dữ liệu hình ảnh ở mức năng lượng cao và lớp đầu thu bên trên ghi dữ liệu hình ảnh ở mức năng lượng thấp. Từ hai bộ dữ liệu này, hai chuỗi hình ảnh riêng biệt được tái tạo dựng hình. Chụp CT hai mức năng lượng với một đầu đèn và một dãy đầu thu có 2 lớp chưa có tính phổ biến sử dụng trên lâm sàng.
Đầu thu đếm quang phổ photon ( Photon-counting Detectors)(8).
Việc sử dụng các đầu thu đếm photon phân tích năng lượng có thể cung cấp giải pháp mạnh mẽ nhất cho việc thu thập dữ liệu năng lượng kép hoặc đa năng lượng. Các đầu thu như vậy, có khả năng đếm được những tương tác photon rời rạc, là đối tượng của nghiên cứu và phát triển đang diễn ra và không có sẵn trên thị trường trong các hệ thống CT, mặc dù chúng được sử dụng trong y học hạt nhân và chụp nhũ ảnh quang phổ. Dựa trên sự lựa chọn các ngưỡng năng lượng và năng lượng liên quan của mỗi photon, số lượng được đặt vào các bộ dữ liệu ngưỡng năng lượng cụ thể. Dữ liệu liên quan đến các cửa sổ năng lượng cụ thể được tạo bằng cách trừ dữ liệu ngưỡng năng lượng khác nhau. Đối với trường hợp đặc biệt với cửa sổ năng lượng n = 2 , đầu thu đếm photon có thể được sử dụng để chụp ảnh năng lượng kép.
- Phổ tia X và mức năng lượng liên kết K:
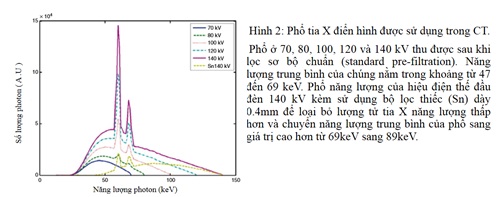
Việc tạo ra tia X trong đầu đèn là một quá trình xác suất tạo ra phổ tia X ở các mức năng lượng khác nhau (30-140KeV). Năng lượng của tia X được biểu thị bằng keV (kiloelectron Volts, keV). Năng lượng tối đa của phổ tia X tương ứng với điện thế của đầu đèn được áp dụng, năng lượng trung bình của tia X tỉ lệ thuận với mức điện thế đầu đèn. Phổ tia X điển hình được thể hiện trong Hình 2 (9,10) và hình dạng của đường cong (và do đó cường độ tia X ở một năng lượng nhất định) thay đổi theo điện thế đầu đèn được áp dụng. Trong thực hành lâm sàng, điện thế đầu đèn được sử dụng trong CT thường khoảng 70 đến 140 kV. Đối với các giá trị này, phổ năng lượng bao gồm trong phạm vi từ 30 đến 140 keV, với năng lượng trung bình khoảng 52 keV cho điện thế đầu đèn 80 KV và năng lượng trung bình khoảng 69 keV cho điện thế đầu đèn 140 kV (9).
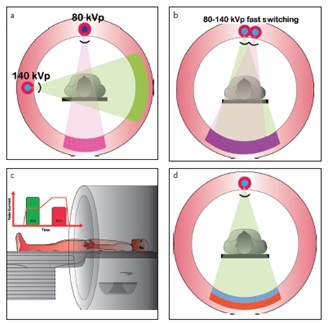 Hình 1: a – d. Minh họa cho thấy các loại máy CT hai mức năng lượng khác nhau. Chụp CT hai mức năng lượng với hai đầu đèn có nguồn năng lượng khác nhau và đặt vuông góc nhau (a). Chụp CT hai mức năng lượng với một đầu đèn chuyển đổi kVp nhanh(b), Kỹ thuật quay kép (Dual Spin technology) (c): Bệnh nhân ban đầu được chụp ở một mức năng lượng (135 kVp) và ngay lập tức sử dụng mức năng lượng khác nhau (80 kVp) được chụp ở cùng một vị trí giải phẫu. Máy CT có đầu thu dạng phổ hay hai lớp đầu thu (Spectral detector CT-SDCT) (d)(4) .
Hình 1: a – d. Minh họa cho thấy các loại máy CT hai mức năng lượng khác nhau. Chụp CT hai mức năng lượng với hai đầu đèn có nguồn năng lượng khác nhau và đặt vuông góc nhau (a). Chụp CT hai mức năng lượng với một đầu đèn chuyển đổi kVp nhanh(b), Kỹ thuật quay kép (Dual Spin technology) (c): Bệnh nhân ban đầu được chụp ở một mức năng lượng (135 kVp) và ngay lập tức sử dụng mức năng lượng khác nhau (80 kVp) được chụp ở cùng một vị trí giải phẫu. Máy CT có đầu thu dạng phổ hay hai lớp đầu thu (Spectral detector CT-SDCT) (d)(4) .
Khi chùm tia X đi qua cơ thể con người, tia X sẽ tương tác với các mô của cơ thể, cụ thể là các phân tử cấu thành các mô của cơ thể theo 2 cơ chế phản ứng (9,2) (Hình 3):
– Tán xạ Compton (Compton scattering): Khi một photon tia X chạm vào một electron của quỹ đạo bên ngoài (hoặc vỏ) có năng lượng liên kết thấp, nó sẽ mất một phần năng lượng và quỹ đạo của nó bị lệch trước khi chạm tới hệ thống đầu thu (Detection System), trong khi electron bị đánh bật ra quỹ đạo của nó. Sự tán xạ Compton chịu trách nhiệm cho việc giảm độ tương phản của hình ảnh ( hình xám trên phim phụ thuộc vào năng lượng của tia X còn lại). Nó chiếm ưu thế trong các khu vực của cơ thể con người giàu nguyên tử có điện tích hạt nhân Z thấp, và nó chủ yếu phụ thuộc vào đậm độ của vật chất.
– Hấp thụ quang điện (Photoelectric absorption) hay hiệu ứng quang điện (photoelectric effect ): Khi một photon tia X chạm vào một electron ở lớp trong cùng được gọi là lớp K (bình thường cấu tạo của nguyên tử gồm 2 phần: nhân mang điện tích dương và vỏ gồm các lớp electron: K, L, M, N mang điện tích âm; lớp K có mức năng lượng liên kết lớn nhất do nằm sát với nhân, điện tích hạt nhân Z càng lớn thì mức năng lượng liên kết ở lớp K càng lớn, mức năng lượng liên kết K còn gọi là K-edges ) nó sẽ mất hết năng lượng và photon tia X không đến được hệ thống đầu thu. Nếu năng lượng tia X lớn hơn năng lượng liên kết của electron, dẫn đến electron bị đánh bật khỏi quỹ đạo của nó. Một electron từ lớp khác di chuyển đến chỗ trống còn lại ở lớp bên trong bởi electron bị đẩy ra. Quá trình chuyển đổi này đi kèm với việc giải phóng các photon tia X. Khi năng lượng tia X bằng hoặc gần bằng với mức năng lượng liên kết K thì tia X bị hấp thu hoàn toàn, góp phần tạo ảnh tia X trên phim, chỉ số HU sẽ tăng cao (hình trắng trên phim). Sự phụ thuộc năng lượng của hiệu ứng quang điện và sự thay đổi của mức năng lượng liên kết K-edges hình thành cơ bản của các kỹ thuật CT hai mức năng lượng hay CT phổ, điều này được sử dụng để phát hiện các chất như Iốt, canxi và tinh thể axit uric (11).
Hiện tượng này chiếm ưu thế trong các mô giàu nguyên tử có điện tích hạt nhân Z cao, nó phụ thuộc mạnh mẽ vào năng lượng tia X và vào điện tích hạt nhân Z của vật chất.
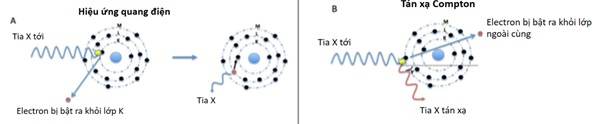
Hình 3: Sơ đồ minh họa hiệu ứng quang điện và tán xạ Compton
Mức năng lượng liên kết K tỉ lệ thuận với điện tích hạt nhân Z của nguyên tử tương ứng. Những phân tử như Hydro (Z=1), Carbon (Z=6), Nitơ (Z=7) và oxy (Z=8) có mức năng lượng liên kết lớp K nhỏ giữa 0.01 và 0.53 keV so với Canxi (Z=20, mức năng lượng liên kết lớp K là 4 keV), Iốt (Z=53, mức năng lượng liên kết lớp K là 33.2 keV, Barium ( Z= 56, mức năng lượng liên kết lớp K là 37.45 KeV), Gadolinium (Z= 64, mức năng lượng liên kết lớp K là 50,20 KeV ) (9,11). Iốt có mức năng lượng liên kết K gần với mức năng lượng trung bình của tia X ( 52 KeV) cho điện thế đầu đèn 80 KVP do đó mức độ hấp thụ tia X ở 80 kVp sẽ lớn hơn so với mức 140kVp. Mức 80 kVp, mô chứa Iốt sẽ có đậm độ cao hơn so với mô không chứa Iốt và tương phản này rõ hơn nhiều so với mức 140kVp. Chúng ta có thể phân biệt các chất khác nhau dựa vào sự khác nhau vế mức liên kết K ở các mức năng lượng khác nhau giữa 80 kVp và 140kVp.
Khả năng hấp thụ quang điện lớn nếu năng lượng tia X tương tự mức năng lượng liên kết lớp K và đối với giá trị thấp của hiệu điện thế đầu đèn(80 kVp), khi đó tia X được hấp thu hoàn toàn, đây là vấn đề cơ bản hình thành CT phổ. Đối với năng lượng tia X lớn hơn mức năng lượng liên kết lớp K, thì sẽ có một sự gia tăng đột ngột trong đậm độ, bởi vì sau đó lượng tử tia X sẽ mất hết tất cả năng lượng của nó cho electron lớp K và sẽ không còn chạm hệ thống đầu thu nữa. Việc tăng đậm độ trong tia X chuyển sang tăng giá trị HU của hình ảnh ( hình có màu trắng trên phim) (9).
Khi tia X đi qua cơ thể con người, các tia X tương tác với các phân tử cấu thành các mô của con người. Chúng bị suy giảm và chạm tới hệ thống đầu thu với cường độ thấp hơn so với cường độ ban đầu. Cường độ của tia X phụ thuộc trực tiếp vào cường độ của đầu đèn. Năng lượng của tia X tỷ lệ thuận với hiệu điện thế giữa cực âm và cực dương của đầu đèn (hay nói cách khác nó phụ thuộc vào điện thế đầu đèn). Giá trị của hiệu điện thế được biểu thị bằng kV (9).
- Đối với điện thế cao, chùm tia X sẽ được hấp thụ ít hơn trong cơ thể người và có độ xuyên thấu cao hơn, và một lượng tử lượng tia X tương đối lớn sẽ đạt tới hệ thống đầu thu. Ở cường độ tia X ban đầu, hình ảnh sẽ ít bị xảo ảnh. Mặt khác, tính tương phản của hình ảnh sẽ bị giảm, đặc biệt đối với chụp CT có dùng thuốc cản quang tiêm tĩnh mạch (9).
- Đối với điện thế thấp, chùm tia X sẽ cho thấy sự hấp thụ cao hơn và ít xâm nhập vào cơ thể con người. Các tia X sẽ tương tác nhiều hơn với các cấu trúc của cơ thể con người và ở cường độ tia X ban đầu, một lượng tử tia X nhỏ hơn sẽ chạm tới hệ thống đầu thu, làm tăng xảo ảnh, mặt khác cải thiện độ tương phản của hình ảnh (9).
Trong chụp cắt lớp vi tính một mức năng lượng (SECT), qúa trình chụp được thực hiện với điện thế đầu đèn đặc biệt theo đặc điểm của bệnh nhân và loại vùng khảo sát. Đối với các giá trị khác nhau của điện thế đầu đèn, phổ năng lượng của tia X sẽ khác nhau và lượng tử tia X sẽ tương tác với vật chất theo những cách khác nhau (9).
- Đối với các mô giàu các nguyên tố có số nguyên tử cao (ví dụ canxi và Iốt của môi trường tương phản), năng lượng trung bình của phổ tia X sẽ gần với năng lượng liên kết K hơn nếu chọn điện thế thấp 80 KVp. Hiệu ứng quang điện chiếm ưu thế và các giá trị HU sẽ cao hơn so với chụp ở điện thế cao (9).
- Đối với các mô chủ yếu chứa các nguyên tố có số nguyên tử thấp, chẳng hạn như hydro, carbon, nitơ, andoxygen, các giá trị năng lượng của vỏ K rất thấp và không khác biệt đáng kể (từ 0,01 keV đối với hydro đến 0,53 keV đối với oxy). Kết quả là, sẽ không có sự khác biệt lớn về sự suy giảm của tia X khi sử dụng điện thế cao hoặc thấp(9).
Nguyên lý của chụp CT phổ chủ yếu dựa trên hiệu ứng quang điện và có thể đạt được bằng cách khai thác sự suy giảm tia X phụ thuộc năng lượng của vật chất khi tiếp xúc với hai mức năng lượng photon khác nhau. Những nguyên tắc vật lý này có thể được khai thác cho hình ảnh con người, vì DECT dựa trên các đặc điểm mô không giống nhau đối với sự suy giảm tia X phụ thuộc năng lượng của chúng. Sau đó, DECT cho phép phân biệt rõ rệt giữa hai vật chất cơ bản. Các vật chất này có thể được chọn tùy ý, miễn là các mức năng lượng liên kết lớp K của chúng đủ khác nhau (vd: cấu hình suy giảm), chẳng hạn như nước và Iốt. Bất kỳ vật chất nào khác có phổ suy giảm khác với vật chất cơ bản được chọn sẽ được phản ánh dưới dạng kết hợp của hai vật chất cơ bản. Do đó, khai thác sự khác biệt về suy giảm liên quan đến năng lượng của các mô, DECT cung cấp thông tin về thành phần mô không thể thực hiện được bằng CT một năng lượng thông thường (SECT)(2).
Có thể tóm tắt nguyên lý hoạt động của CT phổ như sau (Hình 4):
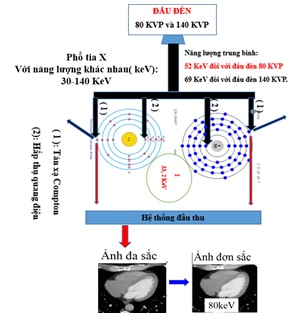
Hình 4: Sơ đồ tóm tắt hoạt động của CT phổ hay CT hai mức năng lượng.
Với chụp CT hai mức năng lượng, hai tập dữ liệu hình ảnh được thu thập ở cùng một vị trí giải phẫu với hai phổ tia X khác nhau để cho phép phân tích những thay đổi phụ thuộc vào năng lượng trong đậm độ các vật liệu khác nhau. Mỗi loại vật liệu thể hiện một sự thay đổi tương đối cụ thể trong đậm độ giữa các hình ảnh thu được với một phổ năng lượng cao và những thứ thu được với một phổ năng lượng thấp, và sự khác biệt đậm độ này cho phép một đặc tính sắc thái hơn các tính năng được mô tả. Hai vật liệu khác nhau cho thấy sự suy giảm tương tự trên hình ảnh thu được với một trong hai phổ năng lượng thường được phân biệt dễ dàng hơn trên các hình ảnh thu được với phổ khác vì sự khác biệt đáng kể về độ suy giảm của chúng (Hình 5). Mặc dù Iốt và canxi có thể chứng minh đậm độ tương tự trên hình ảnh CT thông thường, nhưng trên hình ảnh CT hai mức năng lượng thì đậm độ của Iốt nhiều hơn một cách đáng kể so với canxi thu được với năng lượng thấp và cao, và sự khác biệt đậm độ này tạo điều kiện cho sự khác biệt của hai vật chất (7).
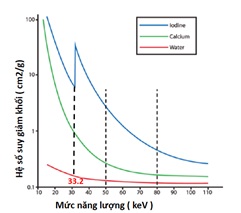
Hình 5. Đồ thị hệ số suy giảm khối ( Mass attenuation coefficients ) cho Iốt (xanh dương), canxi (xanh lá cây) và nước (màu đỏ) trên những hình ảnh CT thu được ở hai nguồn năng lượng khác nhau (đường dọc đứt nét) cho thấy rằng các vật chất này có thể được đặc trưng bằng cách so sánh hệ số suy giảm khối của chúng ở mức năng lượng thấp và cao. Khi những hình ảnh được tái dựng hình lại ở hai mức năng lượng 50 keV và 80 keV thì Iốt chứng tỏ hệ số suy giảm khối lớn hơn canxi ở năng lượng cao hơn, trong khi đậm độ của nước vẫn không thay đổi nhiều hay ít (9). Đỉnh suy giảm của Iốt ( Z=53) ở mức năng lượng 33.2 keV. Đỉnh này đại diện cho năng lượng liên kết K-edge của Iốt (2). Hệ số suy giảm lớn có nghĩa là chùm tia nhanh chóng bị “suy giảm” (suy yếu) khi nó đi qua môi trường, và hệ số suy giảm nhỏ có nghĩa là môi trường tương đối trong suốt với chùm tia.
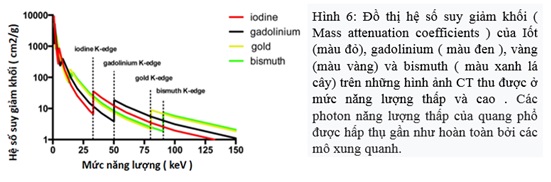
Theo Boussel et al cho thấy khả năng phân biệt các thành phần mảng xơ vữa mạch vành khác nhau dựa trên sự khác biệt về suy giảm phổ và độ tương phản dựa trên nồng độ Iốt. Đáng chú ý, sự hấp thụ các photon năng lượng thấp của cơ thể con người cho thấy việc sử dụng hình ảnh ở mức năng lượng K -edge của Iốt là 33,2 keV. Do đó, để khai thác toàn bộ lợi ích của hình ảnh ở mức năng lượng K -edge bằng cách sử dụng CT đếm photon, nên sử dụng vật liệu tương phản có K-edge cao hơn như gadolinium (50,2 keV), vàng (80,6 keV) và bismuth (90,5 keV) (Hình 6 )(2).
3. Phân tích và xử lý ảnh.
Trong hình ảnh chụp cắt lớp vi tính (CT), các vật liệu có thành phần nguyên tố khác nhau có thể được biểu diễn bằng các số CT (đơn vị Hounsfield, HU) giống nhau hoặc rất giống nhau, khiến cho việc phân biệt và phân loại các loại mô khác nhau trở nên vô cùng khó khăn. Một ví dụ kinh điển là khó phân biệt giữa các mảng vôi hóa và máu có chứa iốt. Mặc dù các vật liệu này khác nhau đáng kể về số lượng nguyên tử, tùy thuộc vào mật độ khối hoặc nồng độ iốt tương ứng, mảng vôi hóa hoặc xương liền kề có thể xuất hiện giống hệt như máu có chứa iốt khi chụp CT. Ngoài những khó khăn trong việc phân biệt và phân loại các loại mô, độ chính xác mà nồng độ vật liệu có thể đo được bị suy giảm do sự hiện diện của nhiều loại mô. Ví dụ, khi đo lượng tăng bắt thuốc Iốt của tổn thương mô mềm, số CT trung bình đo được trên tổn thương không chỉ phản ánh sự tăng bắt thuốc do iốt, mà cả số CT của mô bên dưới. Lý do cho những khó khăn này trong việc phân biệt và định lượng các loại mô khác nhau là do số CT đo được của một voxel có liên quan đến hệ số suy giảm tuyến tính (E), không phải là duy nhất cho bất kỳ vật liệu nào, nhưng là một chức năng của thành phần vật liệu , năng lượng photon tương tác với vật liệu và mật độ khối của vật liệu(8).
Hiện nay, cách tiếp cận để trích xuất thông tin hai mức năng lượng từ dữ liệu ban đầu được sử dụng phổ biến hơn là tái tạo lại hình ảnh CT chuẩn bao gồm các voxels trong các đơn vị Hounsfield và sau đó sử dụng các thuật toán xử lý ảnh để trích xuất thông tin phổ cụ thể từ sự khác biệt giữa các voxels tương ứng, với hệ thống tái tạo hình ảnh cung cấp hình ảnh điện thế thấp và cao và một loạt các hình ảnh có mức năng lượng trung bình (6).
Phân tích hai mức năng lượng sau đó được thực hiện trên hai mức điện thế sử dụng thuật toán dựa trên hình ảnh. Ba loại thuật toán chính đang được sử dụng: Loại thứ nhất tối ưu hóa hình ảnh là hình ảnh đơn sắc, trong đó đậm độ (tính theo đơn vị Hounsfield) cho mỗi voxel được ngoại suy thành một năng lượng nhất định từ hai giá trị đậm độ tại các năng lượng photon thu được (đơn sắc hoặc một mức năng lượng) ; loại thứ hai xác định hoặc phân biệt các vật chất nhất định, xác định độ dốc giữa các giá trị đậm độ ở cả phổ thu được và phân biệt vật chất trên cơ sở hiệu ứng quang điện trong phạm vi đậm độ nhất định, đó là màu được gán ở cả hai phía của độ dốc ví dụ phân biệt axit uric với magiê hoặc canxi hoặc phân biệt Iốt và canxi và loại thứ ba định lượng sử dụng phân tách ba chất, định lượng một trong ba chất (Hình 7B). Độ dốc được xác định bởi đậm độ của hai thành phần cơ bản (ví dụ: mô mềm và mỡ cho gan hoặc mô mềm và không khí cho phổi), và độ dốc thứ hai được xác định bởi hiệu ứng quang điện của chất tương phản được định lượng (nghĩa là Iốt hoặc xenon). Các giá trị đậm độ được đo ở cả hai năng lượng sau đó được hiểu là sự dịch chuyển từ độ dốc thứ nhất dọc theo cái thứ hai (tức là, như một sự tăng cường Iốt nhất định trong một cơ quan bao gồm hai thành phần cơ bản). Sự cải thiện này sau đó được mã hóa bằng màu sắc hoặc cũng bị trừ khỏi hình ảnh (ví dụ, iốt trong nhu mô gan hoặc phổi) (6).
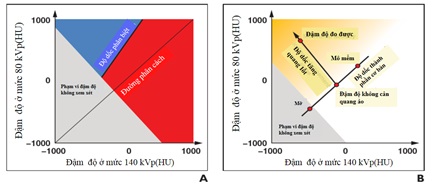
Hình 7: Sơ đồ của các thuật toán xử lý ảnh (6). A, Thuật toán được sử dụng để phân biệt hai chất với nhau. Độ dốc xác định sự phân tách dựa trên sự khác biệt về đậm độ của hai chất theo đơn vị Hounsfield. Hai chất được mã hóa màu bằng màu đỏ ( can xi) hoặc màu xanh (Iốt). B, Thuật toán được sử dụng để phân tách ba chất. Hai thành phần cơ bản xác định một độ dốc và độ dốc của độ dốc thứ hai được xác định bởi hiệu ứng quang điện của Iốt. Hàm lượng Iốt có thể được định lượng và mã hóa màu bằng cách dịch chuyển các cặp giá trị đậm độ đo được dọc theo độ dốc thứ hai. Đậm độ không cản quang ảo được biểu thị bằng giao điểm của cả hai sườn.
Thuật toán phân tách vật việu.
CT hai mức năng lượng (DECT) có thể cung cấp thông tin cụ thể cho vật liệu bằng thuật toán phân rã vật liệu phân tích sự thay đổi hệ số suy giảm mô giữa các lần chụp ở năng lượng thấp và năng lượng cao. Trong khi hình ảnh CT một mức năng lượng chỉ có thể cung cấp thông tin số CT ; với DECT, người ta có thể thu được nhiều dữ liệu khác như số nguyên tử Z hữu hiệu (Zeff), mật độ điện tử và số CT một mức năng lượng. DECT cũng có thể làm giảm các vật liệu làm cứng chùm tia và cung cấp các phép đo suy giảm chính xác hơn về mặt định lượng, được xem xét là những lợi ích chính của hình ảnh DECT đơn sắc ảo. Mặc dù bản đồ Iốt trong hệ thống hiện tại có thể ước tính nồng độ của chất tương phản, nhưng nó chỉ sử dụng dữ liệu CT. Nghiên cứu hiện tại cho thấy dữ liệu vật liệu chi tiết của các giá trị Zeff và số CT đơn sắc. Có khả năng những dữ liệu này góp phần cải thiện độ chính xác của ước tính nộng độ chất tương phản bằng cách sử dụng các giá trị Zeff và số CT đơn sắc ngoài số CT thông thường. Nghiên cứu trong tương lai nên cải thiện chất lượng hình ảnh của các giá trị Zeff và tìm cách thiết lập một phương pháp phân biệt giữa độ tương phản mô trung bình và các mô khác sử dụng những dữ liệu khác nhau cho bệnh nhân trong điều kiện lâm sàng (12).
Khả năng của CT hai mức năng lượng hoặc đa năng lượng để phân tách vật liệu thành các thành phần cấu thành của nó phụ thuộc vào bản chất phụ thuộc năng lượng và yếu tố của suy giảm tia X. Trong dải năng lượng chẩn đoán (E <150 keV), sự suy giảm của tia X theo vật chất chủ yếu là do hiệu ứng quang điện và các quá trình tán xạ Compton. Do sự suy giảm tia X phụ thuộc chủ yếu vào hai cơ chế tương tác này, nên bất kỳ hệ số suy giảm vật liệu nào cũng có thể được biểu diễn dưới dạng kết hợp tuyến tính của các hệ số suy giảm của hai vật liệu cơ bản.Việc sử dụng đầu thu đếm photon trong CT có thể cung cấp nhiều thông tin quang phổ hơn các hệ thống CT hai mức năng lượng. Với việc sử dụng các kỹ thuật phân tách vật liệu, người ta có thể có được mật độ khối, số nguyên tử Z hữu hiệu hoặc thông tin cụ thể về vật liệu khác. Các ứng dụng lâm sàng sử dụng các khả năng này có thể được phân thành hai loại chính, trong đó đầu tiên là định lượng nồng độ của một thành phần nhất định của hỗn hợp. Hỗn hợp thường liên quan đến hai hoặc nhiều vật liệu có thành phần nguyên tố đã biết, chẳng hạn như iốt, mô mềm và chất béo. Điều này có thể được áp dụng, ví dụ, để định lượng sự hấp thu vật chất tương phản ở gan. Loại ứng dụng lâm sàng thứ hai là phân loại vật liệu thành các nhóm được xác định trước, chẳng hạn như axit uric so với sỏi tiết niệu không axit uric. Việc phân loại có thể dựa trên thông tin số nguyên tử Z hữu hiệu từ sự phân hủy vật liệu hoặc các phép đo độc lập với mật độ, chẳng hạn như tỷ lệ của số CT được đo trong hình ảnh năng lượng thấp so với hình ảnh năng lượng cao (8).
Một thuật toán phân tách ba vật liệu cũng có thể được sử dụng để định lượng nồng độ của ba vật liệu có thành phần nguyên tố đã biết trong một hỗn hợp. Trong trường hợp không có khả năng thực hiện hình ảnh dựa vào mức năng lượng liên kết lớp K, khả năng định lượng ba vật liệu chỉ từ hai phép đo duy nhất phụ thuộc vào việc đưa ra thông tin thứ ba, thường là giả định về khối lượng hoặc bảo toàn khối lượng. Về mặt khái niệm, số CT của ba vật liệu có thành phần và mật độ đã biết được vẽ trên đồ thị, trong đó trục y là số CT ở mức năng lượng thấp (ví dụ: 80 kV) và trục x là số CT ở mức năng lượng cao (ví dụ, 140 kV). Lý tưởng nhất, ba vật liệu cơ bản nên đủ khác nhau để tạo ra một tam giác rộng trong cốt truyện này. Sau đó, các cặp số CT tương ứng từ các hình ảnh năng lượng thấp và năng lượng cao được ánh xạ lên sơ đồ hiệu chuẩn. Tùy thuộc vào vị trí của chúng trong sơ đồ, thành phần vật liệu hoặc phần trăm của một vật liệu nhất định được ước tính. Các voxels có thể được mã hóa màu theo loại vật liệu hoặc thành phần phần trăm của các vật liệu cơ bản được báo cáo. Ngoài ra, một hoặc nhiều vật liệu cơ bản có thể bị ức chế hoặc tăng cường, tùy thuộc vào ứng dụng lâm sàng mong muốn. Mức nhiễu trong các hình ảnh năng lượng thấp và năng lượng cao và mức độ khác biệt về số lượng nguyên tử Z hữu hiệu giữa các vật liệu cơ bản từng ảnh hưởng đến độ chính xác của sự phân biệt vật liệu (8).Theo Spiers et al đề xuất định nghĩa của Z eff để xem xét sự hấp thụ tia X của mô người (13):
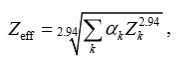
Trong đó α k là tỷ lệ electron và Z k là số nguyên tử Z của nguyên tố k. Một ví dụ là nước (H 2 O), được tạo thành từ hai nguyên tử hydro (Z = 1) và một nguyên tử oxy (Z = 8), tổng số electron là 1 + 1 + 8 = 10, do đó tỷ lệ electron đối với hai hydrogens là (2/10) và đối với một oxy là (8/10). Vì vậy, Zeff cho nước là:
![]() =7,42
=7,42
Thông thường, phép đo Z eff được thực hiện bằng cách sử dụng hệ số suy giảm ( đơn vị HU) được đo bằng tia X với hai năng lượng khác nhau
Theo Torikoshi và cộng sự, phép đo số nguyên tử Z hữu hiệu có thể được mô tả bởi tỷ lệ của 2 hệ số suy giảm (LAC) ở hai mức năng lượng tia X đơn sắc khác nhau Ea và Eb. Vì hình ảnh CT là sự phân phối của LAC, nên tỷ lệ này có thể thu được bằng cách chia hình ảnh CT thu được bởi hai năng lượng tia X đơn sắc khác nhau Ea và Eb.
Số nguyên tử Z hữu hiệu của một số mô: Phổi ( Zeff : 7,84-7,86), Mỡ ( Zeff = 6,4), mô vú ( Zeff = 7,24), Não ( Zeff = 6,3), nước thuần nhất ( Zeff =8,11), xương xốp ( Zeff = 10,9), vỏ xương ( Zeff =14,1) (13).
Nguyên tử Z hữu hiệu có thể được khai thác để tách biệt những mô có cùng số CT (HU) trên hình ảnh CT thông thường. Các hình ảnh dựa vào nguyên tử Z hữu hiệu – được mã hóa màu dựa trên số nguyên tử Z hữu hiệu của mô, những ứng dụng lâm sàng của hình ảnh nguyên tử Z hữu hiệu là mô tả đặc tính của mô. Các hệ số của các thành phần hấp thụ quang điện và tán xạ Compton được tính toán trong quá trình phân tách phổ. Số nguyên tử Z hữu hiệu cung cấp mức độ phân biệt cao hơn mức suy giảm trong HU vì nó mô tả cấu trúc vật chất của từng pixel(14).
Các hình ảnh đa sắc ở mức KV thấp và cao có thể được sử dụng để phân biệt giữa 2 vật chất. Một ví dụ có liên quan trong chụp CT mạch máu là sự khác biệt giữa xương và mạch máu có lấp đầy Iốt trong lòng mạch để loại bỏ xương và canxi một cách tự động khỏi các hình ảnh. Thuật toán được giải thích tốt nhất bằng sơ đồ hiển thị số CT (đậm độ HU) của mỗi ảnh pixel ở mức kV thấp như là một hàm của số CT của nó ở mức kV cao. Các ảnh pixel chứa hỗn hợp máu và Iốt ở các nồng độ khác nhau xếp dọc theo một đường thẳng có độ dốc > 1, vì số CT của Iốt ở kV thấp cao hơn đáng kể so với kV cao do hậu quả của mức liên kết K của Iốt tại 33.2 keV. Trong thực tế, các pixel sẽ được phân phối trong vùng lân cận của dòng này vì độ nhiễu của ảnh. Các pixel hình ảnh chứa hỗn hợp tủy xương và xương (với canxi là thành phần chính) sẽ xếp dọc theo một đường thẳng khác với độ dốc khác nhau, nhỏ hơn. Bằng cách giới thiệu một đường phân cách giữa cả hai dòng, các pixel xương có thể được tách ra khỏi các pixel Iốt (Hình 8) và bị xóa khỏi dữ liệu hình ảnh. Theo Vlahos et al, phép loại bỏ xương từ 2 mức năng lượng nhanh hơn so với việc phân chia xương bằng tay và có thể chính xác hơn, đặc biệt là khi có sự dính sát nhau của xương với mạch máu(10).

CT phổ có khả năng phân tích thông tin dựa vào hai cách tiếp cận khác nhau: đánh giá đơn sắc và phân tách chất.Trên cơ sở các đặc tính hệ số suy giảm khối của vật chất, một tổ hợp tuyến tính của hình ảnh Iốt-nước được sử dụng để tạo ra hình ảnh CT đơn sắc ở bất kỳ mức năng lượng nào từ 40 đến 140 keV. Phân tích đơn sắc cho phép hình dung giải phẫu ở các mức năng lượng khác nhau, từ 40 đến 140 keV. Các cấp độ khác nhau cho thấy độ sáng cũng như các mảng xơ vữa với cường độ, diện tích và thể tích khác nhau. Một số nghiên cứu trong các tình huống lâm sàng khác nhau đã chứng minh rằng CT phổ ở mức năng lượng thấp hơn cho phép giảm lượng Iốt đáng kể, với chất lượng hình ảnh và khả năng giải thích tương tự như CT một mức năng lượng (SECT) với lượng Iốt đầy đủ. Giảm thể tích Iốt lên tới 60 -70% đã được báo cáo trong chụp CT ĐMC và lên đến 50% trong chụp CT ĐMV. Mặc dù sơ bộ và giả thuyết tạo ra, những điều này có thể có khả năng có ý nghĩa lâm sàng đến những bệnh nhân có nguy cơ bị suy thận cấp do thuốc cản quang (15).
Hình ảnh ban đầu thu được từ hệ thống đầu thu gọi là hình ảnh đa sắc ( Polychromatic) hay hình ảnh hỗn hợp (mixed imaging) tương tự hình ảnh thu được từ CT thường qui hay CT một mức năng lượng và tương ứng mức năng lượng trung bình. Từ hình ảnh đa sắc, mô có thể được phân tách sang những mức năng lượng đơn sắc (monochromatic) khác nhau ( 40KeV, 50KeV, …, 130KeV, 140KeV) điều mà có thể cải thiện cho việc đọc diễn giải phân tích hình ảnh của tim và mạch vành (Hình 9 và Hình 10). Ví dụ: sử dụng một mức năng lượng đơn sắc như 40 keV thì nó gần với mức năng lượng liên kết lớp K của Iốt (33,2 KeV), khi đó tia X hấp thu gần như hoàn toàn tạo hình ảnh có độ tương phản cao nhưng bị nhiễu nhiều và bị xảo ảnh do hiện tượng làm cứng chùm tia. Ở mức năng lượng thấp 40 KeV-60 KeV, đánh giá đơn sắc cho thấy tăng quang trong lòng mạch có ý nghĩa, vì vậy cho phép chúng ta giảm được lượng thuốc cản quang cần thiết trong chụp CT mạch máu đến 50%(3), đặc biệt có lợi cho bệnh nhân suy thận. Ngoài ra ở mức năng lượng thấp có thể giúp phân biệt được những khiếm khuyết tưới máu cố định ( fixed defects) trong cơ tim, xác định những vùng cơ tim thiếu máu, hoại tử hay xẹo một cách dễ dàng. CT phổ còn có vai trò đánh giá nhồi máu cơ tim (NMCT), sống còn cơ tim nhưng số lượng bệnh nhân tham gia nghiên cứu còn ít (3,16). Ngược lại, khi sử dụng một mức năng lượng đơn sắc cao như 140 keV thì nó lớn hơn với mức năng lượng liên kết lớp K của Iốt (33,2 KeV), khi đó tia X hấp thu không hoàn toàn tạo hình ảnh có độ tương phản thấp, ít bị nhiễu hơn và không bị xảo ảnh do hiện tượng làm cứng chùm tia, có thể loại bỏ Iốt của hình ảnh, hình ảnh này còn gọi là hình ảnh không có thuốc cản quang ảo (Virtual Non-contrast Images)(3). Với hình ảnh đơn sắc ở mức 140 KeV, chúng ta có thể tính điểm số vôi hóa ĐMV mà không cần phải thực hiện một lần chụp CT không tiêm thuốc cản quang trước khi chụp CT động mạch vành có tiêm chất cản quang, điều này làm giảm phơi nhiễm tia cho bệnh nhân(17). Hình ảnh không cản quang ảo tương tự như hình ảnh không dùng thuốc cản quang thực sự và giúp giảm liều bức xạ ion hóa 50-60%, thậm chí có vài nghiên cứu cho thấy liều bức xạ ion hóa giảm đến 90% bằng cách loại bỏ những lần chụp không tiêm thuốc cản quang trước khi chụp có tiêm thuốc cản quang(2).
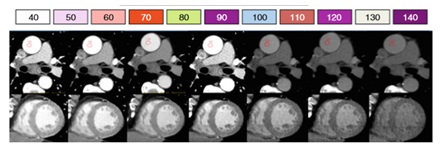
Hình 9: Đánh giá đơn sắc( phổ năng lượng). Đồ thị cho thấy 2 mức năng lượng của đầu đèn 80KVP và 140KVP. Chúng tạo phổ năng lượng tử 40-140keV, phổ năng lượng thấp cho thấy độ tương phản bên trong lòng mạch hơn nhưng bị nhiễu nhiều hơn, phổ năng lượng cao cho thấy độ tương phản trong lòng mạch ít hơn nhưng ít bị nhiễu hơn. Hình ảnh ở ĐM chủ và thất trái cho thấy những gì xảy ra ở các mức năng lượng khác nhau với độ tương phản và xảo ảnh.
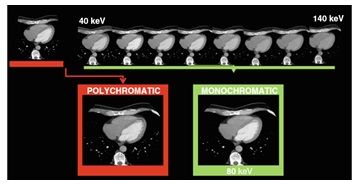
Hình 10: Từ hình ảnh đa sắc đến đánh giá đơn sắc để giảm xảo ảnh do hiện tượng cứng chùm tia. Hình ảnh đa sắc cho thấy khiếm khuyết tưới máu ở vùng mỏm thất trái . Đánh giá đơn sắc ở những mức năng lượng khác nhau cho thấy tưới máu bình thường ở mỏm thất trái. Như vậy hình ảnh giảm tưới máu ở mỏm thất trái trên hình đa sắc là xảo ảnh do hiện tượng cứng chùm tia.
III. Ứng dụng của CT phổ trong tim mạch:
Nhiều nghiên cứu cho thấy CT tim đã vượt qua sự đánh giá đơn thuần của hẹp ĐMV thành một phương tiện hình ảnh cho phép xác định chính xác mảng xơ vữa, đánh giá tưới máu cơ tim, viêm cơ tim, bệnh cơ tim không do thiếu máu cục bộ(TMCB), tái hẹp trong stent mạch vành hay xảo ảnh, rò bên trong stent graft ở ĐMC, phát hiện cả thuyên tắc phổi cấp tính và mãn tính (CTEPH). Ngoài ra CT phổ còn giúp chẩn đoán phân biệt huyết khối hay u trong buồng tim và giảm xảo ảnh do van cơ học (2,11).
- Đánh giá tưới máu cơ tim:
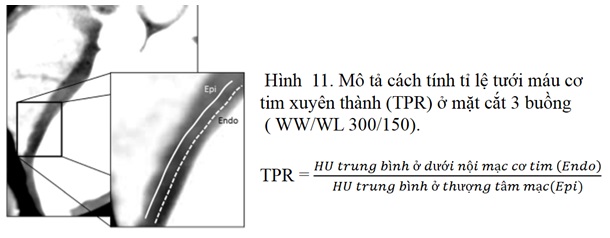
Đánh giá tưới máu cơ tim là ứng dụng có giá trị nhất của CT phổ trong tim mạch (1). Khi dùng thuốc tương phản có thể cho thấy tính bắt thuốc động học khác nhau giữa các vùng cơ tim bình thường, vùng cơ tim thiếu máu và NMCT bởi vì hầu hết các mô bao gổm cơ tim, thành phần chính vẫn là nước, tái tạo hình ảnh loại bỏ nước từ CT hai mức năng lượng sẽ cho phép định lượng Iốt và có thể định lượng tưới máu cơ tim (5). Hình ảnh tưới máu cơ tim có khả năng xác định hẹp ĐMV có ý nghĩa về huyết động, mặc dù hình ảnh tưới máu cơ tim trước đây đã được thực hiện bởi CT thường qui, tuy nhiên kỹ thuật phân tích này thường bị hạn chế bởi những xảo ảnh do chuyển động và hiện tượng làm cứng chùm tia điều này làm giảm độ chính xác và độ đặc hiệu. CT phổ có khả năng làm giảm xảo ảnh do hiện tượng cứng chùm tia làm tăng độ đặc hiệu, ngoài ra CT phổ còn tạo ra bảng đồ phân bố Iốt trong cơ tim giúp xác định tình trạng tưới máu cơ tim. Có nhiều phương thức thực hiện đánh giá tưới máu cơ tim bao gồm(16, 24): chỉ thực hiện trong thời kỳ nghỉ(không dùng chất dãn mạch), thực hiện giai đoạn gắng sức trước với các chất dãn mạch(Adenosine, Dipirydamol, Regadenoson) sau đó đến giai đoạn nghỉ (Stress-Rest) và ngược lại. Nếu xác suất mắc bệnh ĐMV cao trước khi thực hiện kỹ thuật này thì chúng ta chọn phương thức Stress-Rest vì mục tiêu là cần xác định tình trạng thiếu máu cục bộ cơ tim (TMCBCT), còn nếu xác suất mắc bệnh ĐMV thấp hoặc không có vôi hóa ĐMV thì chọn phương thức Rest-Stress vì mục tiêu là để loại trừ bệnh ĐMV. Tất cả các hình ảnh trong giai đoạn gắng sức và giai đoạn nghỉ đều cho phép đánh giá khiếm khuyết tưới máu cố định và khiếm khuyết tưới máu có hồi phục (fixed and reversible perfusion defects)(16). Trong phân tích bán định lượng cho đánh giá tưới máu cơ tim bằng CT, theo sự đồng thuận của hội CT tim Hoa kỳ năm 2020 đánh giá khiếm khuyết tưới máu cơ tim được đánh giá trực quan bằng mô hình 17 phân vùng cơ tim của Hiệp hội Tim mạch Hoa Kỳ, khuyên rằng các khiếm khuyết tưới máu phải được ghi điểm bởi sử dụng các điểm sau (24): a) Mức độ nghiêm trọng: xem có hiện tượng giảm tưới máu hay không (nhị phân). Ngoài ra, có thể hữu ích để mô tả mức độ nghiêm trọng của khiếm khuyết tưới máu bằng cách sử dụng thang đo liên tục ở mức độ nhẹ, trung bình hoặc nặng. b) Kích thước: Kích thước của vùng khiếm khuyết tưới máu (nhỏ, trung bình hoặc lớn) cũng như vùng khiếm khuyết tưới máu xuyên thành cơ tim (> 50%) hoặc không xuyên thành (<50%). Tỉ lệ tưới máu cơ tim xuyên thành ở một phân vùng cơ tim ( transmural perfusion ratio-TPR ), được tính bằng cách lấy đậm độ HU trung bình trong vùng khảo sát (ROI) ở dưới nội mạc cơ tim chia cho đậm độ HU trung bình ở thượng tâm mạc, nếu TPR < 1 là bất thường, nếu TPR < 0,75 thì gợi ý nhiều cho thiếu máu cơ tim (Hình 11) (25). c) Khả năng hồi phục (Reversibility): Khiếm khuyết tưới máu cũng nên được mô tả là có thể hồi phục (khiếm khuyết tưới máu chỉ xuất hiện trên các hình ảnh tưới máu cơ tim trong thời gian gắng sức), cố định hoặc có thể hồi phục một phần (khiếm khuyết tưới máu trên cả hai hình ảnh tưới máu trong thời gian gắng sức và nghỉ nhưng khiếm khuyết ít hơn trong giai đoạn nghỉ. Theo khuyến cáo của Hội CT tim Hoa Kỳ 2020, thực hiện đánh giá tưới máu cơ tim kết hợp với chụp CT mạch vành có cản quang cho những bệnh nhân: nguy cơ cao mắc bệnh tim TMCB, bệnh ĐMV đã biết, đã can thiệp ĐMV trước đây, hẹp ĐMV ở mức độ trung bình, vôi hóa mạch vành có ý nghĩa (24).
CT phổ đánh giá tưới máu cơ tim dựa vào hai cách khác nhau là phân tích đơn sắc (Monochromatic analysis) và phân tách chất (Material Decomposition). Có nhiều nghiên cứu cho thấy CT phổ có kết quả tốt trong đánh giá tưới máu cơ tim so với các phương pháp chẩn đoán hình ảnh được xem như là tiêu chuẩn vàng như MRI tim và SPECT . Theo Meinel và cộng sự cho thấy so với SPECT thì CT phổ có khả năng đánh giá tưới máu cơ tim với độ nhạy 92% và độ đặc hiệu 98% nếu chỉ thực hiện giai đoạn nghỉ (Rest scan), còn nếu thực hiện chụp cả 2 giai đoạn vừa gắng sức (Stress Scan) kết hợp giai đọan nghỉ (Rest scan) và giai đoạn tăng quang muộn (Late Enhancement) thì độ chính xác tăng lên đáng kể: độ nhạy 99% và độ đặc hiệu 97% . Theo kết quả này đã gợi ý chụp CT phổ đánh giá tưới máu cơ tim trong cả 2 giai đoạn nghỉ và gắng sức được xem như là một phương tiện chọn lựa đầu tay cho chẩn đoán tưới máu cơ tim(16) (Hình 12). Gần đây theo hướng dẫn của hội tim mạch Châu Âu 2019, chọn lựa phương tiện chẩn đoán hình ảnh chức năng không xâm lấn cho TMCBCT hoặc chụp CT động mạch vành có cản quang được xem như là phương tiện chẩn đoán chọn lựa đầu tiên cho việc chẩn đoán bệnh ĐMV ở bệnh nhân có triệu chứng (mức chứng cứ nhóm I B)(17). Như vậy CT phổ không những đánh giá tốt về giải phẫu ĐMV mà còn là phương tiện hình ảnh chức năng đánh giá tốt về TMCBCT.
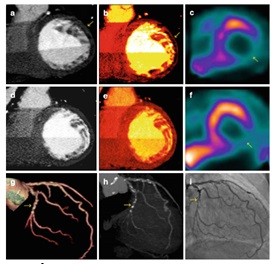
Hình 12 : Chụp CT phổ đánh giá tưới máu cơ tim: hình a (thang xám) và b (thang màu) cho thấy vùng giảm tưới máu ở thành bên và thành bên dưới trong giai đoạn gắng sức (mũi tên), điều này phù hợp với hình ảnh giảm tưới máu trong giai đoạn gắng sức trên SPECT (hình c). Trên hình d và e cho thấy khiếm khuyết tưới máu đã cố định, kích thước nhỏ ở thành bên trong giai đoạn nghĩ, phù hợp với SPECT (hình f). Như vậy bệnh nhân này có khiếm khuyết tưới máu đã cố định ở thành bên phối hợp với giảm tưới máu có hồi phục. Trên chụp MSCT động mạch vành và chụp mạch vành can thiệp (Hình g, h và I) cho thấy mạch vành vôi hóa và xơ vữa nặng, hẹp nặng LCX II (16).
- Đánh giá bệnh cơ tim không do TMCB:
Tăng bắt thuốc cản quang muộn (Delayed myocardial enhancement hay Late Enhancement) được xem là một dấu hiệu của xơ hóa cơ tim hoặc sẹo và là một tính năng quan trọng trong đánh giá NMCT và khả năng sống còn cơ tim cũng như đánh giá bệnh cơ tim không do TMCB. Với việc tạo ra hình ảnh đơn sắc và bản đồ Iốt và khả năng đánh giá tốt hơn việc tăng bắt thuốc cản quang muộn, CT phổ có thể khắc phục được những hạn chế của CT thông thường. Mặc dù CT phổ đã được thực hiện trong lâm sàng cho việc đánh giá tăng bắt thuốc cản quang muộn, tuy nhiên còn thiếu những nghiên cứu có số lương bệnh nhân lớn. So với MRI tim được xem là tiêu chuẩn vàng trong đánh giá tăng bắt thuốc tương phản muộn thì CT phổ có độ nhạy 72-77% và độ đặc hiệu 88-92% trong đánh giá NMCT cũ, độ nhạy này cao hơn một cách có ý nghĩa so với hình ảnh CT thông thường. Ngoài ra tăng bắt thuốc cản quang muộn trên CT phổ còn có thể phát hiện bệnh cơ tim không do TMCB (Hình 13) (1) .
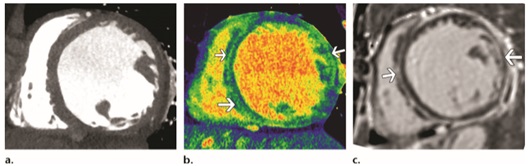
Hình 13: Tăng bắt thuốc cản quang muộn ở bệnh nhân bị Sarcoidosis ở tim với suy tim, thất trái dãn to phù hợp bệnh cơ tim dãn, không có bất thường cơ tim được phát hiện trên hình ảnh CT phổ ở mặt cắt ngang thất trái (hình a), bảng đồ Iốt cho thấy tăng bắt thuốc cản quang muộn (mũi tên) ở vùng cơ tim thất trái phù hợp với bệnh cơ tim không do TMCB (hình b), hình ảnh MRI tim cho thấy tăng bắt thuốc tương phản muộn ở mặt cắt ngang thất trái phù hợp với những dấu hiệu trên CT phổ ở bệnh nhân bị bệnh cơ tim không do TMCB (hình c),
- Chẩn đoán viêm cơ tim cấp:
CT phổ còn là một kỹ thuật mới chẩn đoán viêm cơ tim cấp dựa vào hình ảnh tăng quang muộn với Iốt (Late Iodine Enhancement) (Hình 14). Trong một nghiên cứu khi so sánh với MRI tim trong chẩn đoán viêm cơ tim cấp, cho thấy CT phổ có độ nhạy rất cao 100% dựa trên phân tích bệnh nhân và độ nhạy 82% khi so sánh theo từng vùng, độ đặc hiệu 99%, giá trị tiên đoán dương 94%, giá trị tiên đoán âm 95% và tính phù hợp giữa 2 phương pháp này rất cao, hệ số Kappa= 0.84 (18)
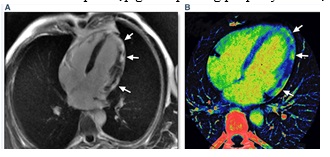
Hình 14: Hình ảnh tăng bắt thuốc muộn với gadolinium (Late Gadolinium Enhancement ) ở mặt cắt 4 buồng trên MRI tim cho thấy viêm cơ tim dưới thượng tâm mạc ở thành bên và vùng mỏm thất trái (A). Tương tự, trên hình CT phổ cũng cho hình ảnh tăng quang muộn với Iốt (B).
4. Đánh giá xơ vữa mạch vành:
Phân tích đơn sắc cho phép hình dung giải phẫu ở các mức năng lượng khác nhau, từ 40 đến 140 keV. Các cấp độ khác nhau cho thấy độ sáng cũng như các mảng xơ vữa với cường độ, diện tích và thể tích khác nhau. Với đánh giá đơn sắc, xảo ảnh do hiện tượng cứng chùm tia và xảo ảnh do vôi hóa đã giảm đáng kể (15) (Hình 15).
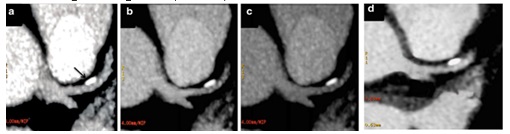
Hình 15. Trên hình CT 2 mức năng lượng: Xơ vữa kèm vôi hóa đoạn gần LAD, mãng xơ vữa lớn ở mức 40keV (a), mãng xơ vữa nhỏ hơn ở mức 60keV (b) và mãng xơ vữa giảm kích thước hơn nữa ở 80keV (c). Trên CT một mức năng lượng: xơ vữa kèm vôi hóa có kích thước bằng với mức 60keV (d).
5. Đánh giá tái hẹp trong stent mạch vành hay xảo ảnh:
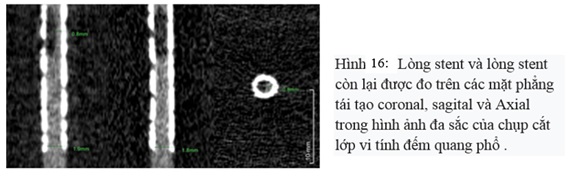
CT phổ có khả năng đánh giá tốt các chất và các mô khác nhau mà không có xảo ảnh của hiện tượng cứng chùm tia, do đó CT phổ đánh giá tốt tái hẹp trong stent mạch vành hay xảo ảnh, trong một nghiên cứu cho thấy đường kính lòng stent nhìn thấy tốt hơn đối với chụp cắt lớp vi tính với đầu thu đếm quang phổ (SPCCT) so với chụp cắt lớp vi tính với đầu thu có hai lớp (DLCT) (Hình 16 và Hình 17)(19).
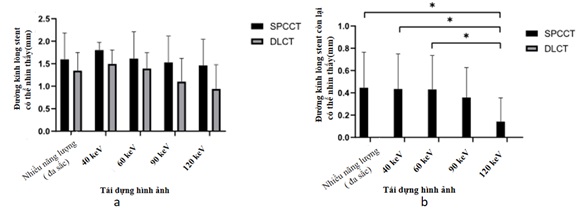
Hình 17 : (a): Đường kính lòng stent nhìn thấy tốt hơn đối với chụp cắt lớp vi tính với đầu thu đếm quang phổ (SPCCT) so với chụp cắt lớp vi tính với đầu thu có hai lớp(DLCT), và không có ý nghĩa thống kê.giữa hình ảnh đa sắc và đơn sắc keV thấp với hình ảnh đơn sắc keV cao.
(b): Lòng mạch còn lại của tất cả 10 stent. Không có lòng mạch còn lại có thể được mô tả cho chụp cắt lớp vi tính với đầu thu có hai lớp. Các giá trị cho hình ảnh đa sắc và đơn sắc keV thấp hơn có thể so sánh và cao hơn đáng kể so với đơn sắc 120 keV (* P <0,05)
- Đánh giá đường dò bên trong stentgraft ở ĐMC.
CT phổ còn giữ vai trò quan trọng trong việc đánh giá đường dò trong stentgraft ở ĐMC sau can thiệp đặt stentgraft ở bệnh nhân phình bóc tách ĐMC, điều này hay gặp khó khăn đối với CT thông thường do ảnh hưởng của xảo ảnh kim loại hay hiện tượng cứng hóa chùm tia, hơn nữa bệnh nhân bị phơi nhiễm bức xạ cao.
Phần lớn bệnh lý ĐMC cần thực hiện chụp MSCT ĐMC ở nhiều pha (không cản quang, động mạch và tỉnh mạch), dẫn đến liều bức xạ cao. Đặc biệt ở những bệnh nhân thường xuyên phải trải qua chụp MSCT điển hình 1 lần/ năm, như bệnh nhân sau khi sửa chữa phình nội mạch ĐMC, các chiến lược giảm liều là mong muốn. CT phổ cung cấp các hình ảnh không cản quang ảo từ các dữ liệu pha động mạch hoặc tĩnh mạch và do đó giảm phơi nhiễm bức xạ gần 50%. Phương thức chụp CTA pha tĩnh mạch và bộ dữ liệu không cản quang ảo đã được đánh giá trong nhiều nghiên cứu cho bệnh nhân sau khi sửa chữa phình nội mạch ĐMC. Các nghiên cứu trong tương lai nên nghiên cứu việc áp dụng các hình ảnh không cản quang ảo trong các bệnh lý động mạch chủ khác, ví dụ: tụ máu trong thành mạch ( intramural hematoma.). Các thuật toán rất hữu ích cho việc đánh giá nhanh và chính xác các dữ liệu hai mức năng lượng của ĐMC: hình ảnh không cản quang ảo, bản đồ Iốt và thuật toán mảng cứng (hard plaque) được sử dụng để phân biệt giữa Iốt và canxi (20)( Hình 18) .
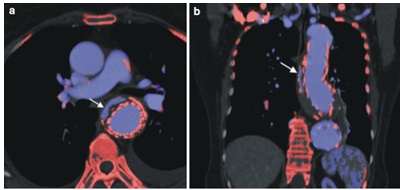
Hình 18 : Áp dụng thuật toán mảng cứng. Trong lát cắt ngang axial (a) và coronal (b) cho thấy Iốt (màu xanh) được phát hiện trong túi phình và bên ngoài stentgraft. Điều này tương ứng với một lỗ dò nội mạch (endoleak) loại I, được xuất phát từ đầu xa của stentgraft (20).
- Phát hiện thuyên tắc phổi
Chụp CT phổ động mạch phổi cho thấy thuyên tắc động mạch phổi không những ở các nhánh lớn mà còn thấy được thuyên tắc ở các nhánh phân thùy hay dưới phân thùy và vùng giảm tưới máu tương ứng trên hình ảnh mã hóa màu (21) ( Hình 19).
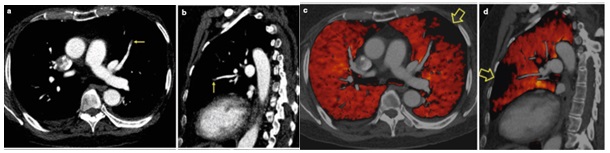
Hình 19: Chụp CT phổ động mạch phổi cho thấy thuyên tắc động mạch phổi ở nhánh phân thùy lưỡi phổi trái (mũi tên) trên mặt cắt Axial (hình a ) và trên mặt cắt Sagital (hình b ), Tương ứng hình ảnh giảm tưới máu dạng hình chêm trên ảnh mã hóa màu ở thùy lưỡi phổi trái (hình c và d)(21).
8. CT phổ giúp chẩn đoán phân biệt huyết khối hay u trong buồng tim .
Mặc dù những khối choán chỗ (huyết khối hay bướu) trong tim không phổ biến, nhưng chúng có khả năng gây nguy cơ tắc mạch cao, vì vậy chẩn đoán chính xác và kịp thời là rất quan trọng. Nó cũng quan trọng về mặt lâm sàng để phân biệt các khối u tim với huyết khối tim vì chúng đòi hỏi các chiến lược điều trị khác nhau. Mặc dù phân biệt chính xác các khối choán chỗ trong tim này có thể là thách thức, chụp CT và chụp MRI là những công cụ đầy hứa hẹn để cải thiện chẩn đoán(22).
Theo Yoo Jin Hong và cộng sự , trong một nghiên cứu phân tích những đặc điểm: đậm độ HU(CT attenuation value) của khối choán chỗ trong thì động mạch và thì muộn và độ tập trung Iốt hay nồng độ Iốt (Iodine concentration) (mg/ml) trên CT hai mức năng lượng và tỷ lệ cường độ tín hiệu (SI) trên MRI tim của huyết khối trong tim và bướu tim này nhằm đánh giá giá trị chẩn đoán của CT hai mức năng lượng để phân biệt giữa khối u tim và huyết khối (Hình 21 và Hình 22, Bảng 1). Khi nồng độ Iốt được sử dụng để phân biệt huyết khối và bướu tim, giá trị ngưỡng tối ưu của nồng độ Iốt cho việc phân biệt giữa huyết khối và bướu tim là 2,55mg/ml, độ nhạy 66,7% và độ đặc hiệu 79%. Diện tích dưới đường cong ROC của nồng độ Iốt (mg/ml) là 0,77( khoảng tin cậy 95%: 0,63-0,91) cao hơn diện tích dưới đường cong ROC của đậm độ HU sau khi tiêm thuốc cản quang là 0,51( khoảng tin cậy 95%: 0.34-0.69), có một sự khác biệt có ý nghĩa thống kê giữa diện tích dưới đường cong ROC của nồng độ Iốt và đậm độ HU sau khi tiêm thuốc cản quang p < 0.001 ( sự khác biệt diện tích dưới đường cong ROC : -0.38, khoảng tin cậy 95%: −0.49 – −0.27, p < 0.001 ) và diện tích dưới đường cong ROC của tỷ lệ SI trên MRI tim là 0,89 cao hơn diện tích dưới đường cong ROC của nồng độ Iốt một cách có ý nghĩa thống kê (AUC; 0.77 vs. 0.89; p = 0.04).(22) .(Hình 20)
| Bướu tim ( n=24) | Huyết khối ( n=19) | Gía trị P ( U so với huyết khối ) | |||||
| Lymphoma ( n=4) | Di căn (n=5) | U nhày (n=9) | U khác* ( n=6) | Tất cả | |||
| Thể tích (cm3) | 32,14 ± 8,77 | 36,5±7,84 | 24,24 ± 5,84 | 9,89 ± 7,16 | 24,52 ± 3,76 | 3,98 ± 4,22 | <0,001 |
| Đậm độ HU | 94,63 ± 21,1 | 88,6 ± 18,88 | 74,11±14,08 | 44,02 ±17,24 | 73,03 ±8,78 | 74,5 ± 9,87 | 0,912 |
| Nồng độ Iốt (mg/ ml) | 3,04 ± 0,58 | 2,96 ± 0,52 | 3,33 ± 0,39 | 2,43 ± 0,47 | 2,98 ± 0,23 | 1,79 ± 0,26 | 0,002 |
| Tỷ lệ SI | 4,13 ± 2,76
| 3,31 ± 3,39 | 10,3 ± 1,95 | 5,92 ± 2,14 | 6,9 ± 0,12 | 1,43 ± 0,14 | 0,008 |
Bảng 1: Phân tích định lượng những dấu hiệu của huyết khối trong tim và bướu tim trên CT hai mức năng lượng và MRI tim, (*) u khác bao gồm: hemangioma (n = 2), lipoma (n = 2), angiofibroma (n = 1), and papillary fibroelastoma (n = 1)

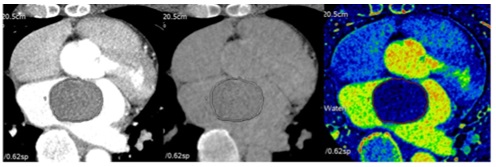
Hình 21 : Hình ảnh phân tích định lượng trên CT 2 mức năng lượng của bướu tim. Ba chế độ hình ảnh thu được bằng cách sử dụng CT 2 mức năng lượng : (A) hình ảnh đơn sắc ở mức nặng lượng 70keV đại diện cho hình ảnh CT sau tiêm cản quang, (B) hình ảnh khử Iốt đại diện cho hình ảnh CT trước tiêm cản quang và (C) hình ảnh bảng đồ Iốt; thể tích toàn bộ khối u được vẽ trên hình ảnh của từng chế độ trên cùng một mức độ của khối u tim.
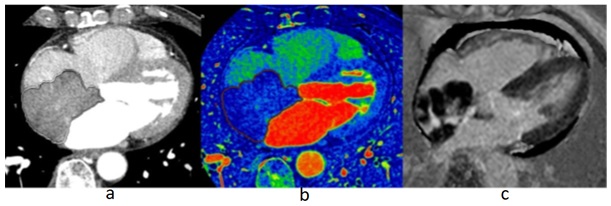
Hình 22: Bệnh nhân nữ 72 tuổi được chẩn đoán Lymphoma nhĩ phải. (a) trên hình chụp CT 2 mức năng lượng có tiêm thuốc cản quang cho thấy có một khối hình nhiều thùy kích thước 68 mm x 48mm trong nhĩ phải.Thể tích của khối này là 47,1cm3, đậm độ HU bên trong của khối là 70HU, (b) bảng đồ Iốt cho thấy nồng độ Iốt trong thể tích khối (VOI) này là 1,67mg/ml, (c) MRI tim thực hiện ba ngày sau, trên hình tăng bắt thuốc tương phản muộn(LGE) cho thấy khối này tăng bắt thuốc ở trung tâm, tỷ lệ SI là 4,16, tràn dịch màng tim lượng ít.
Trong một nghiên cứu 63 bệnh nhân, tổng cộng 13 huyết khối và 19 trường hợp huyết khối tự phát hay máu xoáy tiểu nhĩ trái (spontaneous echo contrast-SEC) đã được phát hiện qua siêu âm tim thực quản(SATTQ). Sử dụng SATTQ làm tiêu chuẩn tham chiếu thì độ nhạy, độ đặc hiệu, giá trị tiên đoán dương và giá trị tiên đoán âm tính của CT tim hai mức năng lượng trong phát hiện huyết khối và SEC trong tiểu nhĩ trái tương ứng là 97%,100%, 100% và 97%. Trên hình ảnh CT, nồng độ Iốt trung bình có ý nghĩa phân biệt giữa huyết khối và máu xoáy nhĩ trái là 1,23 mg/mL ± 6 0,34 (độ lệch chuẩn) đối với huyết khối và 3,61 mg/mL ± 61,01 đối với máu xoáy nhĩ trái (P = 0,001)(Hình 23) (23) .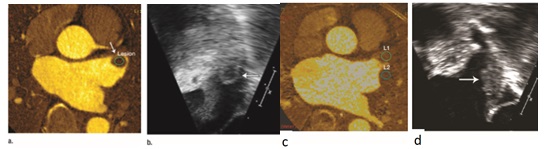 Hình 23 : Hình ảnh CT hai mức năng lượng và SATTQ ở bệnh nhân bị đột quị và huyết khối tiểu nhĩ trái: (a) bảng đồ Iốt cho thấy khiếm khuyết thuốc cản quang trong tiểu nhĩ trái, nồng độ Iốt trung bình trong tổn thương là 1,34mg/ml, (b) SATTQ cho thấy huyết khối ở tiễu nhĩ trái. Hình ảnh CT 2 mức năng lượng và SATTQ ở bệnh nhân bị đột quị, huyết khối và máu xoáy tiểu nhĩ trái: (c) bảng đồ Iốt cho thấy khiếm khuyết thuốc cản quang trong tiểu nhĩ trái, nồng độ Iốt trung bình trong tổn thương 1 là 3,34mg/ml, tổn thương 2 là 1,62mg/ml, (d) SATTQ cho thấy huyết khối và máu xoáy tiểu nhĩ trái .
Hình 23 : Hình ảnh CT hai mức năng lượng và SATTQ ở bệnh nhân bị đột quị và huyết khối tiểu nhĩ trái: (a) bảng đồ Iốt cho thấy khiếm khuyết thuốc cản quang trong tiểu nhĩ trái, nồng độ Iốt trung bình trong tổn thương là 1,34mg/ml, (b) SATTQ cho thấy huyết khối ở tiễu nhĩ trái. Hình ảnh CT 2 mức năng lượng và SATTQ ở bệnh nhân bị đột quị, huyết khối và máu xoáy tiểu nhĩ trái: (c) bảng đồ Iốt cho thấy khiếm khuyết thuốc cản quang trong tiểu nhĩ trái, nồng độ Iốt trung bình trong tổn thương 1 là 3,34mg/ml, tổn thương 2 là 1,62mg/ml, (d) SATTQ cho thấy huyết khối và máu xoáy tiểu nhĩ trái .
IV. Kết Luận
Tóm lại, trong những năm gần đây, đã có những tiến bộ nhanh chóng trong công nghệ chụp cắt lớp vi tính tim mạch, với sự phát triển của chụp CT một mức năng lượng sang chụp CT hai mức năng lượng hay chụp cắt lớp vi tính phổ (CT phổ). CT phổ đại diện cho một lĩnh vực mới nổi của hình ảnh CT lâm sàng. Khả năng của CT phổ để phân biệt các vật liệu có số nguyên tử Z hữu hiệu khác nhau tạo ra một số ứng dụng CT mới và phù hợp về mặt lâm sàng. Kể từ đó, các ứng dụng bổ sung đã được phát triển và các thử nghiệm lâm sàng trong tương lai được thực hiện để đánh giá hiệu quả lâm sàng của các kỹ thuật này. Nghiên cứu và phát triển tích cực trong lĩnh vực này đang diễn ra và đang mang lại các ứng dụng lâm sàng bổ sung hoặc cải tiến. Kết quả là CT phổ hoặc CT đa mức năng lượng đang di chuyển vững chắc vào dòng chính của hình ảnh CT. Các nghiên cứu ban đầu về các công nghệ này đã đầy hứa hẹn và cho thấy tiềm năng của chúng để cải thiện việc đánh giá xơ vữa ĐMV, tăng độ đặc hiệu của chụp cắt lớp vi tính ĐMV trong việc xác định những tổn thương ĐMV có ý nghĩa về huyết động, đánh giá tưới máu cơ tim, viêm cơ tim, bệnh cơ tim không do thiếu máu cục bộ, tái hẹp trong stent mạch vành hay xảo ảnh, rò bên trong stent graft ở ĐMC, chẩn đoán thuyên tắc phổi điều này tương quan rất tốt với xạ hình tưới máu phổi, có khả năng chẩn đoán phân biệt huyết khối tiểu nhĩ trái với hình ảnh do dòng máu chảy chậm, huyết khối trong buồng tim với bướu tim. Ngoài ra liều xạ phơi nhiễm và lượng thuốc cản quang dùng cho bệnh nhân cũng giảm đáng kể. Từ viết tắt: HU: Hounsfield units, SI: Signal IntensityCT: Computed Tomography CTA: Computed Tomography AngiographyMRI: Magnetic Resonance ImagingDECT: Dual-energy computed tomographySECT: Single-energy computed tomographySPECT: Single photon emission computed tomographyCTEPH: Chronic thromboembolic pulmonary hypertension. SCCT: Society of Cardiovascular Computed TomographySPCCT: Spectral photon-counting computed tomographyDLCT: Dual-layer computed tomography.
TÀI LIỆU THAM KHẢO
- Kalisz K (2017). Update on Cardiovascular Applications of Multienergy CT. RadioGraphics, 37:1955–1974.
- Danad I et al (2015). Recent Advances in Cardiac Computed Tomography. JACC Cardiovasc Imaging, 8(6): 710–723
- Patricia M. Carrascosa et al (2015). Dual Energy CT. Patricia M. Carrascosa. Dual-Energy CT in Cardiovascular Imaging, pp.3-10. Springer International Publishing Switzerland.
- Rajiah P et al (2017). Spectral detector CT for cardiovascular applications. Diagn Interv Radiol, 23:187–193.
- James K. Min (2019). Cardiac Computed Tomography. BraunWald’s Heart Disease .A Textbook of Cardiovascular Medicine 11th Volume 1, pp 321-343. Elsevier Inc.
- T.R.C (2012). Dual-Energy CT: General Principles. American Journal of Roentgenology. Vol 199: S3-S8. 10.2214/AJR.12.9116.
- Ravi K. Kaza et al (2012). Dual-Energy CT with Single- and Dual-Source Scanners: Current Applications in Evaluating the Genitourinary Tract. RadioGraphics, No 2: 353–369.
- Cynthia H. Mc Collough, Leng S, Yu L et al (2015). Dual- and Multi-Energy CT: Principles, Technical Approaches, and Clinical Applications. Radiology. September. 276(3): 637–653.
- Saba L et al (2015). Dual Energy CT: Basic Principles. Carlo N. De Cecco. Dual Energy CT in Oncology, pp1-20. Springer International Publishing Switzerland.
- Flohr T, Schmidt B(2015). Technical Aspects of Dual Energy CT with Dual Source CT Systems. Patricia M. Carrascosa. Dual-Energy CT in Cardiovascular Imaging. pp 11-32, Springer International Publishing Switzerland.
- Courtney A. Coursey et al (2010). Dual-Energy Multidetector CT: How Does It Work, What Can It Tell Us, and When Can We Use It in Abdominopelvic Imaging? RadioGraphics, 30:1037–1055.
- Kawahara D, Ozawa S, Yokomachi K, et al. (2018). Accuracy of the raw-data-based effective atomic numbers and monochromatic CT numbers for contrast medium with a dual-energy CT technique. Br J Radiol 91: 20170524.
- Iramina, H., Nakamura, M., Mizowaki, T. and Kanno, I (2018). Effective Atomic Number Mea- surement with Energy-Resolved Compu- ted Tomography Using Two-Dimensional “transXend” Detector. International Jour – nal of Medical Physics , Clinical Engi – neering and Radiation Oncology , 7, 61-73.
- Rassouli1 N, Etesami1 M et al.( 2017). Detector-based spectral CTwith a novel dual-layer technology: principles and applications. Insights Imaging . 8:589–598.
- Gastón A. Rodriguez-Granillo et al (2015). Dual Energy CT Imaging for the Assessment of Coronary Artery Stenosis. Patricia M. Carrascosa. Dual-Energy CT in Cardiovascular Imaging, pp 173-194. Springer International Publishing Switzerland.
- Patricia M. Carrascosa and Ricardo C. Cury (2015). Myocardial Perfusion by Dual Energy CT. Patricia M. Carrascosa. Dual-Energy CT in Cardiovascular Imaging, pp 195-230. Springer International Publishing Switzerland.
- Knuuti J , Wijns W et al( 2019). ESC Guidelines for the diagnosis and management of chronic coronary syndromes. The Task Force for the diagnosis and management of chronic coronary syndromes of the European Society of Cardiology (ESC). European Heart Journal. 00, 1-71.
- Bouleti C, Baudry G et al (2017). Usefulness of Late Iodine Enhancement on Spectral CT in Acute Myocarditis. JACC: Cardiovascular Imaging. Vol 10, Issue 7,823 – 9.
- Bratke G et al (2020). Spectral Photon-Counting Computed Tomography for Coronary Stent Imaging: Evaluation of the Potential Clinical Impact for the Delineation of In-Stent Restenosis. Investigative Radiology 55(2): 61–67.
- Wieland H. Sommer (2011). Aorta. Thorsten R.C. Johnson. Dual Energy CT in Clinical Practice, pp 61-66. Springer-Verlag Berlin Heidelberg.
- Krissak R, Fink C (2011). Lung Perfusion. Thorsten R.C. Johnson. Dual Energy CT in Clinical Practice, pp 83-90. Springer-Verlag Berlin Heidelberg.
- Hong Y J et al (2018). Quantitative Analysis of a Whole Cardiac Mass Using DualEnergy Computed Tomography: Comparison with Conventional Computed Tomography and Magnetic Resonance Imaging. scientific reports | 8:15334.
- Hur J, Kim Y J et al (2012). cardioembolic stroke: Dual Energy Cardiac CT for Differentiation of Left Atrial Appendage Thrombus and Circulatory Stasis. Radiology: Vol 263 (3): 688–695.
- Patel A R, Carrascosa P, Chen M , Ricardo C. Cury et al (2020). Society of cardiovascular computed tomography expert consensus document on myocardial computed tomography perfusion imaging. Journal of Cardiovascular Computed Tomography. Vol 14 (1): 87–100.
- Bryan C. Ramsey, Fentanes E, Andrew D et al (2018). Myocardial Assessment with Cardiac CT: Ischemic Heart Disease and Beyond. Current Cardiovascular Imaging Reports.11: 16 iudbacbsdc
Từ khóa » Nguyên Lý Ct
-
Tổng Quan Về Nguyên Lý Và Cấu Tạo Máy Chụp Cắt Lớp CT Scanner
-
Máy Chụp Cắt Lớp: Cấu Tạo, Nguyên Lý Hoạt động Và Phân Loại | Vinmec
-
Nguyên Lý Của Chụp Cắt Lớp Vi Tính (CTscanner) - PGS Hà Hoàng Kiệm
-
Cùng Bác Sĩ Giải đáp Nguyên Lý Chụp Cắt Lớp Vi Tính | Medlatec
-
Chụp CT Hai Mức Năng Lượng: Nguyên Lý Và ứng Dụng Lâm Sàng
-
Nguyên Lý Ct - SlideShare
-
Máy Chụp Cắt Lớp: Cấu Tạo, Nguyên Lý Hoạt động Và Phân Loại
-
Chụp Cắt Lớp Vi Tính - Đối Tượng Đặc Biệt - MSD Manuals
-
Chụp CT Hai Mức Năng Lượng: Nguyên Lý Và ứng Dụng Lâm Sàng
-
Chụp Cắt Lớp Vi Tính (chụp CT): Quy Trình, ưu Và Nhược điểm
-
Chụp Cắt Lớp Vi Tính (CT), Nguyên Lý Nội Khoa
-
Nguyên Lý Tái Tạo ảnh Trong Máy CT - Tài Liệu Text - 123doc
-
Chụp Cắt Lớp Vi Tính – Wikipedia Tiếng Việt
-
Bài Giảng Nguyên Lý Của Chụp Cắt Lớp điện Toán - TaiLieu.VN