Công Thức Pha Loãng Dung Dịch - Pha Chế Dung Dịch Theo Nồng độ ...
Có thể bạn quan tâm
Chúng ta đã biết đến khái niệm nồng độ dung dịch. Vậy làm thế nào để pha chế được dung dịch hay pha loãng chúng theo nồng độ cho trước. Công thức pha loãng dung dịch như thế nào? Chúng ta cùng tìm hiểu trong bài viết hôm nay các bạn nhé!
Tóm tắt nội dung
- Công thức pha loãng dung dịch
- 1. Cách pha chế một dung dịch theo nồng độ cho trước
- 2. Cách pha loãng một dung dịch theo nồng độ cho trước
- Bài tập về pha chế dung dịch theo nồng độ cho trước
Công thức pha loãng dung dịch
1. Cách pha chế một dung dịch theo nồng độ cho trước
Bài tập
Từ muối CuSO4, nước cất và các dụng cụ cần thiết, hãy tính toán và nêu cách pha chế:
a) 50 g dung dịch CuSO4 10%.
b) 50 ml dung dịch CuSO4
Bài giải
a)
Tính toán:
– Khối lượng chất tan CuSO4 là:
mCuSO4 = (10 x 50) / 100 = 5 (g)
– Khối lượng của dung môi (nước) là:
mdm = mdd – mct = 50 -5 = 45 (g)
Cách pha chế dung dịch:
– Cân 5 g CuSO4 khan cho vào một cốc thủy tinh loại 100 ml.
– Cân 45 g nước cất (hoặc 45 ml) cho vào cốc.
– Khuấy nhẹ cho CuSO4 tan hoàn toàn, ta được dung dịch CuSO4 10%.
b)
Tính toán:
– Số mol chất tan CuSO4 là:
nCuSO4 = 1 x 0,05 = 0,05 (mol)
– Khối lượng của CuSO4 là:
mCuSO4 = nCuSO4 x MCuSO4 = 0,05 x 160 = 8 (g)
Cách pha chế dung dịch:
– Cân 8 g CuSO4 khan cho vào một cốc thủy tinh loại 100 ml.
– Cho từ từ nước cất vào cốc và khuấy nhẹ cho đủ 50 ml dung dịch.
– Ta được dung dịch CuSO4 1M.
Cách pha loãng dung dịch theo nồng độ cho trước

cong-thuc-pha-loang-dung-dich-theo-nong-do-cho-truoc
2. Cách pha loãng một dung dịch theo nồng độ cho trước
Bài tập
Từ nước cất và các dụng cụ cần thiết, hãy tính toán và nêu cách pha chế:
a) 100 ml dung dịch MgSO4 0,4M từ dung dịch MgSO4
b) 150 g dung dịch NaCl 2,5% từ dung dịch NaCl 10%.
Bài giải
a)
Tính toán:
– Số mol chất tan MgSO4 trong 100 ml dd MgSO4 0,4M là:
nMgSO4 = 0,4 x 0,1 = 0,04 (mol)
– Thể tích của dung dịch MgSO4 2M (trong đó có chứa 0,04 mol chất tan MgSO4) là:
VMgSO4 = 0,04 / 2 = 0,02 lít = 20 ml
Cách pha chế dung dịch:
– Đong lấy 20 ml dung dịch MgSO4 2M cho vào cốc chia độ 200 ml.
– Thêm từ từ nước cất đến vạch 100 ml, khuấy đều ta được 100 ml dd MgSO4 0,4M.
b)
Tính toán:
– Khối lượng của NaCl có trong 150 ml dd NaCl 2,5% là:
nNaCl = (2,5 x 150) /100 = 3,75 (g)
– Khối lượng dd NaCl ban đầu (có chứa 3,75 g NaCl) là:
nNaCl = (3,75 x 100) / 10 = 37, 5 (g)
– Khối lượng nước cất cần dùng là: mH2O = 150 – 37,5 = 112,5 (g)
Cách pha chế dung dịch:
– Cân 37,5 g dd NaCl 10% cho vào cốc thủy tinh (hoặc bình tam giác).
– Cân 112,5 g nước cất (hoặc 112,5 ml) rồi từ từ cho vào cốc thủy tinh (hoặc bình tam giác) trên.
– Khuấy đều ta được 150 ml dd Nal 2,5%.
Bài tập về pha chế dung dịch theo nồng độ cho trước
Câu 1. Làm bay hơi 60 g nước từ dd có nồng độ 15% được dd mới có nồng độ 18%. Xác định khối lượng của dd ban đầu.
Giải:
– Gọi m (g) khối lượng của dung dịch ban đầu cần tìm.
⇒ Khối lượng của dung dịch sau khi bay hơi là: m-60 (g)
– Vì khối lượng của chất tan là không đổi, nên ta có:
mct = (m x 15) / 100 = [(m – 60) x 18)] / 100
⇔ m x 15 = (m – 60) x 18
⇔ 15m = 18m – 1080
⇔ 3m = 1080
⇔ m = 360 g
Vậy khối lượng dung dịch ban đầu là 360 gam.
Câu 2. Đun nhẹ 20 g dd CuSO4 cho đến khi nước bay hơi hết thu được chất rắn màu trắng là CuSO4 khan. Chất rắn này có khối lượng 3,6 g. Tính nồng độ phần trăm của dd CuSO4.
Giải:
Ta có:
C% CuSO4 = mct/mdd x 100% = 3,6/20 x 100% = 18%
Câu 3. Cân 10,6 g Na2CO3 cho vào cốc chia độ có dung tích 500 ml. Rót từ từ nước cất vào cốc đến vạch 200 ml. Khuấy nhẹ cho đến khi Na2CO3 tan hết, ta được dd Na2CO3. Biết 1 ml dung dịch này có khối lượng 1,05 g.
Tính nồng độ phần trăm (C%) và nồng độ mol (CM) của dd vừa pha chế được.
Giải:
Ta có:
– Số mol của 10,6 g Na2CO3 là:
nNa2CO3 = 10,6/106 = 0,1 (mol)
– Khối lượng của 200 ml dd Na2CO3 là:
mddNa2CO3 = 200 x 1,05 = 210 (g)
- Nồng độ phần trăm của dd Na2CO3 là:
C% = mct/mdd x 100% = 10,6/210 x 100% = 5,05%
- Nồng độ mol của dd Na2CO3 là:
CM = n/V = 0,1/0,2 = 0,5 (mol/l)
Câu 4. Điền các giá trị thích hợp vào chỗ trống trong bảng sau:
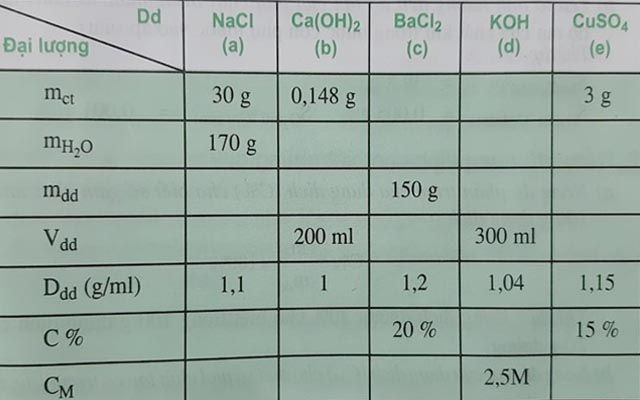
cong-thuc-pha-loang-dung-dich
Đáp án:
a) Dung dịch NaCl
- mdd =mct + mH2O = 200 g
- Vdd = mdd/Ddd = 200/1,1 = 182 ml
- C% = mct/mdd x 100% = 30/200 x 100% = 15%
- CM = n/V =(30/58,5)/0,182 = 2,82 M
b) Dung dịch Ca(OH)2
- mdd = Ddd x Vdd = 1 x 200 = 200 g
- mH2O = mdd – mct = 200 – 0,148 = 199,852 g
- C%= mct/mdd x 100% = 0,148/200 x 100% = 0,074%
- CM = n/V = (0,148/74)/0,2 = 0,01 M
c) Dung dịch BaCl2
- mct = (C% x mdd)/100 = (20 x 150)/100 = 30 g
- mH2O = mdd – mct = 150 – 30 = 120 g
- Vdd = mdd/Ddd = 150/1,2 = 125 ml
- CM = n/V = (30/208)/0,125 = 1,15 M
d) Dung dịch KOH
- mdd = Ddd x Vdd = 1,04 x 300 = 312 ml
- nKOH = CM x V = 2,5 x 0,3 = 0,75 mol
- mct = 0,75 x 56 = 42 g
- mH2O =mdd – mct = 312 – 42 = 270 g
- C%= mct/mdd x 100% = 42/312 x 100% = 13,46%
e) Dung dịch CuSO4
- mdd = (mct x 100)/C% = (3 x 100)/15= 20 g
- mH2O = mdd – mct = 20 – 3 = 17 g
- Vdd = mdd/Ddd = 20/1,15 = 17,39 ml
- CM = n/V = (3/160)/0,01739 = 1,078 M
Câu 5. Tìm độ tan của một số muối trong H2O, người ta có những kết quả như sau:
- Nhiệt độ của dd muối bão hòa là ở 20 °C
- Chén sứ nung có khối lượng 60,26 g
- Chén sự đụng dd muối có khối lượng 86,26 g
- Khối lượng chén nung và muối kết tinh sau khi làm bay hơi hết nước là 66,26 g.
Hãy xác định độ tan của muối ở nhiệt độ 20 °C.
Giải:
Ta có:
mdd = 86,26 – 60,26 = 26 (g)
mct = 66,26 – 60,26 = 6 (g)
mH2O = 26 – 6 = 20 (g)
Độ tan của muối là:
S = (6 x 100) / 20 = 30 (g)
2 / 5 ( 1 bình chọn )Từ khóa » Pha Loãng 4 Lần
-
Công Thức Tính Số Lần Pha Loãng | Dương Lê
-
Pha Loãng Dung Dịch Bao Nhiêu Lần để độ điện Ly Tăng 4 Lần
-
Cách Pha Hóa Chất Trong Phòng Thí Nghiệm | Pha Loãng HCl, NaOH
-
Yếu Tố Pha Loãng Trong Những Gì Nó Bao Gồm, Làm Thế Nào Nó được ...
-
Cách Pha Loãng Dung Dịch 100 Lần - 123doc
-
Cách Pha Loãng 10 Lần
-
Pha Loãng Máu Trước Phẫu Thuật | Vinmec
-
Dạng Toán Pha Loãng Hay Cô đặc Dung Dịch
-
Pha Dung Dịch | Diễn đàn Sinh Học Việt Nam
-
Cách Pha Loãng 10 Lần
-
I. Cách Pha Chế Dung Dịch Theo Nồng độ Cho Trước - HayHocHoi
-
Pha Loãng Dung Dịch HCl Có PH = 2 Bao Nhiêu Lần để ...
-
Nước Rửa Chén Trung Tính đậm đặc Neutral Detergent N-4, 5kg ( Có ...
-
Dung Dịch HCl Có PH = 3. Cần Pha Loãng Dung Dịch Axit Này (bằng N