Công Thức Tính Nồng độ Phần Trăm (C%): Bài Tập + Lời Giải
Có thể bạn quan tâm
Trong lĩnh vực hóa học, sự thành thạo về cách tính toán nồng độ phần trăm và nồng độ mol không chỉ là chìa khóa giúp các học sinh vượt qua mọi thách thức từ bài tập dễ đến bài tập khó, mà còn là nền tảng củng cố kiến thức quan trọng không thể thiếu. Vì vậy, việc hiểu biết sâu rộng về những kiến thức này là vô cùng quan trọng.
Trong bài viết này, chúng ta hãy cùng LabVIETCHEM khám phá về các phương pháp tính nồng độ mol, nồng độ phần trăm cùng việc giải quyết một số bài tập minh họa cụ thể để củng cố kiến thức, sẵn sàng cho những thử thách mới trong năm học tiếp theo.

Công thức tính C% và công thức tính nồng độ mol
Mục lục- Nồng độ là gì?
- Nồng độ phần trăm là gì?
- 1. Công thức tính nồng độ phần trăm
- 2. Các bước giải bài tập tính nồng độ phần trăm
- Bài tập tính nồng độ phần trăm của dung dịch
- Một số lưu ý khi tính nồng độ phần trăm của dung dịch
- Nồng độ mol khác nồng độ phần trăm như thế nào?
- Nồng độ Mol là gì?
- Công thức tính nồng độ mol
- Mối quan hệ giữa nồng độ phần trăm và các nồng độ dung dịch khác
- Giữa nồng độ phần trăm và nồng độ mol
- Tính toán tỷ lệ phần trăm tập trung
Nồng độ là gì?
Nồng độ là khái niệm để biểu thị lượng hóa chất có trong một hỗn hợp, đa phần là dung dịch. Một số khái niệm nồng độ hay gặp là:
- Nồng độ phần trăm
- Nồng độ mol
- Nồng độ molan: Biểu thị số mol của 1 chất cho trước trong 1kg dung môi
- Nồng độ chuẩn: Thường dùng cho những phản ứng và dung dịch axit – bazo
- Nồng độ chính tắc: Là cách đo nồng độ tương tự như nồng độ mol và rất hiếm khi dùng
Nồng độ phần trăm là gì?
Nồng độ phần trăm biểu thị số gam chất tan có trong 100g dung dịch và được ký hiệu là C%.
1. Công thức tính nồng độ phần trăm
Qua nghiên cứu và thử nghiệm các chuyên gia đã đưa ra công thức tính nồng độ phần trăm chính xác nhất.
Công thức tính C% trong hóa học:

Trong đó:
- C%: Ký hiệu của nồng độ phần trăm
- mct: Ký hiệu của khối lượng chất tan
- mdd: Ký hiệu của khối lượng dung dịch
Công thức tính mdd:
mdd = mct + mdm (trong đó mdm là khối lượng của dung môi)
2. Các bước giải bài tập tính nồng độ phần trăm
Các dạng bài tập tính nồng độ phần trăm trong hóa học rất đa dạng, nhưng chúng đều phải thực hiện giải theo các bước sau đây:
- Bước 1: Khi đọc đề bài chúng ta cần phải xác định được số chất có trong dung dịch, nhất là các số dư của chất tham gia phản ứng.
- Bước 2: Tính khối lượng dung dịch sau khi tham gia phảm ứng theo phương pháp bảo toàn khối lượng (tổng khối lượng chất tham gia phản ứng = tổng khối lượng sản phẩm).
- Bước 3: Tính mct
- Bước 4: Áp dụng công thức tính nồng độ phần trăm để giải quyết bài toán.
Áp dụng đúng 4 bước trên đây là bạn hoàn toàn có thể tính nồng độ phần trăm rồi. Tuy nhiên, có nhiều bài tập nó không cho sẵn khối lượng của các chất nên ta cần phải áp dụng các kiến thức hóa học đã được học kết hợp với công thức tính nồng độ phần trăm để giải bài toán nhé.
Bài tập tính nồng độ phần trăm của dung dịch
Bài 1: Bạn hãy tính khối lượng của NaOH có trong 200g dung dịch NaOH 15%
Lời giải:
Áp dụng công thức C% = (mct/mdd).100% ta có:
C% = (mNaOH/200).100 = 15 (%)
=> mNaOH = (15.200)/100 = 30 (g)
Trong đó:
- (.) ký hiệu dấu nhân
- (/) ký hiệu dấu chia
Kết luận: Vậy trong 200g dung dịch NaOH 15% có 30 gam NaOH
Bài 2: Tiến hành hòa tan 20 gam muối vào nước thu được dung dịch A có C% = 10%
a, Hãy tính khối lượng của dung dịch A thu được
b, Hãy ính khối lượng nước cần thiết cho sự pha chế
Lời giải:
a, Áp dụng công thức C% = (mct/mdd).100% ta có:
mdd=(mmuối.100)/ C% = (20.100)/10 = 200 gam
Kết luận: Vậy khối lượng dung dịch A là 200 gam
b, Áp dụng phương pháp bảo toàn khối lượng ta có mnước=mdd - mmuối = 200 - 20 = 180 gam
Kết luận: Vậy để có thể hoàn tan 20 gam muối thì chúng ta phải cần 180 gam nước để tạo ra 200 gam dung dịch
Bài 3: Tiến hành hòa tan 3,9 gam Kali vào 36,2 gam nước chúng ta thu được dung dịch B có nồng độ bao nhiêu?
Lời giải:
Ta có phương trình phản ứng hóa học sau
2K + 2H2O -----> 2KOH + H2
Số mol của K = 3,9/ 39 = 0,1 => mol KOH = 0,1 => mol H2O = 0,05
Theo cân bằng phương trình ta tính được:
mdd = mk + mH2O - mH2 = 3,9 + 36,2 - (0,05.2) = 40 gam
=> Áp dụng công thức C% = (mct/mdd).100% ta có C% = [(0,1.56)/40].100% = 14%
Kết luận: Khi tiến hành hòa tan 3,9 gam Kali vào 36,2 gam nước ra sẽ thu được dung dịch có nồng độ 14%.
Bài 4: Hòa tan 10 gam đường vào 40 gam nước. Hãy tính nồng độ phần trăm của dung dịch thu được theo đơn vị %?
Lời giải:
Khối lượng của dung dịch là:
mdd = mdm + mct = 10 +40 = 50 gam
Nồng độ phần trăm là:
C% = (mct/cdd) . 100% = (10/50). 100% = 20%
Vậy nồng độ phần trăm của dung dịch thu được sau phản ứng là 20%.
Bài 5: Dung dịch HCl có nồng độ là 36%. Tính khối lượng HCl có trong 200g dung dịch
Lời giải:
Nồng độ phần trăn dung dịch là:
C% = mct/mdd . 100%
=> mct = (C%.mdd)/100%
Vậy khối lượng chất tan HCL là: mHCl = (36%.200)/100% = 72 gam.
=> Các bài tập về => Phương trình nhiệt phân KClO3 (muối Kali Clorat)
Một số lưu ý khi tính nồng độ phần trăm của dung dịch
- Phải đọc đề kĩ để biết được chính xác các thành phần đã cho, xác định được cần tính toán những thành phần nào.
- Áp dụng đúng công thức tính để tránh những sai lầm không cần thiết.
- Tính các dữ liệu phải cẩn thận, tránh các sai sót không đáng có.
Nồng độ mol khác nồng độ phần trăm như thế nào?
Nồng độ Mol là gì?
Nồng độ mol của dung dịch cho chúng ta biết số mol chất tan có trong 1 lít dung dịch là bao nhiêu.
Công thức tính nồng độ mol
Ngoài công thức tính nồng độ phần trăm thì công thức tính nồng độ mol cũng rất quan trọng và xuất hiện nhiều trong các bài tập.
1. Công thức tính nồng độ mol theo khối lượng
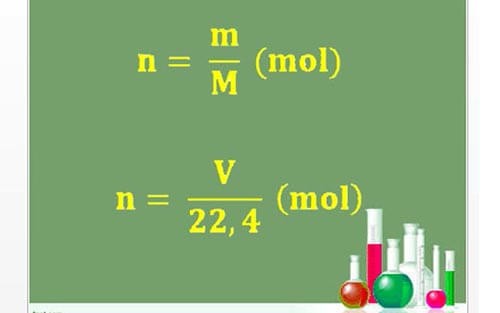
Trong đó:
- n: ký hiệu số mol
- m: khối lượng của chất đó
- M: Khối lượng mol của chất đó (có sẵn trong bảng tuần hoàn hóa học)
- V: Thể tích (đktc)
2. Cách tính nồng độ mol
Nồng độ mol có ký hiệu là CM và được tính theo công thức
CM=n/Vdd
- CM: ký hiệu của nồng độ mol
- n: Ký hiệu số mol chất tan
- V: Ký hiệu thể tích dung dịch
3. Bài tập tính nồng độ mol
Bài 1: 16 gam NaOH có trong 200 ml dung dịch, hãy tính nồng độ mol của dung dịch
Lời giải:
- Ta đổi 200 ml = 0,2 lít
- nNaOH = 16/ 40 = 0,4 mol
=> Áp dụng công thức tính nồng độ mol CM=n/Vdd ta có
CM = n/ V = 0,4/ 0,2 = 2M
Kết luận: Nồng độ mol của dung dịch là 2M
Bài 2: Hãy tính khối lượng H2SO4 có trong 50 ml dung dịch H2SO4 2M
Lời giải:
Áp dụng công thức tính nồng độ mol CM=n/Vdd ta có
nH2SO4 = CM.V = 0,1 mol
=> mH2SO4 = 0,1.98 = 98 gam
Kết luận: Trong 50 ml dung dịch H2SO4 có 98 gam H2SO4 .
Bài 3: Hãy tính khối lượng chất tan cần dùng để pha chế 2,5 lít dung dịch NaCl 0,9M
Lời giải:
Áp dụng công thức tính nồng độ mol CM=n/Vdd ta có
nNaCl = CM.V = 2,5 . 0,9 = 2,25 mol
=> mNaCl = 2,25 . (23 + 35,5)= 131,625 gam
Bài 4: Hãy tính số mol và số gam chất tan tỏng 1 lít dung dịch NaCl 0,5M
Lời giải:
Vdd = 1 lít, CM = 0,5M
=> nNaCl = CM.V = 1. 0,5 = 0,5 mol
=> mNaCl = m = n.MNaCl = 0,5 . (23 + 35,5)= 29,25 gam
Mối quan hệ giữa nồng độ phần trăm và các nồng độ dung dịch khác
Giữa nồng độ phần trăm và nồng độ mol
CM = (10 x d x C%) / M
Trong đó:
- M: khối lượng phân tử chất tan.
- CM: nồng độ mol của dung dịch.
- d: khối lượng riêng của dung dịch.
- C%: nồng độ phần trăm của dung dịch.
Giữa nồng độ phần trăm và nồng độ đương lượng
Đương lượng là đơn vị được sử dụng để đo lường khả năng 1 chất kết hợp với 1 chất khác. Nồng độ đương lượng biểu thị số đương lượng gam chất tan chứa trong 1l dung dịch. Công thức tương quan giữa nồng độ đương lượng và nồng độ phần trăm được biểu diễn như sau:
CN = (10 x d x C%) / D
Trong đó:
- D: đương lượng gam
- d : khối lượng riêng của dung dịch.
- CN: nồng độ tương đương của dung dịch
- C%: nồng độ phần trăm của dung dịch.
Tính toán tỷ lệ phần trăm tập trung
- Tỷ lệ phần trăm nồng độ cho ta biết có bao nhiêu thành phần hoạt chất cụ thể có trong hoặc cần phải có trong một giải pháp tổng thể nào đó.
- Bằng cách đặt số thứ nhất lên trên số thứ hai, nồng độ phần trăm được biểu thị là 1:100, 1:200,… có thể chuyển đổi thành một phần.
- Trong một phần Solute (thuốc) có 100 phần mẻ, 1/100 dung môi.
Hy vọng các bạn học sinh có thể ghi nhớ được công thức tính nồng độ phần trăm (C%) và công thức tính nồng độ mol (CM) và đạt kết quả tốt trong kỳ thi. Tham khảo thêm nhiều công thức hóa học khác tại website labvietchem.com.vn.
XEM THÊM:
>>> Cách tính đương lượng và định luật đương lượng trong hóa học
Tìm kiếm:
- công thức chuyển đổi nồng độ mol sang nồng độ phần trăm
- tính nồng độ phần trăm các chất trong dung dịch sau phản ứng
- bài tập tính nồng độ phần trăm lớp 9 có Lời giải
Từ khóa » Tính Số Mol Dựa Vào Nồng độ Phần Trăm
-
Công Thức Tính Nồng độ Phần Trăm, Ví Dụ Minh Họa - VietChem
-
Cách Tính Số Mol, Nồng độ Mol, Nồng độ Phần Trăm
-
Công Thức Tính Nồng độ Mol, Số Mol Và C Nồng độ Phần Trăm
-
Công Thức Tính Số Mol. Công Thức Liên Hệ Giữa Nồng độ Mol Và Nồng ...
-
Công Thức Tính Nồng độ Mol, Số Mol, Nồng độ Phần Trăm Chuẩn 100%
-
Công Thức Liên Hệ Giữa Nồng độ Mol Và Nồng độ Phần - Mobitool
-
Nồng độ Phần Trăm Là Gì? Công Thức, Hướng Dẫn Tính & Lưu ý Khi Tính
-
Công Thức Tính Nồng độ Phần Trăm Và Bài Tập Vận Dụng
-
Nồng độ Mol Là Gì? Công Thức Tính Số Mol, Nồng độ Mol?
-
[2021]Công Thức Tính C% (nồng độ Phần Trăm) Theo Khối Lượng Và ...
-
Công Thức Tính Nồng độ Mol, Số Mol Và Tính C Nồng độ Phần Trăm
-
Công Thức Tính Nồng độ Phần Trăm – Thuật Toán đơn Giản, Dễ áp Dụng
-
Cách Tính Nồng độ Phần Trăm, Nồng độ Mol Của Dung Dịch - Hóa 8 ...