Crom
Có thể bạn quan tâm
 Những kim loại nhóm A, như kim loại kiềm (nhóm IA), kim loại kiềm thổ (nhóm IIA) và nhôm (nhóm IIIA) chỉ có electron lớp ngoài cùng tham gia phản ứng hóa học và trong hợp chất, chúng có số oxi hóa không đổi. Khác với chúng, nguyên tử crom khi tham gia phản ứng hóa học không chỉ có electron ở phân lớp 4s, mà có cả electron ở phân lớp 3d. Do đó, trong các hợp chất, crom có số oxi hóa biến đổi từ +1 đến +6. Phổ biến hơn cả là các số oxi hóa +2,+3,+6. Bảng dưới đây cho biết một số đại lượng đặc trưng của crom:
Những kim loại nhóm A, như kim loại kiềm (nhóm IA), kim loại kiềm thổ (nhóm IIA) và nhôm (nhóm IIIA) chỉ có electron lớp ngoài cùng tham gia phản ứng hóa học và trong hợp chất, chúng có số oxi hóa không đổi. Khác với chúng, nguyên tử crom khi tham gia phản ứng hóa học không chỉ có electron ở phân lớp 4s, mà có cả electron ở phân lớp 3d. Do đó, trong các hợp chất, crom có số oxi hóa biến đổi từ +1 đến +6. Phổ biến hơn cả là các số oxi hóa +2,+3,+6. Bảng dưới đây cho biết một số đại lượng đặc trưng của crom: 
Crom có cấu tạo mạng tinh thể lập phương tâm khối.
Tính chất vật lí :
Crom có màu trắng ánh bạc, rất cứng (rạch được thủy tinh, cứng nhất trong số các kim loại, độ cứng chỉ kém kim cương), khó nóng chảy (tnc1890). Crom là kim loại nặng, có khối lượng riêng là 7,2g/cm3.
Tính chất hóa học :
+) Tác dụng với phi kim Giống như kim loại nhôm, ở nhiệt độ thường trong không khí, kim loại crom tạo ra màng mỏng crom (III) oxit có cấu tạo mịn, đặc chắc và bền vững bảo vệ. Ở nhiệt độ cao, crom khử được nhiều phi kim. Ví dụ :

+) Tác dụng với nước Crom có thế điện cực chuẩn nhỏ ( \(E^0_{Cr^{3+} /Cr}\) = −0,74V ), âm hơn so với thế điện cực hiđro ở pH = 7( \(E^0_{H_2O/H_2}\) = −0,41V). Tuy nhiên trong thực tế crom không tác dụng được với nước do có màng oxit bảo vệ.
+) Tác dụng với axit Trong dung dịch HCl ,H2SO4 loãng nóng, màng oxit bị phá hủy, crom khử ion H+ tạo ra muối Cr(II) và khí hiđro.

Tương tự nhôm, crom không tác dụng với axit HNO3 và H2SO4 đặc, nguội mà bị thụ động bởi các axit.
Ứng dụng : Crom có nhiều ứng dụng thiết thực trong công nghiệp và trong đời sống. Trong công nghiệp, crom được dùng để sản xuất thép: - Thép chứa từ 2,8 − 3,8% crom có độ cứng cao, bền, có khả năng chống gỉ. - Thép có chứa 18% crom là thép không gỉ (thép inoc). - Thép chứa từ 25 − 30% crom có tính siêu cứng, dù ở nhiệt độ cao.
Trong đời sống, nhiều đồ vật bằng thép được mạ crom. Lớp mạ crom vừa có tác dụng bảo vệ kim loại khỏi bị ăn mòn, vừa tạo vẻ đẹp cho đồ vật. Ví dụ: bộ đồ ăn, dụng cụ nhà bếp và những đồ vật khác được mạ crom. Sản xuất : Trong tự nhiên không có crom ở dạng đơn chất mà chỉ có ở dạng hợp chất (chiếm 0,03% khối lượng vỏ Trái Đất). Hợp chất phổ biến nhất của crom là quặng cromit FeO.Cr2O3. Quặng này thường có lẫn Al2O3 và SiO2. Oxit crom (Cr2O3) được tách từ quặng. Sau đó điều chế crom bằng phương pháp nhiệt nhôm: Cr2O3 + 2Al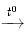 2Cr + Al2O3 Bằng phương pháp này, crom được điều chế được có độ tinh khiết từ 97−99%, tạp chất chủ yếu là nhôm, sắt, silic.
2Cr + Al2O3 Bằng phương pháp này, crom được điều chế được có độ tinh khiết từ 97−99%, tạp chất chủ yếu là nhôm, sắt, silic. Từ khóa » Các Nguyên Tử Crom
-
Tính Chất Hóa Học Của Crom Và Bài Tập Vận Dụng - Kiến Guru
-
Nguyên Tử Khối Của Crom (Cr), M Của Cr. - Bierelarue
-
Chromi – Wikipedia Tiếng Việt
-
Bảng Nguyên Tử Khối Của Crom, Tính Chất Hóa ... - Thánh Chiến 3D
-
Nguyên Tử Khối Của Crom? 3 Ứng Dụng Tuyệt Vời Của ... - THE COTH
-
Crom ( Cr ) Hóa Trị Mấy? Nguyên Tử Khối Của Cr? M Của Cr Là Bao ...
-
Số Nguyên Tử ☢️ (Crom, Cr) 2022 + Nguồn, Sử Dụng - Vật Chất (VN)
-
Nguyên Tử Cr (crom) Có 24e, Nguyên Tử Cu Có 29e. Hãy Viết Cấu Hình ...
-
Nguyên Tử Crom (Z = 24), Cấu Hình Electron Của Nguyên Tử Crom
-
Nguyên Tử Crom (Z = 24), Cấu Hình Electron Của Nguyên Tử Crom Là
-
Trong Tinh Thể, Nguyên Tử Crom Chiếm 68% Về Thể Tích. Khối Lượng ...
-
Có Các Nguyên Tố Hóa Học: Cr (Z = 24), Fe (Z = 26), P (Z = 15)
-
Bảng Nguyên Tử Khối Của Crom Và Bài Tập Vận ...
-
Bảng Nguyên Tử Khối Của Crom, Tính Chất Hóa ... - ThiênBảo Edu