Crôm Và Hợp Chất Của Crôm
Có thể bạn quan tâm
Nâng cấp gói Pro để trải nghiệm website VnDoc.com KHÔNG quảng cáo, và tải file cực nhanh không chờ đợi.
Tìm hiểu thêm » Mua ngay Từ 79.000đ Hỗ trợ ZaloLý thuyết và bài tập crôm và hợp chất của crôm
- CROM
- Một số hợp chất của CROM
Crôm và hợp chất của crôm là tài liệu tham khảo môn hóa THPT, tổng hợp lại lý thuyết và bài tập về crôm và hợp chất của crôm. Hi vọng tài liệu này giúp các bạn học tốt môn hóa, ôn thi THPT Quốc gia cũng như luyện thi đại học khối A, B. Mời các bạn tham khảo chi tiết tại đây nhé.
- Ôn tập Hóa học lớp 12 chương 5: ĐẠI CƯƠNG VỀ KIM LOẠI
- Tổng hợp đề ôn thi học kì 2 môn Hóa học lớp 12
VnDoc.com xin gửi tới bạn đọc bài viết Crôm và hợp chất của crôm để bạn đọc cùng tham khảo. Bài viết được tổng hợp gồm có lý thuyết và bài tập về crom, hợp chất của crom. Mời các bạn cùng tham khảo chi tiết và tải về tại đây nhé.
CROM
I. Vị trí và cấu tạo
Crom là kim loại chuyển tiếp, thuộc nhóm VIB, chu kì 4, số hiệu nguyên tử là 24.
Sự phân bố electron vào các mức năng lượng: 1s22s22p63s23p64s13d5
Cấu hình electron nguyên tử: 1s22s22p63s23p63d54s1 hay [Ar] 3d54s1
Biểu diễn cấu hình electron qua ô lượng tử:
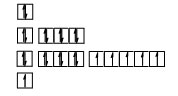
Crom có số oxi hóa +1 đến +6. Phổ biến hơn cả là các số oxi hóa +2, +3 và +6.
Độ âm điện: 1,61
Bán kính nguyên tử Cr 0,13 nm (1 nm = 1×10−9 m = 1×10−3 μm)
Bán kính ion Cr2+ là 0,084 nm và Cr3+ là 0,069 nm.
II. Tính chất vật lý
Crom có màu trắng ánh bạc, rất cứng (cứng nhất trong số các kim loại), khó nóng chảy (18900C).
Crom là kim loại nặng, có khối lượng riêng 7,2 g/cm3.
III. Tính chất hóa học
1. Tác dụng với phi kim
Ở nhiệt độ cao, crom tác dụng được với nhiều phi kim
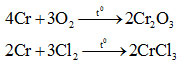
2. Tác dụng với nước.
Crom có thế điện cực chuẩn nhỏ (E0Cr3+/Cr = -0,74V) âm hơn so với thế điện cực hidro ở pH = 7 (E0H2O/H2 = -0,74V ). Tuy nhiên, trong thực tế crom không phản ứng với nước.
3. Tác dụng với axit
Khi tác dụng với dung dịch HCl, H2SO4 loãng tạo ra muối Cr(II).
Cr + 2 HCl → CrCl2 + H2
Cr + H2SO4 → CrSO4 + H2
Cr không phản ứng với HNO3 và H2SO4 đặc nguội.
IV. Ứng dụng
Thép chứa 2,8-3,8% crom có độ cứng cao, bền, có khả năng chống gỉ.
Thép chứa 18% crom là thép không gỉ (thép inox).
Thép chứa 25-30% crom siêu cứng dù ở nhiệt độ cao.
Crom dùng để mạ thép. Thép mạ crom bảo vệ kim loại khỏi bị ăn mòn và tạo vẻ đẹp cho đồ vật.
V. Sản xuất
Phương pháp nhiệt nhôm: Cr2O3 được tách ra từ quặng cromit FeO.Cr2O3.
4 FeCr2O4 + 8 Na2CO3 + 7 O2 → 8 Na2CrO4 + 2 Fe2O3 + 8 CO2
2 Na2CrO4 + H2SO4 → Na2Cr2O7 + Na2SO4 + H2O
Na2Cr2O7 + 2 C → Cr2O3 + Na2CO3 + CO
![]()
Một số hợp chất của CROM
I. HỢP CHẤT CROM (II)
1. CrO
CrO là một oxit bazơ.
CrO có tính khử, trong không khí CrO dễ bị oxi hóa thành Cr2O3.
2. Cr(OH)2
Cr(OH)2 là chất rắn, màu vàng.
Cr(OH)2 có tính khử, trong không khí oxi hóa thành Cr(OH)3
Cr(OH)2 là một bazơ.
3. Muối crom (II)
Muối crom (II) có tính khử mạnh.
Trên đây VnDoc.com vừa giới thiệu tới các bạn bài viết Crôm và hợp chất của crôm, mong rằng qua bài viết này các bạn có thể học tập tốt hơn môn Hóa học lớp 12. Mời các bạn cùng tham khảo thêm các môn Toán 12, Ngữ văn 12, tiếng Anh 12, đề thi học kì 1 lớp 12, đề thi học kì 2 lớp 12...
Mời bạn đọc cùng tham gia nhóm Tài liệu học tập lớp 12 của VnDoc.com để có thêm tài liệu học tập nhé.
Từ khóa » Bài Tập Về Crom Và Hợp Chất Của Crom
-
30 Bài Tập Về Crom (Cr) Cực Hay, Có Lời Giải Chi Tiết
-
Bài Tập Về Hợp Chất Của Crom Cực Hay, Có Lời Giải Chi Tiết - Haylamdo
-
Phương Pháp Giải Một Số Dạng Bài Tập Về Crom Và Hợp Chất Của Crom
-
Bài Tập Về Crom Và Hợp Chất Của Crom Quiz - Quizizz
-
Bài Tập Crom Và Hợp Chất Của Crom
-
Bài Tập Bài Tập Lí Thuyết Về Crom Và Hợp Chất Của Crom Hóa 12 Có Lời ...
-
Bài 34: Lí Thuyết Và Giải Bài Tập Về Crom Và Hợp Kim Của Crom
-
Lý Thuyết Và Bài Tập Crôm Và Hợp Chất Của Crôm - 123doc
-
Lý Thuyết Bài Dạng 1 : Bài Tập Về Crom Và Hợp Chất Của Crom - Lib24 ...
-
Lý Thuyết Và Bài Tập ôn Thi Chuyên đề Crom Và Hợp Chất Của Crom
-
TOP 40 Câu Trắc Nghiệm Crom Và Hợp Chất Của Crom (có đáp án ...
-
Bài Tập Crom Có đáp án Chi Tiết (cách Giải)
-
Giải Bài Tập Hóa 12 Bài 34: Crom Và Hợp Chất Của Crom
-
Bài Tập Luyện Tập Về Đồng, Crom, Hợp Chất Của Đồng Và Crom