Điều Chế Khí Oxi Trong PTN Và Trong Công Nghiệp - Phản ứng Phân Hủy
Có thể bạn quan tâm
Khí oxi là một chất khí quan trong trong đời sống và công nghiệp. Chúng ta cũng đã tìm hiểu về những tính chất vật lý và tính chất hóa học của oxi .Oxi có rất nhiều trong không khí. Vậy có thể tách oxi từ không khí hay không. Trong công nghiệp và trong phòng thí nghiệm, người ta điều chế khí oxi như thế nào? Chúng ta cùng tìm hiểu trong bài viết hôm nay các bạn nhé!
Tóm tắt nội dung
- Điều chế khí Oxi trong PTN và trong công nghiệp
- 1. Điều chế khí oxi trong phòng thí nghiệm
- 2. Sản xuất khí oxi trong công nghiệp
- 3. Phản ứng phân hủy là gì?
- Bài tập điều chế Oxi trong PTN và công nghiệp
Điều chế khí Oxi trong PTN và trong công nghiệp
1. Điều chế khí oxi trong phòng thí nghiệm
– Trong phòng thí nghiệm, người ta điều chế khí oxi bằng cách đun nóng những hợp chất giàu oxi và dễ phân hủy ở nhiệt độ cao.
Chẳng hạn như:
2KMnO4 (t°) → K2MnO4 + MnO2 + O2
2KClO3 (t°) → 2KCl + 3O2
Phương pháp điều chế khí oxi trong phòng thí nghiệm
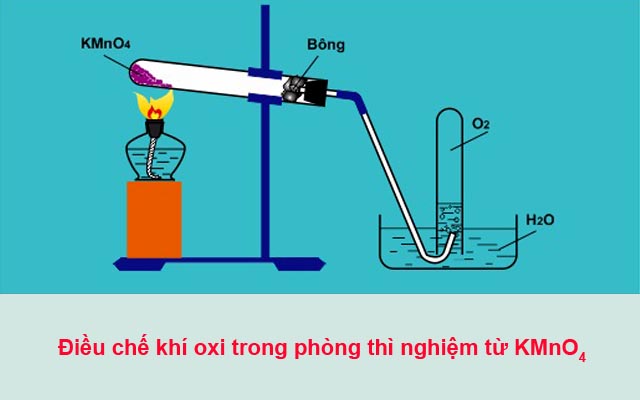
phuong-phap-dieu-che-khi-oxi-trong-phong-thi-nghiem
2. Sản xuất khí oxi trong công nghiệp
Trong công nghiệp, nguyên liệu để sản xuất oxi chủ yếu là không khí và nước. Khí oxi dùng trong công nghiệp thường được hóa lỏng, nén dưới áp suất cao và được đựng trong các bình bằng thép.
Sản xuất khí oxi trong công nghiệp
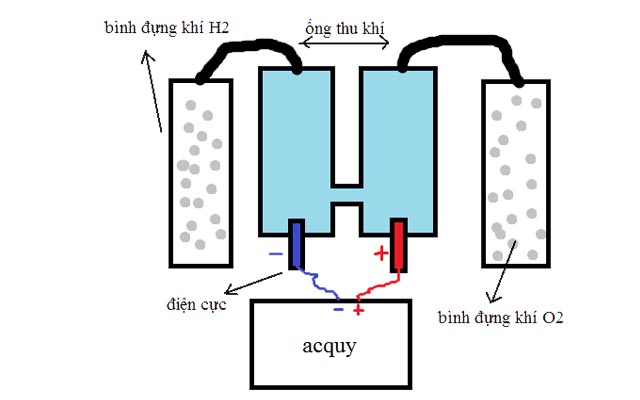
san-xuat-khi-oxi-trong-cong-nghiep
Sản xuất oxi từ không khí: đầu tiên, hóa lỏng không khí ở nhiệt độ thấp và áp xuất cao. Sau đó, cho không khí lỏng bay hơi. Trước hết, thu được khí N2 ở -196 °C, sau đó là O2 ở -183 °C.
Sản xuất oxi từ nước: điện phân nước trong các bình điện phân, sẽ thu được 2 chất khí riêng biệt là O2 và H2.
3. Phản ứng phân hủy là gì?
Định nghĩa: Phản ứng phân hủy là phản ứng hóa học trong đó từ một chất ban đầu tạo ra hai hay nhiều chất mới.
Ví dụ:
CaCO3 → CaO + CO2
2KClO3 → 2KCl + 3O2
Cu(OH)2 → CuO + H2O
Bài tập điều chế Oxi trong PTN và công nghiệp
Câu 1. Những chất nào dùng để điều chế khí oxi trong phòng thí nghiệm:
Fe3O4, KClO3, KMnO4, CaCO3, không khí, H2O
Đáp án: KClO3 và KMnO4
Câu 2. Nêu sự khác biệt về điều chế khí oxi trong PTN và trong công nghiệp (về nguyên liệu, sản lượng và giá thành)?
Đáp án:
| Điều chế Oxi trong PTN | Điều chế Oxi trong công nghiệp | |
| Nguyên liệu | Các hợp chất giàu oxi như KMnO4, KClO3,… | Không khí và nước |
| Sản lượng | Nhỏ | Rất lớn |
| Giá thành | Đắt do các nguyên liệu phải mua | Rẻ hơn do nguyên liệu không khí và nước có sẵn trong tự nhiên |
Câu 3. Nêu sự khác nhau giữa phản ứng phân hủy và phản ứng hóa hợp. Lấy 2 ví dụ để minh họa.
Trả lời:
Sự khác nhau giữa phản ứng phân hủy và phản ứng hóa hợp là:
- Phản ứng phân hủy là phản ứng hóa học trong đó một chất ban đầu sinh ra hai hay nhiều chất mới.
- Phản ứng hóa hợp là phản ứng hóa học trong đó chỉ có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
Ví dụ:
- Phản ứng phân hủy: CaCO3 → CaO + CO2
- Phản ứng hóa hợp: S + O2 → SO2
Câu 4. Tính số mol và số gam kaliclorat (KClO3) cần thiết để điều chế:
a) 48 g khí oxi
b) 44,8 lít khí oxi (đktc)
Trả lời:
Ta có PTHH của phản ứng:
2KClO3 → 2KCl + 3O2
a) Ta có:
nO2 = mO2/MO2 = 48 / 32 = 1,5 mol
Theo phương trình hóa học:
- Muốn thu được 3 mol O2cần đun nóng hết 2 mol KClO3
- Vậy muốn thu được 1,5 mol O2cần đun nóng hết 1 mol KClO3
⇒ Khối lượng KClO3 cần dùng là:
mKClO3 = nKClO3 x MKClO3 = 1 x 122,5 = 122,5 (g)
b) Ta có:
nO2 = V/22,4 = 44,8 / 22,4 = 2 mol
Theo phương trình hóa học:
- Muốn thu được 3 mol O2cần đun nóng hết 2 mol KClO3
- Vậy muốn thu được 2 mol O2cần đun nóng hết 4/3 mol KClO3
⇒ Khối lượng KClO3 cần dùng là:
mKClO3 = nKClO3 x MKClO3 = (4/3) x 122,5 = 163,33 (g)
Câu 5. Nung đá vôi (có thành phần chính là CaCO3) thu được vôi sống CaO và khí cacbonic CO2.
a) Viết PTHH của phản ứng
b) Phản ứng nung đá vôi thuộc loại PUHH nào? Vì sao?
Trả lời:
a) PTHH của phản ứng nung đá vôi:
CaCO3 → CaO + CO2
b) Phản ứng nung đá vôi thuộc loại phản ứng phân hủy vì từ một chất ban đầu tạo ra hai hay nhiều chất.
Câu 6. Trong PTN, người ta điều chế khí oxi sắt từ (Fe3O4) bằng cách dùng oxi oxi hóa sắt ở nhiệt độ cao.
a) Tính số gam Fe và số gam khí O2 cần dùng để điều chế 2,32 gam oxit sắt từ.
b) Tính số gam KmnO4 cần dùng để có được lượng oxi đủ dùng cho phản ứng trên.
Trả lời:
a) Ta có PTHH của phản ứng điều chế Fe3O4:
3Fe + 2O2 → Fe3O4
– Số mol Fe3O4:
nO2 = mFe3O4/MFe3O4 = 2,32 / 232 = 0,01 mol
Theo phương trình hóa học:
- Muốn điều chế 1 mol Fe3O4 cần dùng 3 mol Fe và 2 mol O2
- Vậy muốn điều chế 0,01 mol Fe3O4 cần dùng 0,03 mol Fe và 0,02 mol O2
⇒ Số gam Fe và số gam khí O2 cần dùng là:
mFe = nFe x MFe = 0,03 x 56 = 1,68 (g)
mO2 = nO2 x MO2 = 0,02 x 32 = 0,64 (g)
b) Ta có PTHH của phản ứng điều chế O2 từ KMnO4:
2KMnO4 → K2MnO4 + MnO2 + O2
Theo phương trình hóa học:
- Muốn điều chế 1 mol O2 cần dùng 2 mol KMnO4
- Vậy muốn điều chế 0,02 mol O2 cần dùng 0,04 mol KMnO4
⇒ Số gam KMnO4 cần dùng là:
mKMnO4 = nKMnO4 x MKMnO4 = 0,04 x 158 = 6,32 (g)
Đánh giá bài viếtTừ khóa » Nguyên Liệu Sản Xuất O2 Trong Công Nghiệp
-
Điều Chế O2 Lỏng, Sản Xuất O2 Trong Phòng Thí Nghiệm Và ... - Venmer
-
Nguyên Liệu để Sản Xuất O2 Trong Công Nghiệp Là Phương án Nào Sau
-
Nguyên Liệu để Sản Xuất O2 Trong Công Nghiệp Là Phương ... - Hoc247
-
Điều Chế, Sản Xuất Oxi (O2) Trong Phòng Thí Nghiệm Và Trong Công ...
-
Cách điều Chế O2 Trong Phòng Thí Nghiệm Và Trong Công Nghiệp?
-
Nguyên Liệu để Sản Xuất O2 Trong Công Nghiệp Là ... - Khóa Học
-
Hoá 8 Bài 27: Điều Chế, Sản Xuất Oxi (O2) Trong Phòng Thí Nghiệm Và ...
-
Nguyên Liệu để Sản Xuất O2 Trong Công Nghiệp Là Phương ...
-
Nguyên Liệu để Sản Xuất Khí O2 Trong Công Nghiệp Là Phương án ...
-
Nguyên Liệu để Sản Xuất O2 Trong Công Nghiệp Phương án Nào Sau ...
-
Trong Công Nghiệp Sản Xuất Oxi Bằng Cách - Thả Rông
-
Nguyên Liệu để Sản Xuất Khí O2 Trong Phòng Thí Nghiệm Là - Thả Rông
-
Trong Công Nghiệp Khí Oxi được điều Chế Bằng Cách Nào Sau đây