Điều Chế SO2 Trong Phòng Thí Nghiệm | Sơ đồ, Phản ứng
Có thể bạn quan tâm
Nội dung bài viết
- Câu hỏi: Điều chế SO2 trong phòng thí nghiệm như thế nào?
- Lưu huỳnh đioxit (SO2) là gì?
- Tính chất hóa học của khí lưu huỳnh đioxit (SO2)
- Tác dụng với nước cất tạo ra một axit yếu:
- Tác dụng với một số dung dịch bazơ tạo ra muối:
- Vừa có phản ứng khử vừa có phản ứng oxi hóa:
- Phương pháp điều chế so2 trong phòng thí nghiệm
- Các ứng dụng của khí SO2 trong các lĩnh vực sản xuất
Câu hỏi: Điều chế SO2 trong phòng thí nghiệm như thế nào?
Lời giải:
– Trong phòng thí nghiệm, SO2 được điều chế bằng cách cho muối sunfit tác dụng với axit mạnh như HCl, H2SO4.
Ví dụ:
Na2SO3 + 2HCl → 2NaCl + H2O + SO2
– Ngoài ra, khí SO2 còn được điều chế bằng cách cho Cu tác dụng với H2SO4 đặc.
Cu + 2H2SO2đặc → CuSO4 + SO2 + 2H2O
Khí SO2 được thu bằng phương pháp đẩy không khí.
SO2 là loại khí xuất hiện phổ biến trong cuộc sống của chúng ta. Việc nghiên cứu, giảm tác hại của nó trong bầu khí quyển, sản xuất và sử dụng vào các mục đích công nghiệp thực sự cần thiết. Bạn có biết cách điều chế SO2 trong phòng thí nghiệm, công nghiệp được thực hiện như thế nào hay không?
Lưu huỳnh đioxit (SO2) là gì?
Lưu huỳnh đioxit (SO2) là một hợp chất hóa học vô cơ. Ở bình thường nó ở thể khí, không có màu, nặng hơn không khí nhiều. Chúng ta có thể thu được khí lưu huỳnh đioxit (SO2) bằng cách đốt lưu huỳnh. Khi đốt lưu huỳnh, khí SO2 sinh ra chúng ta sẽ cảm thấy một mùi hôi khó chịu bốc lên.
Cấu tạo của khí lưu huỳnh đioxit (SO2)
- Các tên gọi khác của khí SO2: sulfur đioxit, anhidrit sunfurơ, lưu huỳnh oxit.
- Một số tính chất vật lý cụ thể của loại khí này:
- So2 có tan trong nước
- Độ hòa tan trong nước là: 9,4 g/100ml (ở nhiệt độ phòng 25oC)
- Khối lượng riêng là: 2,551 g/l
- Điểm nóng chảy là: -72,4*C (200.75 K)
- Điểm sôi là: -10*C (263 K)
Chúng ta có thể thấy khí SO2 trong thực tiễn cuộc sống, ở tự nhiên nó là sản phẩm của các vụ núi lửa phun trào, các hợp chất sinh học có chứa lưu huỳnh. Ở các hoạt động của các nhà máy, khu công nghiệp, khu lọc dầu, đốt than, sản xuất xi măng, luyện kim, khói thải xe cộ, đốt rơm rạ ngoài đồng,…

Khí SO2 có lẫn trong đám khói khi cháy
Tính chất hóa học của khí lưu huỳnh đioxit (SO2)
Lưu huỳnh đioxit (SO2) là một chất có tính oxi hóa, khi oxi hóa chậm trong không khí sẽ chuyển thành SO3. Chất xúc tác cho phản ứng này chính là quá trình quang hóa. Ngoài ra, một số tính chất hóa học cụ thể của SO2 gồm:
Tác dụng với nước cất tạo ra một axit yếu:
Phương trình: SO2 + H2O → H2SO3
Tác dụng với một số dung dịch bazơ tạo ra muối:
SO2 + NaOH → NaHSO3
SO2 + 2NaOH → Na2SO3 + H2O
Vừa có phản ứng khử vừa có phản ứng oxi hóa:
SO2 thể hiện tính khử qua các phản ứng sau:
2SO2 + O2 → 2SO3 (V2O5, 450oC)
Cl2 + SO2 + 2H2O → H2SO4 + 2HCl
SO2 làm mất màu nước Brom: SO2 + Br2 + 2H2O → 2HBr + H2SO4
SO2 làm mất màu thuốc tím: 5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
O2 thể hiện tính oxy hóa qua các phản ứng sau:
SO2 + 2H2S → 3S + 2H2O
SO2 + 2Mg → S + 2MgO
Phương pháp điều chế so2 trong phòng thí nghiệm
Cách điều chế SO2 trong phòng thí nghiệm được thực hiện theo cách khá đơn giản. Chúng ta cho Natri sunfit tác dụng với axit sunfuric để sinh ra khí SO2. Phương trình như sau:
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2
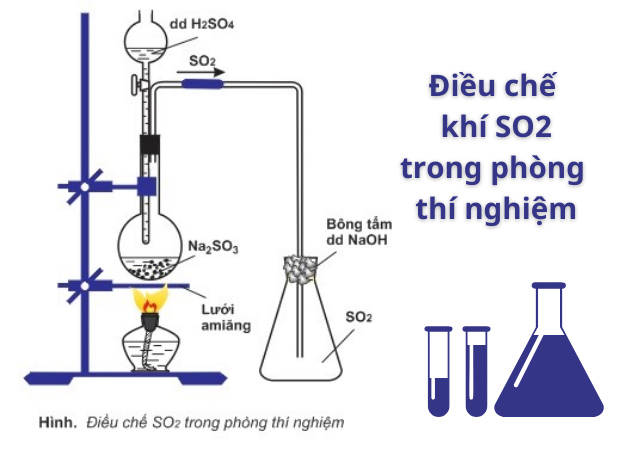
Sơ đồ điều chế SO2 trong phòng thí nghiệm
Hoặc có thể điều chế bằng cách cho Natri sunfit tác dụng với Axit clohydric:
Phương trình như sau: Na2SO3 + 2HCl → 2NaCl + H2O + SO2
Cho đồng (Cu) phản ứng H2SO4 đặc nóng: Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Ngoài cách điều chế ở phòng thí nghiệm, để sản xuất khí SO2 nhanh hơn thì người ta thực hiện đốt lưu huỳnh: S + O2(to) → SO2
Đốt cháy H2S (Hydro Sunfua) trong oxi dư: 2H2S + 3O2 → 2H2O + 2SO2
Đốt quặng Pirit Sắt: 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Các ứng dụng của khí SO2 trong các lĩnh vực sản xuất
Khí SO2 được ứng dụng rất nhiều trong các lĩnh vực sản xuất và đời sống. Nó được dùng để sản xuất Axit Sunfuric, sản xuất bột giấy, sản xuất dung dịch đường, bảo quản các loại thực phẩm sấy khô, sản xuất rượu,… Trong phòng thí nghiệm, SO2 được ứng dụng để nhận biết một số hợp chất.

SO2 ứng dụng trong rất nhiều ngành khác nhau
Có thể nói SO2 là một chất độc, gây ô nhiễm môi trường không khí. Tuy nhiên nó vẫn được sản xuất thường xuyên để phục vụ mục đích công nghiệp, là một trong những mắt xích quan trọng. Trên đây chúng tôi đã giải thích cho bạn đọc cách điều chế SO2 trong phòng thí nghiệm cụ thể nhất. Hãy theo dõi chúng tôi để cập nhật các kiến thức thường xuyên hơn nhé.
||Xem thêm bài viết khác:
- Kim Loại Là Gì? Tính Chất Hóa Học Chung Của Kim Loại
- Điều Chế Clo Trong Phòng Thí Nghiệm | Phương trình, sơ đồ
- Phương Trình Điều Chế HCl Trong Phòng Thí Nghiệm
- Cách Điều Chế Oxi Trong Phòng Thí Nghiệm
- Javen là gì? Cách Điều Chế Nước javen trong phòng thí nghiệm
Từ khóa » Nguyên Liệu Sản Xuất So2 Trong Phòng Thí Nghiệm
-
[CHUẨN NHẤT] Điều Chế SO2 Trong Phòng Thí Nghiệm - TopLoigiai
-
Điều Chế SO2 Trong Phòng Thí Nghiệm Như Thế Nào
-
Viết 4 Phương Trình điều Chế SO2 Trong Phòng Thí Nghiệm ... - HOC247
-
Điều Chế SO2 Trong Phòng Thí Nghiệm, Chúng Ta Tiến Hành Như Sau:
-
Nguyên Liệu điều Chế SO2 Trong Phòng Thí Nghiệm
-
SO2 được điều Chế Trong Phòng Thí Nghiệm Từ Các Hóa Chất Nào?
-
SO2 được điều Chế Trong Phòng Thí Nghiệm Từ Các Hóa Chất Nào?
-
Cặp Chất Nào Sau đây Có Thể Dùng để điều Chế SO2 Trong Phòng Thí ...
-
Điều Chế SO2 Trong Phòng Thí Nghiệm
-
Lưu Huỳnh Dioxit Có Nguy Hiểm Không? Điều Chế Và ứng Dụng
-
[Chi Tiết] Quy Trình Sản Xuất Axit Sunfuric Công Nghiệp - GhGroup
-
Hóa Chất Dùng để điều Chế Khí SO2 Trong Công Nghiệp Là - Hàng Hiệu
-
Phương Pháp Thu Khí O2 Và So2 Trong Phòng Thí Nghiệm - Học Tốt