Dung Dịch HCl Có PH = 3, Số Lần để Pha Loãng Dung ...
Có thể bạn quan tâm

CHỌN BỘ SÁCH BẠN MUỐN XEM
Hãy chọn chính xác nhé!
Trang chủ Lớp 11 Hóa họcCâu hỏi:
22/07/2024 2,442Dung dịch HCl có pH = 3, số lần để pha loãng dung dịch để thu được dung dịch HCl có pH = 4 là:
A. 30
B. 40
C. 70
D. 10
Đáp án chính xác Xem lời giải Xem lý thuyết Câu hỏi trong đề: Trắc nghiệm Sự điện li của nước. pH. Chất chỉ thị axit-bazơ có đáp án (Vận dụng) Bắt Đầu Thi ThửTrả lời:
 Giải bởi Vietjack
Giải bởi Vietjack Gọi dung dịch ban đầu có thể tích là V1
→nHCl = V1[H + ] = V1.10 – 3
(vì pH = 3 nên [H +]=10-3
Gọi dung dịch sau pha loãng có thể tích là V2
→nHCl = V2[H +] = V2.10 – 4
(vì pH = 4)
Do số mol của HCl không đổi nên: V1.10 – 3 = V2.10 – 4 → V2 = 10V1
Vậy phải pha loãng dung dịch 10 lần
Đáp án cần chọn là: D
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
ĐĂNG KÝ VIP
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1:
Thể tích dung dịch Ba(OH)20,025M cần cho vào 100 ml dung dịch hỗn hợp gồm HNO3và HCl có pH = 1, để thu được dung dịch có pH = 2 là
Xem đáp án » 05/01/2022 2,781Câu 2:
Cho 40 ml dung dịch HCl 0,75M vào 160 ml dung dịch chứa đồng thời Ba(OH)20,08M và KOH 0,04M. pH của dung dịch thu được là:
Xem đáp án » 05/01/2022 1,555Câu 3:
Trộn lẫn V ml dung dịch NaOH 0,01M với V ml dung dịch HCl 0,03 M được 2V ml dung dịch Y. Dung dịch Y có pH là:
Xem đáp án » 05/01/2022 1,546Câu 4:
Có 4 dung dịch có nồng độ bằng nhau : HCl ( pH = a) ; H2SO4(pH = b) ; NH4Cl (pH = c); NaOH ( pH = d). Kết quả nào sau đây đúng :
Xem đáp án » 05/01/2022 975Câu 5:
Có V1ml HCl (pH = 2). Cần thêm V2ml H2O để được dung dịch HCl mới có pH = 3. Quan hệ V1và V2là :
Xem đáp án » 05/01/2022 962Câu 6:
Dung dịch HCl và CH3COOH có cùng nồng độ. pH của hai dung dịch này tương ứng là x và y. Cứ 100 phân tử CH3COOH thì có 1 phân tử phân li. Quan hệ giữa x và y là:
Xem đáp án » 05/01/2022 834Câu 7:
Trộn 100ml dung dịch (gồm Ba(OH)20,1M và NaOH 0,1M) với 400 ml dung dịch (gồm H2SO40,0375 M và HCl 0,0125 M) thu được dung dịch X, giá trị pH của dung dịch X là:
Xem đáp án » 05/01/2022 822Câu 8:
Dung dịch NaOH có pH = 12. Cần pha loãng dung dịch này bao nhiêu lần để thu được dung dịch NaOH mới có pH = 11?
Xem đáp án » 05/01/2022 606Câu 9:
pH của dung dịch H2SO40,0005 M và pH của dung dịch CH3COOH 0,1 M (α = 4,25%) lần lượt là
Xem đáp án » 05/01/2022 591Câu 10:
Cho ba dung dịch có cùng giá trị pH, các dung dịch được sắp xếp theo thứ tự nồng độ mol tăng dần là:
Xem đáp án » 05/01/2022 552Câu 11:
Cho 100 ml dung dịch X chứa: 0,07 mol Na+; 0,02 mol SO42- và x mol OH-. 100 ml dung dịch Y có chứa y mol H+, Cl-, NO3-và 0,01 mol Na+ (tổng số mol Cl-và NO3-là 0,042). Trộn 100 ml dung dịch X với 100 ml dung dịch Y thu được dung dịch Z. Dung dịch Z có pH là
Xem đáp án » 05/01/2022 486 Xem thêm các câu hỏi khác »LÝ THUYẾT
Mục lục nội dung
Xem thêmI. Nước là chất điện li rất yếu
1. Sự điện li của nước
- Nước là chất điện li rất yếu. Thực nghiệm đã xác định được ở nhiệt độ thường cứ 555 triệu phân tử nước chỉ có 1 phân tử phân li ra ion.
- Phương trình điện li:
H2O⇄H++OH−
2. Tích số ion của nước
- Ở 25°C, tích số = [H+].[OH-] được gọi là tích số ion của nước. Tích số này là hằng số ở nhiệt độ xác định. Tuy nhiên, giá trị tích số ion của nước thường được dùng trong các phép tính, khi nhiệt độ không khác nhiều so với 25°C.
= [H+].[OH-] = 10^-14
⇒ [H+] = [OH-] = 10^-7 M.
- Môi trường trung tính là môi trường trong đó [H+] = [OH-] = 10^-7 M.
3. Ý nghĩa tích số ion của nước
a. Môi trường axit
- Là môi trường trong đó [H+] > [OH-] hay [H+] > 10^-7 M.
b. Môi trường kiềm
- Là môi trường trong đó [H+] < [OH-] hay [H+] < 10^-7 M.
Kết luận: Độ axit và độ kiềm của dung dịch có thể đánh giá bằng nồng độ H+.
+ Môi trường trung tính: [H+] = 10^-7 M.
+ Môi trường axit: [H+] > 10^-7 M.
+ Môi trường kiềm: [H+] < 10^-7 M.
II. Khái niệm về pH. Chất chỉ thị axit – bazơ
1. Khái niệm về pH
- pH được dùng để đánh giá độ axit và độ kiềm của dung dịch.
- Quy ước: [H+]=1,0.10−pHM
Tức là: [H+]=1,0.10−aM thì pH = a.
Về mặt toán học: pH=−lg[H+]
- Thang pH thường dùng có giá trị từ 1 đến 14, trong đó:
+ pH < 7: môi trường axit.
+ pH > 7: môi trường bazơ.
+ pH = 7: môi trường trung tính.
- Giá trị của pH có ý nghĩa to lớn trong thực tế. Chẳng hạn, pH của máu người và động vật có giá trị gần như không đổi hay tốc độ ăn mòn kim mòn kim loại trong nước tự nhiên phụ thuộc rất nhiều vào giá trị pH của nước.
2. Chất chỉ thị axit – bazơ
- Là chất có màu biến đổi phụ thuộc vào giá trị pH của dung dịch.
Ví dụ: Quỳ tím, phenolphatalenin.
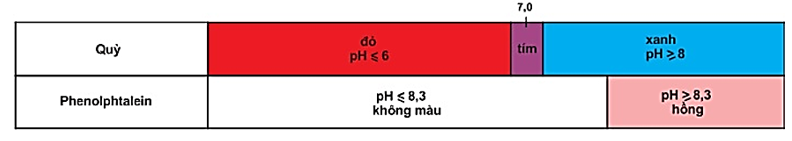
Hình 1: Màu của quỳ và phenolphtalein trong dung dịch ở các khoảng pH khác nhau
- Trộn lẫn một số chất chỉ thị có màu biến đổi kế tiếp nhau theo giá trị pH, ta được hỗn hợp chất chỉ thị vạn năng.
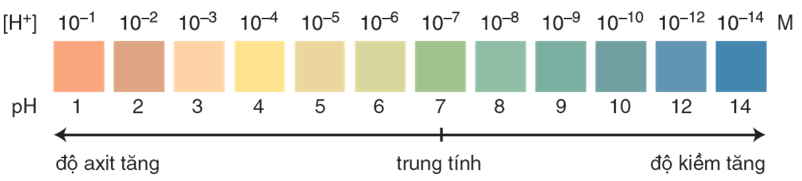
Hình 2: Màu của chất chỉ thị vạn năng (thuốc thử MERCK của Đức) ở các giá trị pH khác nhau
- Để xác định tương đối chính xác giá trị pH của dung dịch, người ta dùng máy đo pH.
3. Bảng công thức pH trong các môi trường

Đề thi liên quan
Xem thêm »-
 Đề thi cuối kì 2 Hóa 11 có đáp án 13 đề 8879 lượt thi Thi thử
Đề thi cuối kì 2 Hóa 11 có đáp án 13 đề 8879 lượt thi Thi thử -
 Đề kiểm tra Hóa 11 học kì 2 có đáp án (Mới nhất) 22 đề 8868 lượt thi Thi thử
Đề kiểm tra Hóa 11 học kì 2 có đáp án (Mới nhất) 22 đề 8868 lượt thi Thi thử -
 Bộ 30 đề thi học kì 1 Hóa 11 có đáp án 30 đề 8020 lượt thi Thi thử
Bộ 30 đề thi học kì 1 Hóa 11 có đáp án 30 đề 8020 lượt thi Thi thử -
 Đề thi Hóa học 11 Giữa kì 1 có đáp án 13 đề 7170 lượt thi Thi thử
Đề thi Hóa học 11 Giữa kì 1 có đáp án 13 đề 7170 lượt thi Thi thử -
 Đề thi Hóa 11 giữa kì 1 có đáp án 9 đề 5560 lượt thi Thi thử
Đề thi Hóa 11 giữa kì 1 có đáp án 9 đề 5560 lượt thi Thi thử -
 Chuyên đề ôn tập Hóa Học 11 - 12 có lời giải 13 đề 5127 lượt thi Thi thử
Chuyên đề ôn tập Hóa Học 11 - 12 có lời giải 13 đề 5127 lượt thi Thi thử -
 Trắc nghiệm Ankan có đáp án 6 đề 4993 lượt thi Thi thử
Trắc nghiệm Ankan có đáp án 6 đề 4993 lượt thi Thi thử -
 Trắc nghiệm Mở đầu về hóa học hữu cơ có đáp án 5 đề 4925 lượt thi Thi thử
Trắc nghiệm Mở đầu về hóa học hữu cơ có đáp án 5 đề 4925 lượt thi Thi thử -
 Chuyên đề ôn luyện Hóa Học 10 - 11 cực hay có lời giải chi tiết 9 đề 4530 lượt thi Thi thử
Chuyên đề ôn luyện Hóa Học 10 - 11 cực hay có lời giải chi tiết 9 đề 4530 lượt thi Thi thử -
 Đề thi Hóa học 11 Giữa kì 1 có đáp án 13 đề 4335 lượt thi Thi thử
Đề thi Hóa học 11 Giữa kì 1 có đáp án 13 đề 4335 lượt thi Thi thử
Từ khóa » Pha Loãng Dd Hcl (ph=3) Bao Nhiêu Lần để được Dd Mới Có Ph = 4
-
Pha Loãng Dd HCL Có PH=3 Bao Nhiêu Lần để được Dd Mới ... - Hoc24
-
Dung Dịch HCl Có PH = 3. Cần Pha Loãng Dung Dịch Axit ... - Khóa Học
-
Pha Loãng Dd HCL Có PH=3 Bao Nhiêu Lần để được Dd Mới Có PH=4?
-
Dung Dịch HCl Có PH = 3. Cần Pha Loãng Dung Dịch Axit Này (bằng N
-
Pha Loãng Dung Dịch Hcl Có Ph=3 Bao Nhiêu Lần để ...
-
[LỜI GIẢI] Dung Dịch HCl Có PH = 3 Cần Pha Loãng Dung Dịch Axit Nà
-
Pha Loãng Dung Dịch Hcl Có Ph = 3 Bao Nhiêu Lần để được Dung Dịch ...
-
Dung Dịch HCl Có PH=3 , Cần Pha Loãng Dd Này ( Bằng Nước) Bao ...
-
Pha Loãng Dung Dịch HCl Có PH = 3 Bao Nhiêu Lần để được Dung ...
-
Dung Dịch HCl Có PH = 3, Số Lần để Pha Loãng Dung Dịch để Thu ...
-
Pha Loãng Dd Hcl Có Ph=3 Bao Nhiêu Lần để được Dd Mới Có Ph=5
-
Dd Hno3 Có Ph = 3. Cần Pha Loãng Dd Trên Bao Nhiêu Lần để Thu ...
-
Cần Pha Loãng Dung Dịch Hcl Có Ph = 2 Bao Nhiêu Lần để ... - HoiCay
-
Dung Dịch HCl Có PH = 3. Cần Pha Loãng Dung Dịch ...