Ethyl Amin – Wikipedia Tiếng Việt
Có thể bạn quan tâm
Nội dung
chuyển sang thanh bên ẩn- Đầu
- Bài viết
- Thảo luận
- Đọc
- Sửa đổi
- Sửa mã nguồn
- Xem lịch sử
- Đọc
- Sửa đổi
- Sửa mã nguồn
- Xem lịch sử
- Các liên kết đến đây
- Thay đổi liên quan
- Liên kết thường trực
- Thông tin trang
- Trích dẫn trang này
- Tạo URL rút gọn
- Tải mã QR
- Tạo một quyển sách
- Tải dưới dạng PDF
- Bản để in ra
- Wikimedia Commons
- Khoản mục Wikidata
| Ethylamin[1] | |
|---|---|
| Danh pháp IUPAC | Ethanamine |
| Tên khác | Ethylamin, Monoethylamin, Aminoethan, 1-Aminoethan, |
| Nhận dạng | |
| Số CAS | 75-04-7 |
| PubChem | 6341 |
| Số EINECS | 200-834-7 |
| Số RTECS | KH2100000 |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| Thuộc tính | |
| Công thức phân tử | C2H7N |
| Khối lượng mol | 45,08 g/mol |
| Bề ngoài | Chất lỏng màu vàng |
| Khối lượng riêng | 0,689 g/cm³ |
| Điểm nóng chảy | -81 °C |
| Điểm sôi | 16,6 °C |
| Độ hòa tan trong nước | Trộn lẫn |
| Áp suất hơi | 121 kPa (20 °C) |
| Các nguy hiểm | |
| Nguy hiểm chính | Độc hại, ăn mòn, dễ cháy |
| NFPA 704 |
|
| Chỉ dẫn R | R12, 20, 22, 34, 36, 37, 38 |
| Chỉ dẫn S | S16, 26, 29 |
| Điểm bắt lửa | -17 °C |
| Nhiệt độ tự cháy | 385 °C |
| Giới hạn nổ | 3,5-14 %V |
| Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). Tham khảo hộp thông tin | |
Ethylamin hay ethanamin là một hợp chất hữu cơ thuộc chức amin có công thức phân tử là C2H7N. Công thức cấu tạo của ethylamin là CH3CH2NH2.
Tính chất vật lý
[sửa | sửa mã nguồn]Ethylamin là chất khí tan nhiều trong nước, có mùi khai giống amonia. Ethylamin là amin bậc nhất.
Ethylamin hoà tan được trong hầu hết các dung môi và được coi là một base yếu - tính chất điển hình của amin với pKa[CH3CH2NH3]+ = 10.8 (pKa+pKb=14 ở đktc). Ethylamin được sử dụng rộng rãi trong công nghiệp hóa chất và tổng hợp hữu cơ.
Ethylamin, giống như một vài amin khác, có tính chất bất thường là hòa tan lithi kim loại để tạo ra ion [Li(amin)4]+ và electron solvat hóa. Làm bay hơi dung dịch này sẽ thu lại được lithi kim loại. Các dung dịch như thế được sử dụng trong khử các hợp chất hữu cơ chưa no, như naphtalen[2]
Tổng hợp
[sửa | sửa mã nguồn]Ethylamin có thể được điều chế trong phòng thí nghiệm bằng phản ứng của ethylen với amonia với sự hiện diện của chất xúc tác là amide kim loại kiềm như natri amide.[3]
H2C=CH2 + NH3 → CH3CH2NH2
Nó cũng có thể tổng hợp từ ethanal và amoni chloride.
2 CH3CHO + NH4Cl → CH3CH2NH3Cl + CH3CO2H CH3CH2NH3Cl + NaOH → CH3CH2NH2 + NaCl + H2OEthylamin cũng có thể sản xuất trực tiếp từ ethanol và amonia với sự hiện diện của hydro, sử dụng các chất xúc tác hydro hóa, chẳng hạn như tỷ lệ 4:1 hỗn hợp nickel-đồng. Phản ứng này đòi hỏi nhiệt độ và/hoặc áp suất cao.[4]
![]()
Các amin như ethylamin cũng có thể được tổng hợp bằng phản ứng khử các amit như acetamide, chẳng hạn như sử dụng lithi nhôm hydride (LiAlH4 hay LAH), theo phản ứng sau:
2RCONR2 + LiAlH4 → 2RCH2NR2 + LiAlO2[5]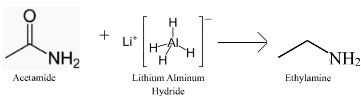
Ethylamin cũng có thể điều chế thông qua phản ứng thế ái lực hạt nhân của haloethan (như chloroethan hay bromoethan) với amonia như là tác nhân, kết hợp với các base mạnh như kali hydroxide. Nó tạo thành cation ethylamoni. Một lượng đáng kể phụ phẩm cũng được tạo ra, bao gồm diethylamin và triethylamin cũng như cation tetraethyl amoni, mà từ đó ethylamin có thể được tách ra thông qua chưng cất đơn giản do tất cả các phụ phẩm còn lại đều có điểm sôi cao hơn đáng kể[6][7]
C2H5Cl + NH3 → C2H8N+ + Cl- C2H8N+ + Cl- + KOH → C2H7N + KCl + H2O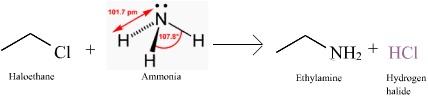
Thay vì thế, nếu halomethan được sử dụng trong phản ứng nói trên thì nó sẽ sinh ra methylamin mặc dù các phụ phẩm khác dimethylamin, trimethylamin và tetramethyl amoni là khó tách hơn nhiều do chúng có điểm sôi rất gần nhau.
Phản ứng
[sửa | sửa mã nguồn]Phản ứng của ethylamin với sulfuryl chloride tiếp theo sau bởi oxy hóa sulfonamide tạo ra diethyl diazen, EtN=NEt.[8]
Ethylamin cũng có thể bị oxy hóa bằng các chất oxy hóa mạnh như kali permanganat để tạo ra nitroethan.
Tham khảo
[sửa | sửa mã nguồn]- ^ Merck Index, Ấn bản lần thứ 12, 3808.
- ^ Kaiser E. M.; Benkeser R. A. Δ9,10-Octalin, Organic Syntheses, tập 6, trang
- ^ Ulrich Steinbrenner, Frank Funke, Ralf Böhling, Method and device for producing ethylamine and butylamine Lưu trữ ngày 12 tháng 9 năm 2012 tại archive.today, Bằng sáng chế Hoa Kỳ số 7161039.
- ^ "Production of amines from alcohols"[liên kết hỏng]
- ^ "The reduction of acid amides with lithium aluminum hydride."[liên kết hỏng]
- ^ Chemistry in Context, John Holman, Graham Hill, trang 461]
- ^ Nucleophilic substitution, Chloroethane & Ammonia Lưu trữ ngày 28 tháng 5 năm 2008 tại Wayback Machine, St Peter's School
- ^ Ohme R.; Preuschhof H.; Heyne H.-U. Azoethane, Organic Syntheses, tập 6, trang 78 (1988)
Liên kết ngoài
[sửa | sửa mã nguồn]- Dữ liệu an toàn hóa chất tại www.inchem.org
- Dữ liệu MSDS Lưu trữ ngày 11 tháng 10 năm 2007 tại Wayback Machine
- Ethylamin
- Hóa chất danh sách I của DEA
- Amin
- Bản mẫu webarchive dùng liên kết archiveis
- Bài có liên kết hỏng
- Bản mẫu webarchive dùng liên kết wayback
Từ khóa » Etylamin Là Chất Lỏng ở điều Kiện Thường
-
Ở điều Kiện Thường, Metylamin Và Etylamin Là Những Chất Khí Có Mùi ...
-
Amin Nào Sau đây Là Chất Lỏng ở điều Kiện Thường? A. Metylamin
-
Amin Nào Sau đây Là Chất Lỏng ở điều Kiện Thường? - Khóa Học
-
Amin Nào Sau đây Là Chất Lỏng ở điều Kiện Thường? A. Metylamin B ...
-
Amin Nào Sau đây Là Chất Lỏng ở điều Kiện ...
-
Ở điều Kiện Thường Amin Nào Sau đây ở Trạng Thái Lỏng
-
Phát Biểu Nào Sau đây đúng?
-
Amin Nào Sau đây Là Chất Lỏng ở điều Kiện Thường ...
-
Amin Nào Sau đây Là Chất Lỏng ở điều Kiện Thường? - Hoc247
-
Amin Nào Sau đây Là Chất Lỏng ở điều Kiện Thường? - Vietjack.online
-
Ở điều Kiện Thường Chất Nào Sau đây ở Trạng Thái Lỏng ?
-
(a) Metylamin, đimetylamin, Etylamin Là Những Chất Khí ở điều Kiện ...
-
Ở điều Kiện Thường Amin Nào ở Trạng Thái Lỏng | HoiCay
-
Ở điều Kiện Thường Amin Nào ở Trạng Thái Lỏng - Thả Rông
