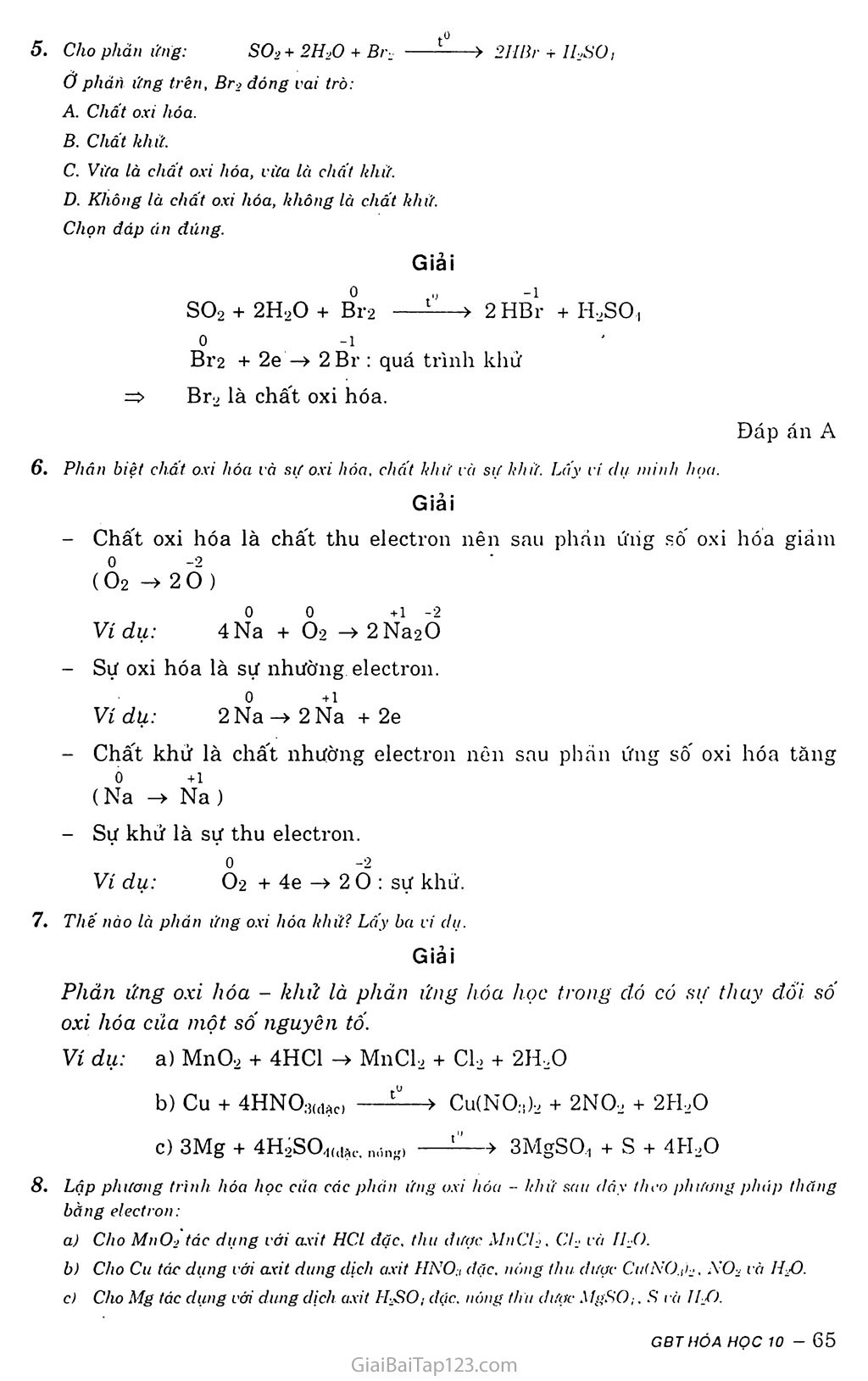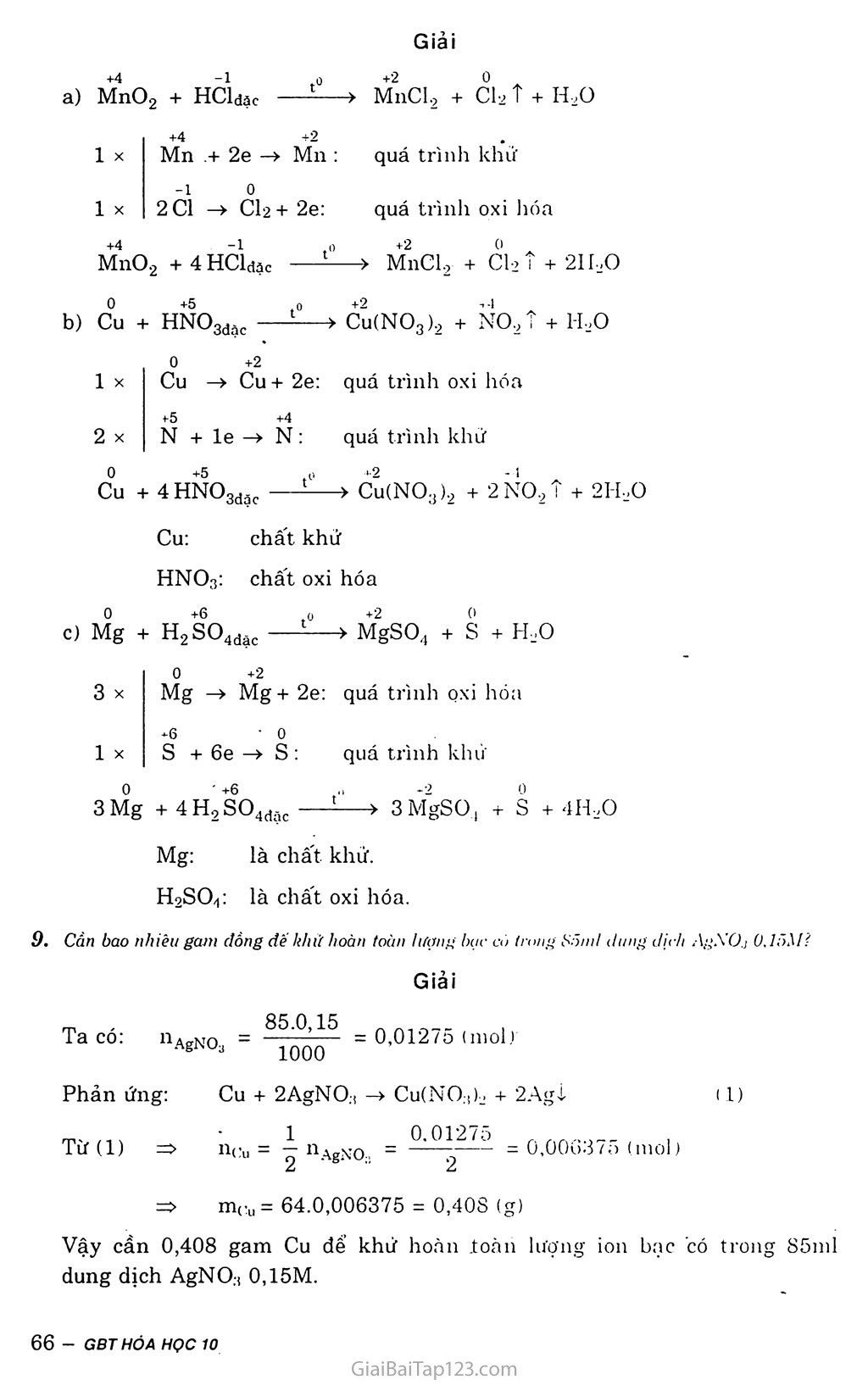Giải Bài Tập Hóa 10 Bài 17: Phản ứng Oxi Hóa - Khử
Có thể bạn quan tâm


- Home
- Lớp 1,2,3
- Lớp 1
- Giải Toán Lớp 1
- Tiếng Việt Lớp 1
- Lớp 2
- Giải Toán Lớp 2
- Tiếng Việt Lớp 2
- Văn Mẫu Lớp 2
- Lớp 3
- Giải Toán Lớp 3
- Tiếng Việt Lớp 3
- Văn Mẫu Lớp 3
- Giải Tiếng Anh Lớp 3
- Lớp 4
- Giải Toán Lớp 4
- Tiếng Việt Lớp 4
- Văn Mẫu Lớp 4
- Giải Tiếng Anh Lớp 4
- Lớp 5
- Giải Toán Lớp 5
- Tiếng Việt Lớp 5
- Văn Mẫu Lớp 5
- Giải Tiếng Anh Lớp 5
- Lớp 6
- Soạn Văn 6
- Giải Toán Lớp 6
- Giải Vật Lý 6
- Giải Sinh Học 6
- Giải Tiếng Anh Lớp 6
- Giải Lịch Sử 6
- Giải Địa Lý Lớp 6
- Giải GDCD Lớp 6
- Lớp 7
- Soạn Văn 7
- Giải Bài Tập Toán Lớp 7
- Giải Vật Lý 7
- Giải Sinh Học 7
- Giải Tiếng Anh Lớp 7
- Giải Lịch Sử 7
- Giải Địa Lý Lớp 7
- Giải GDCD Lớp 7
- Lớp 8
- Soạn Văn 8
- Giải Bài Tập Toán 8
- Giải Vật Lý 8
- Giải Bài Tập Hóa 8
- Giải Sinh Học 8
- Giải Tiếng Anh Lớp 8
- Giải Lịch Sử 8
- Giải Địa Lý Lớp 8
- Lớp 9
- Soạn Văn 9
- Giải Bài Tập Toán 9
- Giải Vật Lý 9
- Giải Bài Tập Hóa 9
- Giải Sinh Học 9
- Giải Tiếng Anh Lớp 9
- Giải Lịch Sử 9
- Giải Địa Lý Lớp 9
- Lớp 10
- Soạn Văn 10
- Giải Bài Tập Toán 10
- Giải Vật Lý 10
- Giải Bài Tập Hóa 10
- Giải Sinh Học 10
- Giải Tiếng Anh Lớp 10
- Giải Lịch Sử 10
- Giải Địa Lý Lớp 10
- Lớp 11
- Soạn Văn 11
- Giải Bài Tập Toán 11
- Giải Vật Lý 11
- Giải Bài Tập Hóa 11
- Giải Sinh Học 11
- Giải Tiếng Anh Lớp 11
- Giải Lịch Sử 11
- Giải Địa Lý Lớp 11
- Lớp 12
- Soạn Văn 12
- Giải Bài Tập Toán 12
- Giải Vật Lý 12
- Giải Bài Tập Hóa 12
- Giải Sinh Học 12
- Giải Tiếng Anh Lớp 12
- Giải Lịch Sử 12
- Giải Địa Lý Lớp 12
Các bài học tiếp theo
- Bài 18: Phân loại phản ứng trong hóa học vô cơ
- Bài 19: Luyên tập: Phản ứng oxi hóa - khử
- Bài 21: Khái quát về nhóm halogen
- Bài 22: Clo
- Bài 23: Hiđroclorua - Axit clohiđric và muối clorua
- Bài 24: Sơ lược về hợp chất có oxi của clo
- Bài 25: Flo - Brom - Iot
- Bài 26: Luyện tập: Nhóm halogen
- Bài 29: Oxit - Ozon
- Bài 30: Lưu huỳnh
Các bài học trước
- Bài 16: Luyên tập - Liên kết hóa học
- Bài 15: Hóa trị và số oxi hóa
- Bài 14: Tinh thể nguyên tử và tinh thể phân tử
- Bài 13: Liên kết cộng hóa trị
- Bài 12: Liên kết ion - Tinh thể ion
- Bài 11: Luyện tập: Bảng tuần hoàn, sự biến đổi tuần hoàn cấu hình electron nguyên tử và tính chất của các nguyên tố hóa học
- Bài 10: Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
- Bài 9: Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học. Định luật tuần hoàn
- Bài 8: Sự biến đổi tuần hoàn cấu hình electron nguyên tử của các nguyên tố hóa học
- Bài 7: Bảng tuần hoàn các nguyên tố hóa học
Tham Khảo Thêm
- Giải Bài Tập Hóa Học 10(Đang xem)
- Giải Hóa 10
- Sách Giáo Khoa - Hóa Học 10
Giải Bài Tập Hóa Học 10
- Chương I - NGUYÊN TỬ
- Bài 1: Thành phần nguyên tử
- Bài 2: Hạt nhân nguyên tử - Nguyên tố hóa học - Đồng vị
- Bài 3: Luyện tập: Thành phần nguyên tử
- Bài 4: Cấu tạo vỏ nguyên tử
- Bài 5: Cấu hình electron nguyên tử
- Bài 6: Luyện tập: Cấu tạo vỏ nguyên tử
- Chương 2 - BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC VÀ ĐỊNH LUẬT TUẦN HOÀN
- Bài 7: Bảng tuần hoàn các nguyên tố hóa học
- Bài 8: Sự biến đổi tuần hoàn cấu hình electron nguyên tử của các nguyên tố hóa học
- Bài 9: Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học. Định luật tuần hoàn
- Bài 10: Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
- Bài 11: Luyện tập: Bảng tuần hoàn, sự biến đổi tuần hoàn cấu hình electron nguyên tử và tính chất của các nguyên tố hóa học
- Chương 3 - LIÊN KẾT HÓA HỌC
- Bài 12: Liên kết ion - Tinh thể ion
- Bài 13: Liên kết cộng hóa trị
- Bài 14: Tinh thể nguyên tử và tinh thể phân tử
- Bài 15: Hóa trị và số oxi hóa
- Bài 16: Luyên tập - Liên kết hóa học
- Chương 4 - PHẢN ỨNG OXI HÓA - KHỬ
- Bài 17: Phản ứng oxi hóa - khử(Đang xem)
- Bài 18: Phân loại phản ứng trong hóa học vô cơ
- Bài 19: Luyên tập: Phản ứng oxi hóa - khử
- Chương 5 - NHÓM HALOGEN
- Bài 21: Khái quát về nhóm halogen
- Bài 22: Clo
- Bài 23: Hiđroclorua - Axit clohiđric và muối clorua
- Bài 24: Sơ lược về hợp chất có oxi của clo
- Bài 25: Flo - Brom - Iot
- Bài 26: Luyện tập: Nhóm halogen
- Chương 6 - OXIT - LƯU HUỲNH
- Bài 29: Oxit - Ozon
- Bài 30: Lưu huỳnh
- Bài 32: Hiđro sunfua - Lưu huỳnh đioxit. Lưu huỳnh trioxit
- Bài 33: Axit sunfuric - Muối sunfat
- Bài 34: Luyện tập: Oxit và lưu huỳnh
- Chương 7 - TỐC ĐỘ PHẢN ỨNG VÀ CÂN BẰNG HÓA HỌC
- Bài 36: Tốc độ phản ứng hóa học
- Bài 38: Cân bằng hóa học
- Bài 39: Luyện tập: Tốc độ phản ứng và cân bằng hóa học
Từ khóa » Hóa Lớp 10 Bài 17
-
Giải Hóa 10 Bài 17: Phản ứng Oxi Hóa Khử
-
Bài 17. Phản ứng Oxi Hoá - Khử
-
Lý Thuyết Hóa 10: Bài 17. Phản ứng Oxi Hóa - Khử - TopLoigiai
-
Hoá Học 10 Bài 17: Phản ứng Oxi Hóa Khử - Hoc247
-
Giải Bài Tập Hóa 10 Bài 17: Phản ứng Oxi Hóa - Khử
-
Giải Bài Tập Hóa Học 10 - Bài 17: Phản ứng Oxi Hóa Khử
-
Soạn Hoá Học 10 Bài 17: Phản ứng Oxi Hóa Khử
-
Hóa Học Lớp 10 - Bài 17 - Phản ứng Oxi Hóa Khử - Tiết 1 - YouTube
-
Giải Bài 17 Hóa Học 10: Phản ứng Oxi Hóa Khử - Tech12h
-
Giải Hóa 10 Bài 17: Phản ứng Oxi Hóa - Khử Dầy đủ Nhất
-
HÓA HỌC LỚP 10 (Bài 17): PHẢN ỨNG OXI HÓA KHỬ
-
Hóa Học Lớp 10 – Bài 17 – Phản ứng Oxi Hóa Khử – Tiết 4
-
Phản ứng Oxi Hóa - Khử: Giải Hoá 10 Trang 82, 83
-
Giáo án Môn Hóa Học Lớp 10 - Bài 17: Phản ứng Oxi Hóa – Khử