Giải Hóa Học 9 Bài 18: Nhôm
Có thể bạn quan tâm
- Trang chủ
- Lớp 9
- Hóa học
Giải Hóa học 9 Bài 18: Nhôm
Đỗ Hương Ly Ngày: 12-05-2022 Lớp 9 2 K 2 K- 33 câu Trắc nghiệm Nhôm có đáp án 2023 – Hóa học lớp 9
- 12 câu Trắc nghiệm Nhôm và các hợp chất của nhôm tác dụng với dung dịch kiềm có đáp án 2023 – Hóa học lớp 9
- Trắc nghiệm Phản ứng nhiệt nhôm có đáp án 2023 – Hóa học lớp 9
- Giáo án hóa học 9 Bài 18: Nhôm mới nhất
- Lý thuyết Nhôm (mới 2023 + 33 câu trắc nghiệm) hay, chi tiết – Hóa học 9
- SBT Hóa học 9 Bài 18: Nhôm | Giải SBT Hóa học lớp 9
Tailieumoi.vn giới thiệu Giải bài tập Hóa học 9 Bài 18: Nhôm chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Nhôm lớp 9
Giải bài tập Hóa học lớp 9 Bài 18: Nhôm
Câu hỏi và bài tập (trang 57,58 sgk Hóa học lớp 9)
Bài 1 trang 57 sgk hoá học 9: Hãy điền vào bảng sau những tính chất tương ứng với những ứng dụng của nhôm:| Tính chất của nhôm | ứng dụng của nhôm |
| 1 | làm dây dẫn điện |
| 2 | Chế tạo máy bay, ô tô, xe lửa ,…. |
| 3 | làm dụng cụ gia đình: nồi xoong, khung cửa….. |
Điền vào bản sau những tính chất tương ứng với những ứng dụng của nhôm.
| Tính chất của nhôm | ứng dụng của nhôm | |
| 1 | Dẫn điện tốt | làm dây dẫn điện |
| 2 | Nhẹ, bền | Chế tạo máy bay, ô tô, xe lửa ,…. |
| 3 | Nhôm dẻo nên có thể cán thành đồ dùng bằng nhôm, dẫn nhiệt tốt, nóng chảy ở nhiệt độ cao | làm dụng cụ gia đình: nồi xoong, khung cửa….. |
Bài 2 trang 58 sgk hoá học 9: Thả một mảnh nhôm vào các ống nghiệm chứa các dung dịch sau:
a) MgSO4; b) CuCl2;
c) AgNO3; d) HCl.
Cho biết hiện tượng xảy ra. Giải thích và viết phương trình hoá học.
Phương pháp giải:Al chỉ đẩy được các kim loại đứng sau Al trong dãy điện hóa ra khỏi dung dịch muối.
a) Không phản ứng
b) Dựa vào màu sắc dung dịch thay đổi và kim loại sinh ra có màu gì => Nêu được hiện tượng
c) Tương tự b
d) Có khí bay ra hay không? => Nêu hiện tượng
Lời giải:a) Thả nhôm vào dung dịch MgSO4:Không có phản ứng, vì Al hoạt động hóa học kém hơn Mg, không đẩy được magie ra khỏi muối.
b) Thả nhôm vào dung dịch CuCl2: 2Al + 3CuCl2 → 2AlCl3 + 3Cu↓
Hiện tượng:Al tan dần, có chất rắn màu đỏ bám vào lá nhôm, màu xanh lam của dung dịch nhạt dần. Vì Al hoạt động mạnh hơn Cu, nên đẩy đồng ra khỏi dung dịch muối, tạo thành Cu (màu đỏ) bám vào là nhôm.
c) Thả nhôm vào dung dịch AgN03 : Al + 3AgN03 → Al(N03)3 + 3Ag↓
Hiện tượng: Al tan dần, có chất rắn màu trắng bám vào lá nhôm. Vì Al hoạt động hóa học mạnh hơn Ag, nên đẩy bạc ra khỏi muối, tạo thành Ag (màu trắng) bám vào lá nhôm.
d) Thả nhôm vào dung dịch HCl: 2Al + 6HCl → 2AlCl3 + 3H2↑
Hiện tượng: Có khí thoát ra, nhôm bị hòa tan dần. Vì nhôm đứng trước hiđro nên phản ứng với axit HCl, tạo thành muối nhôm clorua, tan và giải phóng khí hiđro.
Bài 3 trang 58 sgk hoá học 9: Có nên dùng xô, chậu, nồi nhôm để đựng vôi, nước vôi tôi hoặc vữa xây dựng không ? Hãy giải thích. Lời giải:Không nên. Vì vôi, nước vôi hoặc vữa xây dựng đều có chứa Ca(OH)2 là chất kiềm, chất này sẽ phá hủy dần các đồ vật bằng nhôm do có xảy ra các phản ứng.
Al203 + Ca(OH)2 → Ca(AlO2)2 + H2O
2Al + Ca(OH)2 + 2H2O → Ca(AlO2)2 + 3H2
Bài 4 trang 58 sgk hoá học 9: Có dung dịch muối AlCl3 lẫn tạp chất là CuCl2. Có thể dùng chất nào sau đây để làm sạch muối nhôm ? Giải thích và viết phương trình hoá học.a) AgNO3; b) HCl;
c) Mg; d)Al; e) Zn.
Phương pháp giải: Dùng chất nào sau khi phản ứng dung dịch thu được chỉ chứa AlCl3 Lời giải:Để làm sạch muối AlCl3 có lẫn tạp chất CuCl2 có thể dùng: nhôm, vì Al hoạt dộng hóa học mạnh hơn Cu, đẩy đồng ra khỏi dung dịch, tạo thành đồng kim loại Cu.
Phương trình hóa học: 2Al + 3CuCl2 → 2AlCl3 + 3Cu↓
Bài 5 trang 58 sgk hoá học 9: Thành phần hoá học chính của đất sét là :Al203.2Si02.2H20. Hãy tính phần trăm khối lượng của nhôm trong hợp chất trên. Phương pháp giải:Tính phân tử khối của đất sét =?
Giả sử có 1 mol đất sét => khối lượng của Al trong đất sét
áp dụng công thức tính thành phần phần trăm:
%Al=mAlmđấtsét.100%
Lời giải:Thành phần hóa học chính của đất sét là Al2O3. 2SiO2. 2H2O
Khối lượng mol của hợp chất : MAl203.2Si02.2H20=258
Khối lượng nhôm trong hợp chất = 27.2 = 54 (g)
Phần trăm khối lượng của nhôm trong hợp chất =
%mAl=54258⋅100%=20,93%
Bài 6 trang 58 sgk hoá học 9: Để xác định thành phần phần trăm khối lượng của hỗn hợp A gồm bột nhôm và bột magie, người ta thực hiện hai thí nghiệm sau :Thí nghiệm 1: Cho m gam hỗn hợp A tác dụng hết với dung dịch H2SO4 loãng dư, thu được 1568 ml khí ở điều kiện tiêu chuẩn.
Thí nghiệm 2: Cho m gam hỗn hợp A tác dụng với dung dịch NaOH dư, sau phản ứng thấy còn lại 0,6 gam chất rắn.
Tính phần trăm khối lượng của mỗi chất trong hỗn hợp A.
Phương pháp giải:Thí nghiệm 1: Cả Al và Mg cùng phản ứng
2Al + 3H2S04 → Al2(S04)3 + 3H2
Mg + H2S04 → MgS04 + H2
Thí nghiệm 2: Chỉ có Al tham gia phản ứng, chất rắn còn lại là Mg dư. => mMg= 0,6 (g)
Dựa vào PTHH (1), (2) và số mol khí H2 tính toán được số mol của Al
=> từ đó tính được phần trăm khối lượng mỗi kim loại trong hỗn hợp.
Lời giải:Số mol khí thoát ra= 1,568 : 22,4 = 0,07 mol
Phương trình hóa hoc: ở TN1 : 2Al + 3H2S04 → Al2(S04)3 + 3H2
TN2: Mg + H2S04 → MgS04 + H2
Ở thí nghiệm 2: Al tác dụng hết với NaOH, còn Mg không phản ứng nên khối lượng chất rắn còn lại là MgnMg=0,624=0,025mol
Gọi x là số mol Al
Theo phương trình (2): nH2(2)=nMg=0,025mol
Theo phương trình (1): nH2(1)=32nAl=32xmol
Theo hiđro, ta có: 1,5x + 0,025 = 0,07 => x = 0,03 mol = n Al
Khối lượng của hỗn hợp: m = mMg + mAl = 0,6 + 0,03.27 = 1,41 gam
Phần trăm khối lượng mỗi chất trong hỗn hợp A:
%Mg = 0,61,41 x 100% = 42,55%; %Al = 100% - 42,55% = 57,45%.
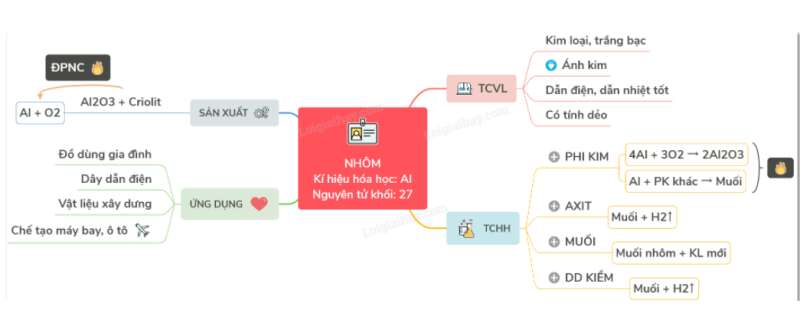
Lý thuyết Bài 18: NhômI. TÍNH CHẤT VẬT LÝ
- Nhôm là kim loại nhẹ (D = 2,7 g/cm3), màu trắng bạc, có ánh kim, nóng chảy ở 6600C
- Nhôm có tính dẫn điện, dẫn nhiệt tốt
- Nhôm có tính dẻo nên có thể cán mỏng được
II. TÍNH CHẤT HÓA HỌC
1. Nhôm phản ứng với phi kim
a) Phản ứng của nhôm với oxi
4Al + 3O2 2Al2O3
Ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững. Lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng với oxi trong không khí và nước.
b) Phản ứng với phi kim khác
2Al + 3Cl2 2AlCl3
2Al + 3S Al2S3
2. Tác dụng với nước
- Vật bằng nhôm không tác dụng với nước kể cả khi đun nóng vì có lớp màng Al2O3 không cho nước thấm qua
- Nếu phá bỏ lớp Al2O3 thì Al tác dụng với nước
2Al + 6H2O → Al(OH)3 + 3H2
3. Nhôm phản ứng với dung dịch axit
- Nhôm phản ứng với dung dịch axit HCl và H2SO4 loãng tạo thành muối nhôm và giải phóng hiđro
2Al + 6HCl → 2AlCl3 + 3H2
- Nhôm phản ứng với dung dịch axit H2SO4 đặc, nóng và HNO3 đặc, nóng
8Al + 30HNO3đặc 8Al(NO3)3 + 3N2O + 15H2O
8Al + 15H2SO4 đặc 4Al2(SO4)3 + 3H2S + 12H2O
*Chú ý: Nhôm không tác dụng với H2SO4 đặc, nguội và HNO3 đặc, nguội
4. Nhôm phản ứng với dung dịch muối
Nhôm phản ứng với dung dịch muối của kim loại kém hoạt động hơn tạo thành muối nhôm và giải phóng kim loại trong muối
2Al + 3Cu(NO3)2 → 2Al(NO3)3 + 3Cu
5. Nhôm phản ứng với dung dịch kiềm
Do lớp oxit nhôm bị hòa tan trong kiềm nên nhôm phản ứng với dung dịch kiềm
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
6. Tác dụng với một số oxit kim loại ở nhiệt độ cao (phản ứng nhiệt nhôm)
Nhôm khử được các oxit kim loại đứng sau Al trong dãy hoạt động hóa học
2Al + Fe2O3 2Fe + Al2O3
2Al + 3CuO 3Cu + Al2O3
III. ỨNG DỤNG
Nhôm và hợp kim của nhôm được sử dụng rộng rãi trong đời sống: đồ dùng gia đình, dây dẫn điện, vật liệu xây dựng....
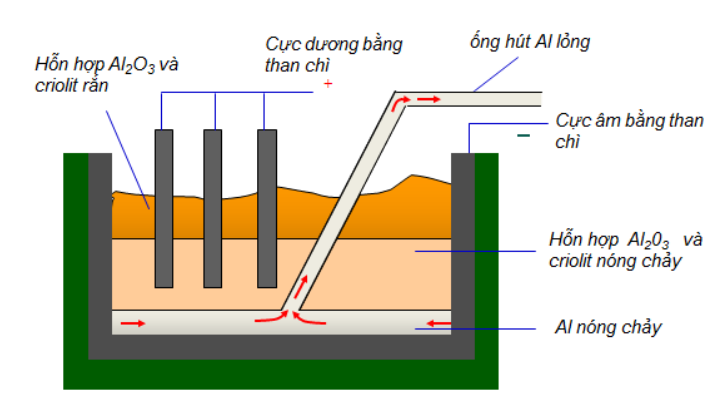
IV. SẢN XUẤT NHÔM
- Nguyên liệu để sản xuất nhôm là quặng bôxit có thành phần chủ yếu là Al2O3
Phương pháp: Điện phân hỗn hợp nóng chảy của nhôm oxit và criolit, thu được hỗn hợp nhôm và oxi
2Al2O3 4Al + 3O2
Sơ đồ tư duy: Nhôm
 Phương pháp giải một số dạng bài tập về nhôm và hợp chất của nhôm
Phương pháp giải một số dạng bài tập về nhôm và hợp chất của nhôm Dạng 1: Trắc nghiệm câu hỏi lý thuyết
* Một số ví dụ điển hình
Câu 1: Kim loại vừa tác dụng với dd HCl vừa tác dụng với dung dịch KOH là:
A. Fe
B. Mg
C. Na
D. Al
Hướng dẫn giải chi tiết:
Al vừa tác dụng với dd HCl vừa tác dụng với dd NaOH
PTHH: 2Al + 6HCl → 2AlCl3 + 3H2↑
Al + NaOH + H2O → NaAlO2 + 3/2 H2↑
Đáp án D
Câu 2: Nhôm được sản xuất bằng cách điện phân nóng chảy chất nào sau đây?
A. Al(OH)3
B. AlCl3
C. Al2O3
D. Al2(SO4)3
Hướng dẫn giải chi tiết:
Sau khi đã làm sạch tạp chất, người ta điện phân hỗn hợp nóng chảy của nhôm oxit và criolit trong bể điện phân, thu được nhôm và oxi.
=> Nhôm được sản xuất bằng cách điện phân nóng chảy nhôm oxit.
Đáp án C
Câu 3: Nhúng thanh nhôm vào dung dịch Cu(NO3)2 sau một thời gian thấy hiện tượng gì xảy ra:
A. màu xanh lam nhạt dần và có kết tủa màu đỏ lắng xuống đáy ống nghiệm.
B. màu xanh lam chuyển dần nâu đỏ và có chất rắn màu đỏ bám vào thanh nhôm.
C. màu xanh lam đậm dần và có chất rắn màu trắng bám vào thanh nhôm.
D. màu xanh lam nhạt dần và có chất rắn màu đỏ bám vào thanh nhôm.
Hướng dẫn giải chi tiết:
Nhúng thanh nhôm vào dung dịch Cu(NO3)2 sau một thời gian thấy hiện tượng màu xanh lam nhạt dần và có chất rắn màu đỏ bám vào thanh nhôm.
2Al +3Cu(NO3)2 → 2Al(NO3)3 + 3Cu
Đáp án D
Dạng 2: Nhôm và hợp chất của nhôm tác dụng với dung dịch kiềm
* Một số lưu ý cần nhớ
Ta có phản ứng của Al, Al2O3, Al(OH)3 tác dụng với dung dịch kiềm
Al + NaOH + H2O → NaAlO2 + 3/2 O2
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Al(OH)3 + NaOH → NaAlO2 + 2H2O
* Một số ví dụ điển hình
Ví dụ 1: Hòa tan a gam hỗn hợp Mg và Al bằng dung dịch HCl thu được 17,92 lít H2 (đktc). Cũng hỗn hợp trên hòa tan hoàn toàn trong dung dịch NaOH dư thu được 13,44 lít H2 (đktc). Giá trị của a là
Hướng dẫn giải chi tiết:
Hòa tan trong NaOH => chỉ có Al phản ứng
nH2=13,4422,4=0,6mol
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
0,4 mol ← 0,6 mol
Hòa tan trong HCl cả 2 kim loại đều tạo khí
nH2=17,9222,4=0,8mol
2Al + 6HCl → 2AlCl3 + 3H2
0,4 mol → 0,6 mol
Mg + 2HCl → MgCl2 + H2
0,2 mol ← 0,2 mol
=> a = mAl + mMg = 0,4.27 + 24.0,2 = 15,6 gam
Ví dụ 2: Để hòa tan hoàn toàn m gam Al cần dùng 100 ml dung dịch chứa NaOH 1M và Ba(OH)2 0,5M. Giá trị của m là
Hướng dẫn giải chi tiết:
nNaOH=0,1mol;nBa(OH)2=0,05mol
PTHH:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
0,1 ← 0,1 mol
2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2↑
0,1 ← 0,05 mol
=> ∑nAl phản ứng = 0,1 + 0,1 = 0,2 mol => mAl = 0,2.27 = 5,4 gam
Ví dụ 3: Cho 5,4 gam bột nhôm vào 200 ml dung dịch NaOH, sau phản ứng thấy khối lượng dung dịch tăng 3,6 gam. Nồng độ mol/lít của dung dịch NaOH là
Hướng dẫn giải chi tiết:
nAl = 0,2 mol
Gọi số mol Al phản ứng là x mol
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
x → x → 1,5x
Khối lượng dung dịch tăng 3,6 gam => ∆mtăng = mAl – mH2 = 3,6 gam
=> 27x – 1,5x.2 = 3,6 => x = 0,15 mol
Theo PT: nNaOH = nAl phản ứng = 0,15 mol
=>CMNaOH=0,150,2=0,75M
Ví dụ 4: Hoà tan hỗn hợp A gồm 13,7 gam Ba và 5,4 gam Al vào một lượng nước có dư thì thể tích khí thoát ra ở điều kiện tiêu chuẩn là
Hướng dẫn giải chi tiết:
nBa=13,7137=0,1mol;nAl=5,427=0,2mol
Ba + 2H2O → Ba(OH)2 + H2↑
0,1 mol → 0,1 mol → 0,1 mol
2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2↑
0,2 ← 0,1 mol → 0,3 mol
=>∑nH2=0,1+0,3=0,4mol=>VH2=0,4.22,4=8,96
Dạng 3: Phản ứng nhiệt nhôm
* Một số lưu ý cần nhớ:
Nhôm khử được oxit kim loại đứng sau Al trong dãy hoạt động hóa học
Ta có phương trình phản ứng:
Al + Fe2O3 → Al2O3 + Fe
2Al + 3ZnO → Al2O3 + 3Zn
* Một số ví dụ điển hình:
Ví dụ 1: Nung m gam hỗn hợp Al, Fe2O3 đến phản ứng hoàn toàn thu được hỗn hợp rắn Y. Chia Y làm 2 phần bằng nhau. Phần 1 tác dụng với dung dịch H2SO4 loãng dư, sinh ra 3,08 lít khí H2 ở đktc. Phần 2 tác dụng với dung dịch NaOH dư, sinh ra 0,84 lít khí H2 ở đktc. Giá trị của m là
Hướng dẫn giải chi tiết:
nH2(P1)=3,0822,4=0,1375mol;nH2(P2)=0,8422,4=0,0375mol
Phần 2 tác dụng với dung dịch NaOH dư tạo khí => Al còn dư sau phản ứng nhiệt nhôm
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
0,025 mol ← 0,0375 mol
=> nAl dư = 0,025 mol
Phần 1 tác dụng với dung dịch H2SO4 loãng dư => Al và Fe phản ứng tạo khí
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
0,025 mol → 0,0375 mol
Fe + H2SO4 → FeSO4 + H2
0,1 mol ← 0,1 mol
Phản ứng nhiệt nhôm:
2Al + Fe2O3 → Al2O3 + 2Fe
0,1 ← 0,05 ← 0,1 mol
=> ∑nAl ban đầu = nAl dư + nAl phản ứng = 0,025 + 0,1 = 0,125 mol
=> mhh 1 phần 11,375 gam => mhh ban đầu = 11,375.2 = 22,75 gam
Ví dụ 2: Tiến hành phản ứng nhiệt nhôm hỗn hợp X gồm Fe2O3 và Al trong điều kiện không có không khí thu được hỗn hợp chất rắn Y. Cho Y tác dụng với dung dịch NaOH dư sẽ thu được 0,3 mol H2. Mặt khác nếu cho Y tác dụng với dung dịch HCl dư sẽ thu được 0,4 mol H2. Số mol Al trong X là
Hướng dẫn giải chi tiết:
Cho Y tác dụng với dung dịch NaOH dư sẽ thu được 0,3 mol H2 => trong Y chứa Al dư
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
0,2 mol ← 0,3 mol
=> nAl dư = 0,2 mol
Y tác dụng với dung dịch HCl dư sẽ thu được 0,4 mol H2
2Al + 6HCl → AlCl3 + 3H2
0,2 mol → 0,3 mol
Fe + 2HCl → FeCl2 + H2
0,1 mol ← 0,1 mol
Phản ứng nhiệt nhôm:
2Al + Fe2O3 → Al2O3 + 2Fe
0,1 mol ← 0,1 mol
=> ∑nAl ban đầu = nAl dư + nAl phản ứng = 0,2 + 0,1 = 0,3 mol
Ví dụ 3: Trộn 6,48 gam Al với 16 gam Fe2O3. Thực hiện phản ứng nhiệt nhôm thu được chất rắn A. Khi cho A tác dụng dung dịch NaOH dư thu được 1,344 lít khí H2 (đktc). Hiệu suất phản ứng nhiệt nhôm (được tính theo chất thiếu) là
Hướng dẫn giải chi tiết:
Phản ứng nhiệt nhôm: 2Al + Fe2O3 → Al2O3 + 2Fe (1)
Xét tỉ lệ:
=> hiệu suất phản ứng tính theo Fe2O3
Al dư tác dụng với dung dịch NaOH tạo khí
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 (2)
0,04 mol ← 0,06 mol
=> nAl phản ứng (1) = nAl ban đầu – nAl dư = 0,24 – 0,04 = 0,2 mol
=> phản ứng = 0,5
nAl phản ứng = 0,1 mol
=> Hiệu suất phản ứng là
H = = 100%
Từ khóa :
Giải bài tập Hóa học 9 NhômĐánh giá
0
0 đánh giá
Đánh giáBài viết cùng môn học
Hóa học Lớp 12 Bộ 10 đề thi học kì 1 Hoá 12 Cánh diều có đáp án năm 2025 Nguyễn Lê Khánh Vy 1.1 K Hóa học Lớp 12
Bộ 10 đề thi học kì 1 Hoá 12 Cánh diều có đáp án năm 2025 Nguyễn Lê Khánh Vy 1.1 K Hóa học Lớp 12  Bộ 10 đề thi học kì 1 Hoá 12 Chân trời sáng tạo có đáp án năm 2025 Nguyễn Lê Khánh Vy 1.4 K Hóa học Lớp 12
Bộ 10 đề thi học kì 1 Hoá 12 Chân trời sáng tạo có đáp án năm 2025 Nguyễn Lê Khánh Vy 1.4 K Hóa học Lớp 12  Bộ 10 đề thi học kì 1 Hoá 12 Kết nối tri thức có đáp án năm 2025 Nguyễn Lê Khánh Vy 1.9 K Hóa học Lớp 12
Bộ 10 đề thi học kì 1 Hoá 12 Kết nối tri thức có đáp án năm 2025 Nguyễn Lê Khánh Vy 1.9 K Hóa học Lớp 12  Giải SBT Hóa 12 (Chân trời sáng tạo): Ôn tập chương 1 Thuy Quynh 1.6 K
Giải SBT Hóa 12 (Chân trời sáng tạo): Ôn tập chương 1 Thuy Quynh 1.6 K Tìm kiếm
Tìm kiếm
Bài Viết Xem Nhiều
- 1. Đề thi chuyên Hóa vào lớp 10 trường chuyên Khoa học tự nhiên năm 2022 7 K
- 2. 30 câu Trắc nghiệm Luyện tập chương 2: Kim loại có đáp án 2023 – Hóa học lớp 9 5.6 K
- 3. 300 câu Trắc nghiệm hóa học 9 chương 4 có đáp án 2023: Hiđrocacbon. Nhiên liệu 4.7 K
- 4. Giải Hóa học 9 Bài 27: Cacbon 3.9 K
- 5. 300 câu Trắc nghiệm hóa học 9 chương 5 có đáp án 2023: Dẫn xuất của Hiđrocacbon. Polime 3.8 K
Đánh giá tài liệu
Gửi đánh giáBáo cáo tài liệu vi phạm
Sai môn học, lớp học Tài liệu chứa link, quảng cáo tới các trang web khác Tài liệu chất lượng kém Tài liệu sai, thiếu logic, tài liệu chứa thông tin giả Nội dung spam nhiều lần Tài liệu có tính chất thô tục, cổ súy bạo lực Khác Báo cáoẨn tài liệu vi phạm
Lý do ẩn ẨnCÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
© 2021 Vietjack. All Rights Reserved.

Từ khóa » Hóa Học 9 Bài Tập Nhôm
-
Giải Hóa 9 Bài 18: Nhôm
-
Bài 18. Nhôm
-
Giải Hóa 9 Bài 18: Nhôm
-
Giải Bài 18 Hóa Học 9: Nhôm - Tech12h
-
Giải Bài Tập Hóa Học 9 - Bài 18: Nhôm
-
Hoá Học 9 Bài 18: Nhôm Giải Hoá Học Lớp 9 Trang 57, 58
-
Hoá Học 9 Bài 18: Nhôm
-
Lý Thuyết & Giải Bài Tập SGK Bài 18: Nhôm - Hóa Học Lớp 9
-
Lý Thuyết Hóa 9: Bài 18. Nhôm - TopLoigiai
-
Giải Bài Tập Hóa Học 9 Bài Nhôm - Gia Sư Toàn Cầu
-
Giải Vở Bài Tập Hóa Học 9 Bài 18: Nhôm - Haylamdo
-
Giải Hóa 9 Bài 18: Nhôm | Hay Nhất Giải Bài Tập Hóa Học 9.
-
Soạn Hoá Học 9 Bài 18: Nhôm | Học Cùng
-
Kim Loại SGK Môn Hóa Học Lớp 9 – Giải Bài Tập Bài 18: Nhôm