Giải Hoá Học 9 Bài 38: Axetilen Trang 122 SGK
Có thể bạn quan tâm
Nội dung bài viết
- Giải bài tập SGK Hóa 9 Bài 38
- Giải Bài 1 trang 122 SGK Hoá 9
- Giải bài 2 Hoá 9 SGK trang 122
- Giải bài 3 SGK Hoá 9 trang 122
- Giải Bài 4 trang 122 SGK Hoá 9
- Giải Bài 5 Hoá 9 SGK trang 122
- Lý thuyết trọng tâm Hóa 9 Bài 38: Axetilen
Sau bài học các em sẽ được nghiên cứu về tính chất vật lý, tính chất hóa học và các kiến thức liên quan đến Axetilen. Từ đó vận dụng kiến thức đã học để giải các bài tập ứng dụng và chứng minh các hiện tượng thực tiễn trong cuộc sống có liên quan.
Giải bài tập SGK Hóa 9 Bài 38
Giải Bài 1 trang 122 SGK Hoá 9
Hãy cho biết trong các chất sau:
CH3 – CH3 ; CH≡ CH; CH2 = CH2; CH4; CH≡ C – CH3.
a) Chát nào có liên kết ba trong phân tử?
b) Chất nào làm mất màu dung dịch brom?
Lời giải:
a) Có hai chất: CH≡ CH và CH≡ C – CH3 có liên kết ba.
b) Có ba chất làm mất màu dung dịch brom: CH≡ CH; CH2 = CH2 và CH≡ C – CH3.
Giải bài 2 Hoá 9 SGK trang 122
Cần bao nhiêu ml dung dịch brom 0,1M để tác dụng vừa đủ với:
a) 0,224 lít etilen ở điều kiện tiêu chuẩn.
b) 0,224 lít axetilen ở điều kiện tiêu chuẩn.
Lời giải:
a) 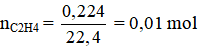
C2H4 + Br2 → C2H4Br2
1 mol 1 mol 1 mol
0,01 mol ?
Theo pt: nBr2 = nC2H4 = 0,01 mol → 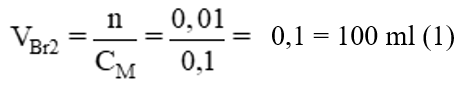
b) 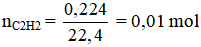
С2H2 + 2Вr2 → C2H2Br4
1mol 2 mol 1 mol
0,01 mol ?
nBr2 = 2. nС2H2 = 0,02 (mol) → 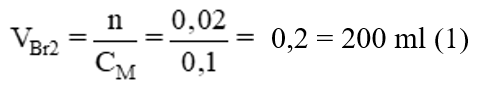
Giải bài 3 SGK Hoá 9 trang 122
Biết rằng 0,1 lít khí etilen (đktc) làm mất màu 50ml dung dịch brom. Nếu dùng 0,1 lít khí axetilen (đktc) thì có thể làm mất màu bao nhiêu ml dung dịch brom trên?
Lời giải:
Phương trình phản ứng:
C2H4 + Br2 → C2H4Br2. (1)
C2H2 + 2Br2 → C2H2Br4. (2)
Từ phương trình (1) và (2) ta nhận thấy:
Tỉ lệ nC2H4 : nBr2 = 1:1
nC2H2 : nBr2 = 1:2
⇒ Số mol brom phản ứng tối đa với C2H2 gấp 2 lần C2H4 nên thể tích dung dịch brom cần dùng khi phản ứng với C2H2 cũng gấp 2 lần khi phản ứng với C2H4
VBr2 cần dung khi phản ứng với 0,1 l axeilen là: 50ml × 2 = 100ml.
Giải Bài 4 trang 122 SGK Hoá 9
Đốt cháy 28ml hỗn hợp khí metan và axetilen cần phải dùng 67,2ml khí oxi.
a) Tính phần trăm thể tích của mỗi khí trong hỗn hợp.
b) Tính thể tích khí CO2 sinh ra.
(Các thể tích khí đo ở cùng điều kiện nhiệt độ và áp suất)
Lời giải:
Do các thể tích khí được đo ở cùng điều kiện nhiệt độ và áp suất nên tỉ lệ về thể tích cũng chính là tỉ lệ về số mol.
Gọi thể tích metan (CH4) là x (ml); thể tích axetilen (C2H2) là y (ml)
Theo bài ra: Vhh khí = 28 (ml)
→ x + y = 28 (1)
Phương trình phản ứng:
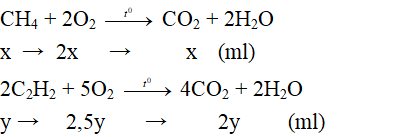
Theo bài ra thể tích khí oxi là 67,2 ml
→ 2x + 2,5y = 67,2 ml (2)
Từ (1) và (2) giải hệ phương trình được: x = 5,6 (ml) và y = 22,4 (ml).
a/ Phần trăm thể tích từng khí là:
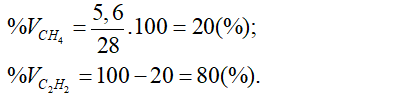
b/ Theo phương trình phản ứng ở trên có:
Thể tích khí CO2 = x + 2y = 5,6 + 2.22,4 = 50,4 (ml).
Giải Bài 5 Hoá 9 SGK trang 122
Cho 0,56 lít (đktc) hỗn hợp khí gồm C2H4, C2H2 tác dụng hết với dung dịch brom dư, lượng brom đã tham gia phản ứng là 5,6g
a) Hãy viết phương trình hóa học.
b) Tính phần trăm thể tích của mỗi khí trong hỗn hợp.
Lời giải:
a) Phương trình hóa học:
C2H4 + Br2 → C2H4Br2 (1)
C2H2 + 2Br2 → C2H2Br4 (2)
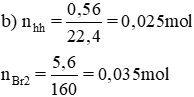
Gọi nC2H4 = x mol, nC2H2 = y.
nhh khí = x + y = 0,025.
Theo pt: nBr2(1) = nC2H4 = x mol, nBr2 (2) = 2. nC2H2= 2.y mol
⇒ nBr2 = x + 2y = 0,035.
b) Phần trăm thể tích mỗi khí:
Giải hệ phương trình ta có x = 0,015, y = 0,01.
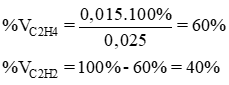
Lý thuyết trọng tâm Hóa 9 Bài 38: Axetilen
I. TÍNH CHẤT VẬT LÍ
Axetilen là chất khí, không màu, không mùi, nhẹ hơn không khí 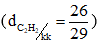 , ít tan trong nước.
, ít tan trong nước.
II. CẤU TẠO PHÂN TỬ
Axetien có công thức cấu tạo: H – C ≡ C– H; viết gọn HC ≡ CH.
Trong phân tử axetilen có một liên kết ba giữa hai nguyên tử cacbon.
Chú ý:
Trong liên kết ba, có hai liên kết kém bền, dễ đứt lần lượt trong các phản ứng hóa học.
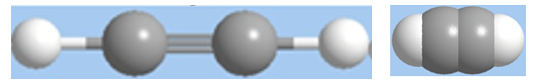
Hình 1: Mô hình phân tử axetilen dạng rỗng và dạng đặc.
III. TÍNH CHẤT HÓA HỌC
1. Tác dụng với oxi
Khí axetilen cháy tỏa nhiều nhiệt, sản phẩm sinh ra gồm CO2 và nước tương tự metan và etilen.
Phương trình hóa học:
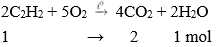
Nhận xét: Khi đốt cháy axetilen thu được số mol CO2 lớn hơn số mol H2O.
2. Phản ứng cộng với dung dịch brom
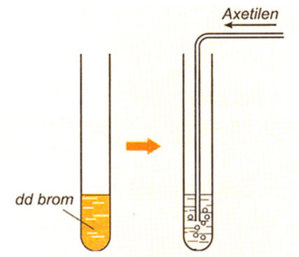
Hình 2: Mô phỏng thí nghiệm axetilen tác dụng với dung dịch brom.
Phương trình hóa học:
HC ≡ CH + Br2 → Br–CH=CH– Br
Sản phẩm mới sinh ra có liên kết đôi trong phân tử nên có thể cộng tiếp với 1 phân tử brom nữa
Br–CH=CH– Br + Br2 → Br2CH–CHBr2
Tổng quát: HC≡CH + 2Br2 → Br2CH–CHBr2
Trong điều kiện thích hợp, axetilen còn tham gia phản ứng cộng với nhiều chất khác như H2, Cl2...
IV. ỨNG DỤNG
Axetilen dùng làm nhiên liệu trong đèn xì oxi–axetilen để hàn, cắt kim loại.
Trong công nghiệp Axetilen là nguyên liệu để sản xuất poli (vinyl clorua) dùng sản xuất nhựa PVC và nhiều hóa chất khác.
V. ĐIỀU CHẾ
Trong phòng thí nghiệm axetilen được điều chế bằng cách cho canxi cacbua (thành phần chính của đất đèn) phản ứng với nước.
CaC2 + 2H2O → C2H2 + Ca(OH)2
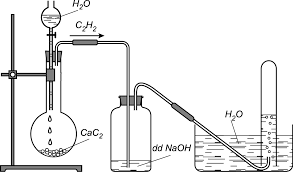
Hình 3: Điều chế và thu khí axetilen trong phòng thí nghiệm
Phương pháp hiện đại để điều chế axetilen hiện nay là nhiệt phân metan ở nhiệt độ cao, sau đó làm lạnh nhanh.
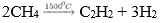
►►► CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải bài tập Hóa 9 Bài 38: Axetilen SGK trang 122 file PDF hoàn toàn miễn phí!
Từ khóa » Giải Bài Tập Sgk Hóa Học 9 Trang 122
-
Giải Bài 1 Trang 122 SGK Hóa 9
-
Giải Bài 1,2,3, 4,5 Trang 122 Hóa Lớp 9: Axetilen
-
Giải Bài 1, 2, 3, 4, 5 Trang 122 Sách Giáo Khoa Hóa Học 9
-
Bài 1 Trang 122 SGK Hoá Học 9 | SGK Hóa Lớp 9
-
Hướng Dẫn Giải Bài 1 2 3 4 5 Trang 122 Sgk Hóa Học 9
-
Giải Hóa 9 Bài 38: Axetilen
-
Giải Bài Tập 4: Trang 122 SGK Hóa Học Lớp 9 - Bài 38 - HocTapHay
-
Giải Bài Tập 1: Trang 122 SGK Hóa Học Lớp 9 - Bài 38 - HocTapHay
-
Bài 5 Trang 122 Sgk Hóa 9, Bài 5. Cho 0,56 Lít (đktc) Hỗn Hợp Khí
-
Bài Tập 1 Trang 122 SGK Hóa Học 9 - Hoc247
-
Cho 0,56 Lít (đktc) Hỗn Hợp Khí Gồm C2H4, C2H2 Tác Dụng Hết Với ...
-
Bài 3 Trang 122 SGK Hóa 9 - TopLoigiai
-
Bài 4 Trang 122 SGK Hóa 9 - Axetilen - Top Lời Giải
-
Bài 4 Trang 122 SGK Hoá Học 9 - CungHocVui