HCl Làm Quỳ Tím Chuyển Màu Gì? Lời Giải Chi Tiết, Chính Xác Nhất
Có thể bạn quan tâm
HCl làm quỳ tím chuyển màu gì? Tính chất vật lý, tính chất hóa học của HCL như thế nào? HCl tác dụng được với những chất nào? HCl có ứng dụng như thế nào trong đời sống? Dưới đây sẽ là bài viết đầy đủ và toàn diện nhất giải đáp mọi thắc mắc của bạn về Axit HCl.
Mục lục
- HCl là gì?
- HCl là axit mạnh hay yếu?
- HCl làm quỳ tím chuyển màu gì?
- Tính chất vật lý của HCl
- Tính chất hóa học của HCl
- Những chất tác dụng được với HCl
- Kim loại tác dụng với HCl
- Oxit kim loại tác dụng với HCl
- Oxit Bazơ tác dụng với HCl
- Muối tác dụng với HCl
- HCl không tác dụng với chất nào?
- Ứng dụng của axit HCl
HCl là gì?
HCl (Axit clohidric hay còn gọi là Acid Hydrocloric) là một axit vô cơ mạnh. Chất này được tạo thành từ 1 nguyên tử Hydro và 1 nguyên tử Clo do sự hòa tan của khí Hidro Clorua trong nước. Cả hiđro clorua và axit clohiđric đều có tính ăn mòn.
Phương trình phản ứng hóa học: H 2 + Cl 2 → 2HCl
HCl là axit mạnh hay yếu?
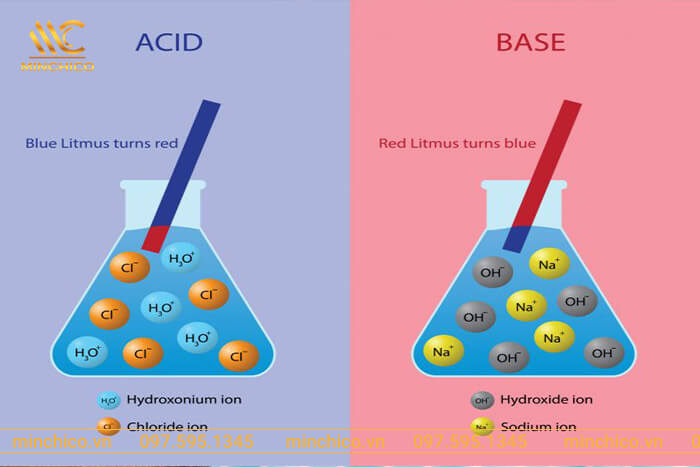
Trong dung dịch nước, hợp chất bị phân ly mạnh thành ion hydronium (H 3 O + ) và ion clorua (Cl – ). Trong dung dịch loãng, axit tan trong nước và phân li hoàn toàn. Như vậy, axit clohiđric (HCl) là một axit mạnh.
Phương trình phản ứng hóa học: HCl + H2O → H3O + Cl
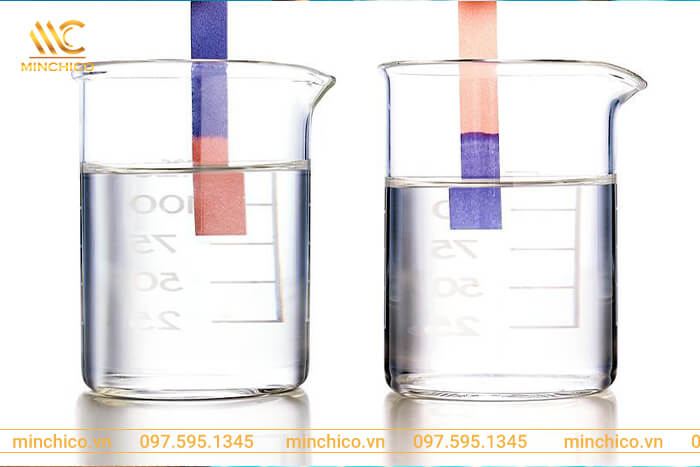
HCl làm quỳ tím chuyển màu gì?
Axit HCl làm quỳ tím chuyển sang màu đỏ. Tuy nhiên, phản ứng này chỉ xảy ra với HCl ở dạng dung dịch. Còn HCl dạng khí không làm đổi giấy quỳ tím sang màu đỏ.
Dung dịch HCL có khả năng làm giấy quỳ tím chuyển màu đỏ vì axit có khả năng cho ion H+. Và axit clohydric là một axit và có khả năng cung cấp cho các ion Hydro. Như vậy, quỳ tím chuyển sang màu đỏ.
Tính chất vật lý của HCl
Axit clohidric là một chất lỏng trong nước không màu, có mùi hắc khó chịu.
Tính chất hóa học của HCl
HCL là axit mạnh, vì thế nó mang đầy đủ các tính chất hóa học của một axit:
- Phản ứng với kim loại, trong đó khí Hydro bị dịch chuyển
- Phản ứng với oxit bazơ (kim loại) và hidroxit trung hòa tạo thành clorua kim loại và nước
- Phản ứng với muối của axit yếu, trong đó axit yếu bị thay thế.
- Tham gia vào phản ứng hóa học đặc trưng của ion clorua. Ví dụ như phản ứng với nhiều vô cơ và hữu cơ hợp chất. Trong đó axit clohydric được sử dụng như một chất khử clo.
Axit HCl ăn mòn mắt, da và màng nhầy. Nếu bị phơi nhiễm cấp tính (phơi nhiễm ngắn hạn) có thể gây kích ứng mặt, mũi, đường hô hấp, viêm và phù phổi ở con người. Nếu tiếp xúc qua đường miệng dễ dẫn đến ăn mòn màng nhầy, thực quản, dạ dày, gây bỏng nặng, lở loét. Tiếp xúc với Axit HCl lâu dài có thể gây viêm dạ dày, viêm phế quản, viêm da.

Những chất tác dụng được với HCl
Kim loại tác dụng với HCl
Axit HCl có thể tác dụng được với hầu hết kim loại (đặc biệt là những kim loại gần bên trái của bảng tuần hoàn, đứng trước hidro ) để giải phóng khí Hidro và tạo muối Clorua.
HCl phản ứng với kim loại kiềm: Ví dụ: Hai phân tử axit clohidric và hai nguyên tử natri kim loại sẽ phản ứng để tạo ra hai phân tử natri clorua (muối ăn) và một phân tử khí hydro.
Phương trình phản ứng hóa học: Na + 2HCl → NaCl + H2
HCl phản ứng với kim loại kiềm thổ tạo thành clorua và hydro. Ví dụ Magie kim loại (Mg) khi kết hợp với axit clohidric, tự nhiên sẽ tạo ra magie clorua – được sử dụng như một chất bổ sung trong chế độ ăn uống – với hidro được giải phóng dưới dạng khí.
Phương trình phản ứng hóa học: Mg + HCl → MgCl2 + H2
Ngoài ra, HCl cũng sẽ phản ứng với sắt, cadimi, coban, niken, thiếc và chì. Khi cho HCl tác dụng với F2, sắt sẽ phản ứng với hidro clorua để tạo ra clorua sắt, FeCl2 – đôi khi được gọi là clorua đen. FeCl2 ứng dụng trong xử lý nước thải, loại bỏ các hạt lơ lửng có trong nước.
Phương trình phản ứng hóa học: Fe + 2HCl → FeCl2 + H2
Oxit kim loại tác dụng với HCl
Oxit kim loại là hợp chất có chứa một kim loại và 1 hoặc nhiều nguyên tử O2. Axit HCl tác dụng với Oxit kim loại tạo thành muối và nước.
Một số phương trình phản ứng hóa học:
- Na2O + 2HCl → 2NaCl + H2O
- MgO + 2HCl → MgCl2 + H2O
- V2O5 + 10HCl → 2VCl + 4Cl2 + 5H2O
- AgO + 2HCl → AgCl2 + H2O
Oxit Bazơ tác dụng với HCl
Axit HCl tác dụng với Oxit Bazơ để tạo thành muối và nước.
Phản ứng hóa học điển hình:
- NaOH + HCl → NaCl + H2O
- Ca(OH)2 + 2HCl → 2H2O + CaCl2
- Cu(OH)2 + 2HCl → CuCl2 + H2O
- Fe(OH)3 + 3HCl → FeCl3 + 3H2O
- Ba(OH)2 + 2HCl → BaCl2 + 2H2O
Muối tác dụng với HCl
Muối là hợp chất khi tan trong nước có khả năng phân li ra cation kim loại (hoặc cation NH4+) và anion gốc axit. Muối tác dụng với HCl tạo ra muối mới và axit mới. Sản phẩm tạo ra sẽ có chất khí bay lên hoặc kết tủa.
Một số phương trình phản ứng hóa học:
- 2NaCl + 2HCl → 2NaCl2 + H2
- Na2SO4 + 2HCl → 2NaCl + H2SO4
- NaHCO3 + HCl → NaCl + CO2+ H2O
- K2SO4 + 2HCl → 2KCl + H2SO4
HCl không tác dụng với chất nào?
- Dung dịch Axit HCl không tác dụng với một số kim loại đứng sau Hidro trong bảng tuần hoàn. Ví dụ như: Đồng (Cu), thủy ngân (Hg), bạc (Ag), vàng (Au), Platin (Pt).
- Dung dịch axit HCl không tác dụng với các hợp chất muối không tan có gốc CO3, PO4 (Ngoại trừ K2CO3 và Na2CO3,K3PO4 và Na3PO4).
- HCl (Axit clohidric) không tác dụng được với tất cả các axit.
- HCl (Axit clohidric) không tác dụng với phi kim.
- HCl (Axit clohidric) không tác dụng được với một số oxit kim loại.
- HCl (Axit clohidric) không tác dụng với oxit phi kim.
Tại Minchico, chúng tôi không chỉ thiết kế thi công hồ bơi tốt nhất. Mà còn xây dựng chất lượng cao, giá trị cao, độc quyền, hạnh phúc, tiện lợi, đáng tin cậy, an toàn và yên tâm.
Vậy bạn đã sẵn sàng sở hữu bể bơi chất lượng tốt nhất, sang trọng nhất, không bao giờ phải lo lắng vấn đề rò rỉ, sai sót hay phải sửa chữa liên tục chưa? Hãy liên hệ ngay với Minchico nhé!
Ứng dụng của axit HCl
Axit HCl được ứng dụng trong nhiều lĩnh vực khác nhau:
- Dùng để sản xuất Clorua, phân bón và thuốc nhuộm, mạ điện
- Ứng dụng trong ngành công nghiệp nhiếp ảnh, dệt may và cao su.
- Dùng để trung hòa các tác nhân kiềm, có vai trò như một chất tẩy trắng
- Dùng để sản xuất chất tẩy rửa gia dụng, làm sạch các vết bẩn khó rửa. Ngoài ra còn được ứng dụng trong sản xuất chất tẩy rửa bồn cầu, gạch phòng tắm, rửa sứ.
- Ứng dụng trong ngành công nghiệp chế biến thực phẩm. Chẳng hạn như bánh quy giòn, ngũ cốc, nước sốt cà chua. Đồng thời sử dụng như một chất axit hóa để tăng hương vị và giảm hư hỏng trong: Nước sốt; Nước ép rau củ; Đồ hộp
- Sản xuất hóa chất khử trùng, diệt mối mọt
- HCl còn được ứng dụng để vệ sinh hồ bơi. Giúp cân bằng độ pH và duy trì nồng độ hóa chất trong hồ bơi ở mức cân bằng, an toàn với người sử dụng cũng như thiết bị máy móc.

Dịch vụ xử lý nước hồ bơi chuyên nghiệp, công nghệ hiện đại
Tóm lại
HCl làm quỳ tím chuyển màu gì? Khi nhúng quỳ tím vào dung dịch axit mạnh HCL, giấy quỳ sẽ chuyển sang màu đỏ. Dựa vào những đặc tính vật lý và hóa học của mình, hợp chất này được ứng dụng rộng rãi trong đời sống, sản xuất công nghiệp. Ngoài ra, dung dịch HCl còn là hóa chất quan trọng để vệ sinh, làm sạch hồ bơi, bồn sục. Song chỉ được khống chế ở một liều lượng nhất định để không làm tổn hại đến người bơi và thiết bị máy móc.
Từ khóa » Nhúng Giấy Quỳ Tím Vào Dung Dịch Hcl Quỳ Tím Hóa
-
Nhúng Giấy Quỳ Tím Vào Dung Dịch HCl, Quỳ Tím A. Hóa đỏ - Khóa Học
-
Nhúng Quỳ Tím Vào Dung Dịch HCl Thu được Hiện Tượng Là:
-
Nhúng Giấy Quỳ Tím Vào Dung Dịch HCl, Quỳ Tím A. Hóa đỏ...
-
Nhúng Giấy Quỳ Tím Vào Dung Dịch HCl, Quỳ Tím - Hoc247
-
Nhúng Giấy Quỳ Tím Vào Dung Dịch HCl, Quỳ Tím Chuyển Thành Màu Gì?
-
HCl Làm Quỳ Tím Chuyển Màu Gì? - Toploigiai
-
Nhúng Giấy Quỳ Tím Vào Dung Dịch HCl, Quỳ Tím - Đọc Tài Liệu
-
Nhúng Giấy Quỳ Tím Vào Dung Dịch HCl, Quỳ Tím
-
Nhúng Giấy Quỳ Tím Vào Dung Dịch HCl, Quỳ Tím
-
[LỜI GIẢI] Nhúng Quỳ Tím Vào Dung Dịch HCl Thu được Hiện Tượng Là
-
Nhúng Giấy Quỳ Tím Vào Dung Dịch HCl, Quỳ Tím
-
Nhúng Giấy Quỳ Tím Vào Dung Dịch HCl, Quỳ Tím A. Hóa đỏ
-
HCl Làm Quỳ Tím Chuyển Màu Gì? HCl Là Axit Mạnh Hay Yếu? - Bilico
-
Nhúng Giấy Quỳ Tím Vào Dung Dịch HCl, Quỳ Tím