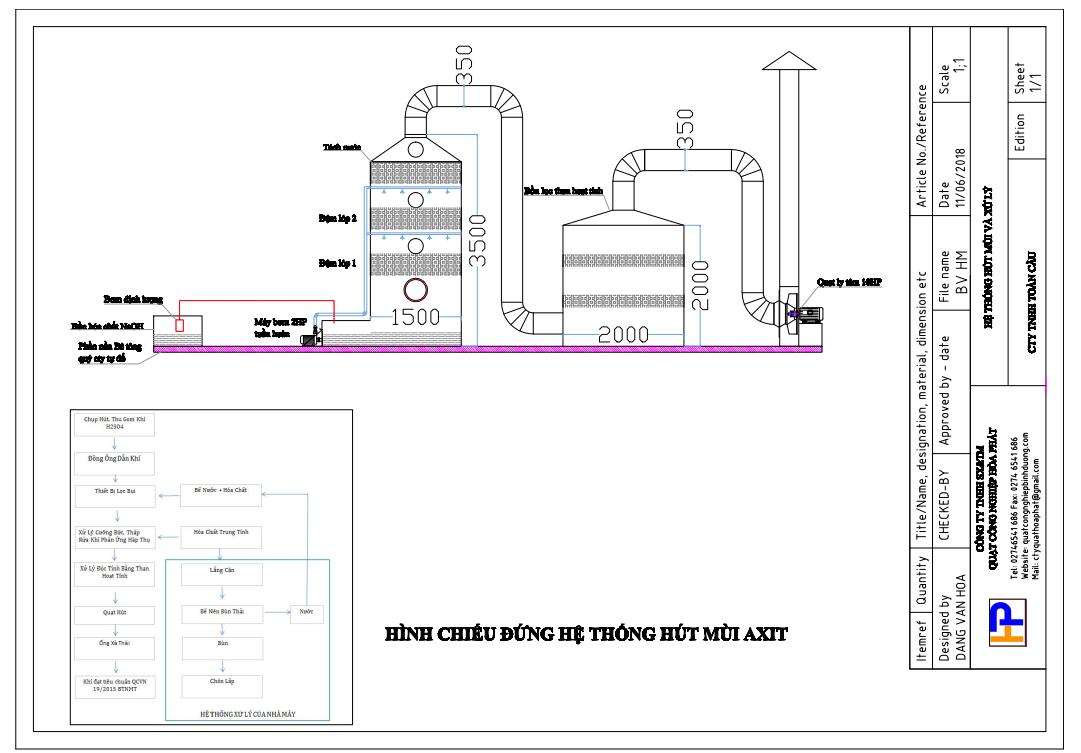
Hệ Thống Hút Hơi Axit Và Xử Lý Hơi Axit H2SO4
Có thể bạn quan tâm
Thiết kế hệ thống hút hơi axit và xử lý hơi axit H2SO4,
Cho nhà máy Công Ty HỮu Hạn Cơ Khí Động Lực Toàn Cầu
Đc: Khu công nghiệp Giang Dien, Trảng Bom, Dong Nai. Trong quá trình tẩy rửa các sản phẩm bị lỗi thì sử dụng Axit H2SO4 đun nóng để tẩy, trong quá trình nhúng tẩy hàng hóa bị lỗi, xi mạ sinh ra hơi rất độc hại
1.1. Phương pháp hóa học
1.1.1. Phương pháp trung hòa
Nước thải sản xuất của nhiều ngành công nghiệp có thể chứa axit hoặc kiềm. Để ngăn ngừa hiện tượng xâm thực và để tránh cho quá trình sinh hóa ở các công trình làm sạch và nguồn nước không bị phá hoại, ta cần phải trung hòa nước thải. Trung hòa còn nhằm mục đích tách loại một số ion kim loại nặng ra khỏi nước thải. Mặt khác muốn nước thải được xử lý tốt bằng phương pháp sinh học phải tiến hành trung hòa và điều chỉnh pH về 6.6 -7.6
Trung hòa bằng cách dùng các dung dịch axit hoặc muối axit, các dung dịch kiềm hoặc oxit kiềm để trung hòa dịch nước thải.
Một số hóa chất dùng để trung hòa: CaCO3, CaO, Ca(OH)2, MgO, Mg(OH)2,
CaO 0.6MgO 0.4,(Ca(OH)2)0.6(Mg(OH)2)0.4, NaOH, Na2CO3, H2SO4, HCl, HNO3,…
Ngoài ra, có thể tận dụng nước thải có tính acid trung hòa nước thải có tính kiềm hoặc ngược lại. Ví dụ như trong dây chuyền công nghệ sản xuất xi mạ, do có 2 công đoạn: làm sạch bề mặt nguyên liệu cần mạ (đây là công đoạn tạo ra nước thải có tính kiềm mạnh) và công đọan tẩy rỉ kim loại (công đoạn này lại tạo ra nước thải có tính acid mạnh). Ta có thể tận dụng 2 loại nước thải này để trung hòa lẫn nhau.
1.1.1.1. Trung hoà bằng trộn nước thải chứa axit và nước thải chứa kiềm.
Phương pháp này cho xử lý nước thải chứa axit hoặc chứa kiềm trong khu công nghiệp được tập trung lai để xử lý vì chế độ thải của các nhà máy không giống nhau. Nước thải chứa axit thường được thải một cách điều hoà ngày đêm và có nồng độ nhất định. Nước thải chứa kiềm lại thải theo chu kỳ, một hoặc hai lần trong một ca tuỳ thuộc vào chế độ công nghệ.
1.1.1.2. Trung hoà bằng cách cho thêm hoá chất vào nứơc thải.
Phương pháp này dùng để trung hoà nước thải có chứa axit. Người ta phân biệt ba loại nước thải có chứa axit như sau :
- Nước thải chứa axit yếu (H2CO3, CH3COOH).
- Nước thải chứa axit mạnh (HCl, HNO3), các muối canxi của chúng dễ tan trong nước.
- Nước thải chứa axit mạnh (H2SO4, H2CO3) các muối canxi của chúng khó tan trong nước.
Bản chất của phương pháp hóa học là đưa vào nước thải một hóa chất nào đó, hóa chất này phản ứng với các chất ô nhiễm trong nước thải để tạo thành cặn lắng, chất hòa tan, hay các sản phẩm không độc hại. Ví dụ phương pháp trung hòa phản ứng axít hay bazơ, phương pháp ô-xy hóa, kết tủa các kim loại…. là những phương pháp hóa học.
Bảng. Ứng dụng quá trình xử lý hóa học
| Quá trình | Ứng dụng |
| Trung hòa | Để trung hòa các nước thải có độ a-xít hoặc bazơ cao |
| Keo tụ | Loại bỏ phốt-pho và tăng hiệu quả lắng của các chất rắn lơ lửng trong các công trình lắng sơ cấp |
| Hấp phụ | Loại bỏ các chất hữu cơ không thể xử lý được bằng các phương pháp hóa học hay sinh học thông dụng. Cũng được dùng để khử clo của nước thải sau khi xử lý, trước khi thải vào môi trường |
| Khử trùng | Để loại bỏ các vi sinh vật gây bệnh. Các phương pháp thường sử dụng như chlorine, chlorine dioxide, bromide chlorine, ozone… |
| Khử chlor | Loại bỏ các hợp chất của chlorine còn sót lại sau quá trình khử trùng bằng chlor |
| Các quá trình khác | Nhiều lọai hóa chất được sử dụng để đạt được mục đích nhất định nào đó; ví dụ dùng hoá chất để kết tủa các kim loại nặng trong nước thải. |
(Nguồn: Metcalf & Eddy, 1991)
1.1.2. Phương pháp oxy hóa khử
Để làm sạch nước thải người ta có thể sử dụng các chất oxy hóa như clo ở dạng khí và hóa lỏng, dioxyt clo, clorat canxi, hypoclorit canxi và natri, pemanganat kali, bicromat kali, peoxythydro (H2O2), oxy của không khí, ozôn, pyroluzit (MnO2)...
Trong quá trình oxy hóa, các chất độc hại trong nước thải được chuyển thành các chất ít độc hơn và tách ra khỏi nước. Quá trình này tiêu tốn một lượng lớn các tác nhân hóa học, do đó quá trình oxy hóa hóa học chỉ được dùng trong những trường hợp khi các tạp chất gây nhiễm bẩn trong nước thải không thể tách bằng những phương pháp khác.
Các phương pháp oxy hóa và khử bao gồm:
- Oxy hóa bằng clo
- Oxy hóa bằng peoxyt hydro (H2O2)
- Oxy hóa bằng oxy trong không khí
- Oxy hóa bằng pyroluzit
- Làm sạch bằng khử
Oxy hóa bằng Clo
Clo và các chất có chứa Clo hoạt tính là những chất oxy hóa thông dụng nhất. Người ta sử dụng chúng để tách H2S, hydrosunfit, các hợp chất chứa metylsunfit, phenol, xyanua ra khỏi nước thải.
Khi cho Clo tác dụng với nước, xảy ra các phản ứng sau:
Cl2 + H2O = HOCl + HCl
HOCl H++OCl-
Tổng Clo, HOCl và OCl- được gọi là clo tự do hay clo hoạt tính.
Quá trình tách xyanua ra khỏi nước được tiến hành ở môi trường kiềm (pH = 9). Xyanua có thể bị oxy hóa tới nito và CO2 theo phương trình sau:
CN- + 2OH- + Cl2 CNO- + 2Cl- + H2O
2CNO- + 4OH- + 3Cl2 CO2 + 6Cl- + N2 + 2H2O
Các nguồn cung cấp clo có hoạt tính còn có thể là clorat canxi (CaOCl2), hypoclorit, clorat, dioxyl clo, clorat canxi được nhận theo pahn3 ứng sau:
Ca(OH)2 + Cl2 = CaOCl2 + H2O
Natri hypoclorit được tạo thành khi sục khí clo qua dung dịch kiềm:
2NaOH + Cl2 = NaClO + NaCl + H2O
Còn hypoclorit canxi được điều chế bằng clo hóa hydtoxyt canxi ở nhiệt độ 25 – 30oC:
2Ca(OH)2 + 2Cl2 = Ca(ClO)2 + CaCl2 + 2H2O
Trong đó natriclorat (NaClO3) là chất oxy hóa mạnh nên phân tách thành ClO2. Dioxyt clo là khí độc có màu vàng xanh, có mùi mạnh hơn clo.
1.1.2.1. Oxy hóa bằng oxi trong không khí
Oxy trong không khí được sử dụng để tách sắt ra khỏi nước theo phản ứng sau:
4 Fe2+ + O2 + 2H2O 4 Fe3+ + 4OH-
Fe3+ + 3H2O = Fe(OH)3 + 3H+
Quá trình oxy hóa được tiên hành bằng sự thông gió qua nước trong các tháp phun mưa.
Oxy của không khí còn được sử dụng để oxy hóa sunfua trong nước thải cùa các nhà máy giấy, chế biến dầu mỏ. Quá trình oxy hóa hydrosunfua thành sufua lưu huỳnh diễn ra qua các giai đoạn thay đổi hóa trị của lưu huỳnh từ -2 đến +6
1.1.2.2. Ozon hóa
Oxy hóa bằng ozon cho phép đồng thời khử tạp chất nhiễm bẩn, khử màu, khử các vị lạ và mùi đối với nước.
Tác động của ozon trong quá trình oxy hóa có thể diễn ra theo ba hướng:
+ Oxy hóa trực tiếp với sự tham gia của một nguyên tử oxy
+ Kết hợp toàn bộ phân tử ozon với chất bị oxy hóa thành ozonua
+ Tăng cường xúc tác của tác động oxy hóa trong không khí bị ozon hóa.
1.1.3. Khử trùng nước thải
Sau khi xử lý sinh học, phần lớn các vi khuẩn trong nước thải bị tiêu diệt. Khi xử lý trong các công trình sinh học nhân tạo (Aerophin hay Aerotank ) số lượng vi khuẩn giảm xuống còn 5%, trong hồ sinh vật hoặc cánh đồng lọc còn 1-2%. Nhưng để tiêu diệt toàn bộ vi khuẩn gây bệnh, nước thải cần phải khử trùng Chlor hoá, Ozon hoá, điện phân, tia cực tím .
Phương pháp phổ biến nhất hiện nay là phương pháp Chlor hoá
Chlor cho vào nước thải dưới dạng hơi hoặc Clorua vôi. Lượng Clor hoạt tính cần thiết cho một đơn vị thể tích nước thải là: 10 g/m3 đối với nước thải sau xử lý cơ học; 5 g/m3 sau xử lý sinh học hoàn toàn. Clor phải được trộn đều với nước và để đảm bảo hiệu quả khử trùng, thời gian tiếp xúc giữa nước và hoá chất là 30 phút trước khi nước thải ra nguồn. Hệ thống Clor hoá nước thải Clor hơi bao gồm thiết bị Clorato, máng trộn và bể tiếp xúc. Clorato phục vụ cho mục đích chuyển Clor hơi thành dung dịch Clor trước khi hoà trộn với nước thải và được chia thành 2 nhóm: nhóm chân không và nhóm áp lực. Clor hơi được vận chuyển về trạm xử lý nước thải dưới dạng hơi nén trong banlon chịu áp. Trong trạm xử lý cần phải có kho cất giữ các banlon này. Phương pháp dùng Clor hơi ít được dùng phổ biến.
Phương pháp Clor hoá nước thải bằng Clorua vôi
Áp dụng cho trạm nước thải có công suất dưới 1.000 m3/ngđ. Các công trình và thiết bị dùng trong dây chuyền này là các thùng hoà trộn, chuẩn bị dung dịch Clorua vôi, thiết bị định lượng máng trộn và bể tiếp xúc. Với Clorua vôi được hoà trộn sơ bộ tại thùng hoà trộn cho đến dung dịch 10 -15% sau đó chuyển qua thùng dung dịch. Bơm định lượng sẽ đưa dung dịch Clorua vôi với liều lượng nhất định đi hoà trộn vào nước thải. Trong các thùng trộn dung dịch, Clorua vôi được khuấy trộn với nước cấp bằng các cánh khuấy gắn với trục động cơ điện.
Phương pháp Ozon hoá
Ozon hoá tác động mạnh mẽ với các chất khoáng và chất hữu cơ, oxy hoá bằng Ozon cho phép đồng thời khử màu, khử mùi, tiệt trùng của nước. Bằng Ozon hoá có thể xử lý phenol, sản phẩm dầu mỏ, H2S, các hợp chất Asen, thuốc nhuộm … Sau quá trình Ozon hoá số lượng vi khuẩn bị tiêu diệt đến hơn 99%. Ngoài ra Ozon còn oxy hoá các hợp chất Nito, Photpho … Nhược điểm chính của phương pháp này là giá thành cao và thường được ứng dụng rộng rãi trong xử lý nước cấp.
Ưu, nhược điểm của phương pháp hóa học
Ưu điểm:
+ Nguyên liệu các hoá chất dễ kiếm
+ Dễ sử dụng và quản lý
+ Không gian xử lý nhỏ
Nhược điểm:
+ Chi phí hoá chất cao
+ Có khả năng tạo ra một số chất ô nhiễm thứ cấp.
Từ khóa » Cách Khử Axit
-
Khử Axit Trong Nước Mưa? - Tuổi Trẻ Online
-
Hướng Dẫn Cách Xử Lý Axit Trong Nước Mưa - Hóa Chất Vũ Hoàng
-
Tác Hại Của Axit Trong Nước Mưa Và Cách Loại Bỏ
-
Khử Axit Tài Liệu - .vn
-
Cách Xử Trí Khi Bị Tạt Axit
-
Làm Thế Nào để Trung Hòa Axit, Bazơ Khi Xảy Ra Sự Cố Tràn Hóa Chất??
-
Xử Trí đúng Cách Khi Bị Dính Axit - VnExpress Sức Khỏe
-
Giúp Mình Khử Axit Vơiiiiiiiii [Lưu Trữ] - Diễn đàn Thế Giới Hoá Học
-
Mưa Axit Là Gì? Nguyên Nhân, Tác Hại Và Cách Khắc Phục ... - Lọc Nước
-
Cách Giảm Axit Trong Dạ Dày Tại Nhà Bằng Mẹo Và Ăn Uống
-
Các Phương Pháp Xử Lý Nước Thải Có Tính Axit Vừa Tiết Kiệm Vừa Hiệu ...
-
Xử Lí Sự Cố Axit Bị đổ Trên Mặt đường
-
Xử Lý Nước Có độ PH Thấp, Hàm Lượng Nước Axit Cao
-
Một Số Biện Pháp Xử Lý Dòng Thải Axit Trong Hoạt động Hoàn Thổ Phục ...