Hemoglobin – Wikipedia Tiếng Việt
Có thể bạn quan tâm
Nội dung
chuyển sang thanh bên ẩn- Đầu
- Bài viết
- Thảo luận
- Đọc
- Sửa đổi
- Sửa mã nguồn
- Xem lịch sử
- Đọc
- Sửa đổi
- Sửa mã nguồn
- Xem lịch sử
- Các liên kết đến đây
- Thay đổi liên quan
- Liên kết thường trực
- Thông tin trang
- Trích dẫn trang này
- Tạo URL rút gọn
- Tải mã QR
- Tạo một quyển sách
- Tải dưới dạng PDF
- Bản để in ra
- Wikimedia Commons
- Khoản mục Wikidata
| Hemoglobin | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| (Heterotetramer, (αβ)2) | |||||||||||||
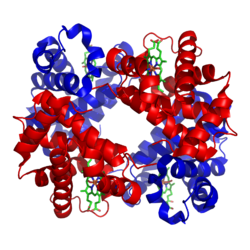 Cấu trúc của hemoglobin ở người. Globin subunit α và β lần lượt có màu đỏ và xanh lam, còn các nhóm hem chứa sắt có màu xanh lục. Từ PDB: 1GZX Bản mẫu:Proteopedia Cấu trúc của hemoglobin ở người. Globin subunit α và β lần lượt có màu đỏ và xanh lam, còn các nhóm hem chứa sắt có màu xanh lục. Từ PDB: 1GZX Bản mẫu:Proteopedia | |||||||||||||
| Loại protein | Metalloprotein, chromoprotein, globulin | ||||||||||||
| Chức năng | Vận chuyển oxy | ||||||||||||
| Cofactor(s) | Hem (4) | ||||||||||||
| |||||||||||||

Hemoglobin (còn gọi là huyết sắc tố, viết tắt Hb hay Hgb; công thức hóa học: C2952H4664N812O832S8Fe4[1]) là một protein chứa sắt có trong erythrocyte của hầu hết các loài động vật có xương sống (ngoại trừ họ cá Channichthyidae),[2][3] cũng như mô của một số động vật không xương sống. Hemoglobin trong máu có nhiệm vụ vận chuyển oxy từ các cơ quan hô hấp (phổi hoặc mang) đến các mô khác của cơ thể, nơi nó giải phóng oxy để tạo điều kiện cho quá trình hô hấp hiếu khí giúp tăng cường quá trình trao đổi chất của động vật. Một người khỏe mạnh có từ 12 đến 20 gam hemoglobin trong mỗi 100 mL máu. Hemoglobin là một metallicoprotein, là một chromoprotein cũng như là một globulin.
Ở động vật có vú, hemoglobin chiếm khoảng 96% trọng lượng khô của hồng cầu (không bao gồm nước) và khoảng 35% tổng trọng lượng (bao gồm cả nước).[4]
Các loại hemoglobin
[sửa | sửa mã nguồn]Tùy theo sự kết hợp các loại chuỗi globin, có các loại hemoglobin khác nhau:
- Hemoglobin A (HbA) được tạo thành từ 2 chuỗi alpha (α) và 2 chuỗi beta (β), ký hiệu là α2β2.[5] Đây là hemoglobin tetramer phổ biến nhất ở người, chiếm hơn 97% tổng lượng hemoglobin hồng cầu.[6]
- Hemoglobin A2 (HbA2) là một biến thể bình thường của hemoglobin A bao gồm 2 chuỗi alpha và 2 chuỗi delta (δ) (α2δ2), chiếm tỷ lệ 2–3,5%.
- Hemoglobin F (còn gọi hemoglobin bào thai vì nó chiếm tỷ lệ rất cao ở giai đoạn cuối của thai nhi và sơ sinh), có cấu tạo gồm 2 chuỗi alpha và 2 chuỗi gamma (γ) (α2γ2).
Một số hemoglobin ở thời kỳ phôi và thời kỳ đầu của bào thai.
- Hemoglobin Gower I (ζ2ε2 hay HbE Gower-1) gồm 2 chuỗi zeta và 2 chuỗi epsilon, tương đối không ổn định, dễ bị phá vỡ.[7]
- Hemoglobin Gower II (α2ε2 hay HbE Gower-2) gồm 2 chuỗi alpha và 2 chuỗi epsilon. Hemoglobin Gower II có phần không ổn định, mặc dù không nhiều như hemoglobin Gower 1.[7]
- Hemoglobin Porland I (ζ2γ2 hay HbE Portland-1) tồn tại ở ngưỡng thấp trong thời kỳ phôi thai và bào thai, gồm 2 chuỗi zeta và 2 chuỗi gamma.[7]
- Hemoglobin Portland II (ζ2β2 hay HbE Portland-2) tồn tại ở ngưỡng thấp trong thời kỳ phôi thai và bào thai, gồm 2 chuỗi zeta và 2 chuỗi beta. Là một hemoglobin không ổn định, thậm chí còn không ổn định bằng hemoglobin Gower 1, hemoglobin Portland II bị phân hủy rất nhanh khi bị stress.[7]
Tham khảo
[sửa | sửa mã nguồn]- ^ "What is the molecular formula of haemoglobin class 11 chemistry CBSE". www.vedantu.com. Truy cập ngày 23 tháng 10 năm 2022.
- ^ Maton, Anthea; Jean Hopkins; Charles William McLaughlin; Susan Johnson; Maryanna Quon Warner; David LaHart; Jill D. Wright (1993). Human Biology and Health. Englewood Cliffs, New Jersey, US: Prentice Hall. ISBN 978-0-13-981176-0.
- ^ Sidell, Bruce; Kristin O'Brien (2006). "When bad things happen to good fish: the loss of hemoglobin and myoglobin expression in Antarctic icefishes". The Journal of Experimental Biology. Quyển 209 số Pt 10. tr. 1791–802. doi:10.1242/jeb.02091. PMID 16651546.
- ^ Weed, Robert I.; Reed, Claude F.; Berg, George (1963). "Is hemoglobin an essential structural component of human erythrocyte membranes?". J Clin Invest. Quyển 42 số 4. tr. 581–88. doi:10.1172/JCI104747. PMC 289318. PMID 13999462.
- ^ Immigrant medicine. Walker, Patricia Frye., Barnett, Elizabeth D. (Elizabeth Day). St. Louis, Mo.: Elsevier Mosby. 2007. ISBN 9780323034548. OCLC 489070888.{{Chú thích sách}}: Quản lý CS1: khác (liên kết)
- ^ "Hemoglobinopathies". Truy cập ngày 6 tháng 2 năm 2009.
- ^ a b c d He Z, Russell JE (tháng 2 năm 2001). "Expression, purification, and characterization of human hemoglobins Gower-1 (zeta(2)epsilon(2)), Gower-2 (alpha(2)epsilon(2)), and Portland-2 (zeta(2)beta(2)) assembled in complex transgenic-knockout mice". Blood. Quyển 97 số 4. tr. 1099–1105. doi:10.1182/blood.V97.4.1099. PMID 11159543.
Đọc thêm
[sửa | sửa mã nguồn]| Thư viện tài nguyên ngoại văn về Hemoglobin |
|
- Campbell, MK (1999). Biochemistry . Harcourt. ISBN 978-0-03-024426-1.
- Eshaghian, S; Horwich, TB; Fonarow, GC (2006). "An unexpected inverse relationship between HbA1c levels and mortality in patients with diabetes and advanced systolic heart failure". Am Heart J. Quyển 151 số 1. tr. 91.e1–91.e6. doi:10.1016/j.ahj.2005.10.008. PMID 16368297.
- Ganong, WF (2003). Review of Medical Physiology (ấn bản thứ 21). Lange. ISBN 978-0-07-140236-1.
- Hager, T (1995). Force of Nature: The Life of Linus Pauling. Simon and Schuster. ISBN 978-0-684-80909-0.
- Hazelwood, Loren (2001) Can't Live Without It: The story of hemoglobin in sickness and in health, Nova Science Publishers ISBN 1-56072-907-4
- Kneipp J, Balakrishnan G, Chen R, Shen TJ, Sahu SC, Ho NT, Giovannelli JL, Simplaceanu V, Ho C, Spiro T (2005). "Dynamics of allostery in hemoglobin: roles of the penultimate tyrosine H bonds". J Mol Biol. Quyển 356 số 2. tr. 335–53. doi:10.1016/j.jmb.2005.11.006. PMID 16368110.
- Hardison, Ross C. (2012). "Evolution of Hemoglobin and Its Genes". Cold Spring Harbor Perspectives in Medicine. Quyển 2 số 12. tr. a011627. doi:10.1101/cshperspect.a011627. ISSN 2157-1422. PMC 3543078. PMID 23209182.
Liên kết ngoài
[sửa | sửa mã nguồn]- National Anemia Action Council at anemia.org
- New hemoglobin type causes mock diagnosis with pulse oxymeters Lưu trữ ngày 9 tháng 3 năm 2016 tại Wayback Machine at www.life-of-science.net Lưu trữ ngày 7 tháng 3 năm 2017 tại Wayback Machine
- Animation of hemoglobin: from deoxy to oxy form at vimeo.com
| Cơ sở dữ liệu tiêu đề chuẩn | |
|---|---|
| Quốc tế |
|
| Quốc gia |
|
| Khác |
|
- Protein heteropolymers
- Sinh lý hô hấp
- Cân bằng hóa học
- Quản lý CS1: khác
- Bản mẫu webarchive dùng liên kết wayback
- Taxonbars without from parameter
- Trang thẻ đơn vị phân loại không có ID đơn vị phân loại tại Wikidata
- Thẻ đơn vị phân loại trên trang có thể không là đơn vị phân loại
Từ khóa » Các Loại Hemoglobin Bình Thường
-
Điện Di Huyết Sắc Tố Là Gì? | Vinmec
-
Các Loại Hemoglobin Và ý Nghĩa Trong Cơ Thể
-
Hemogolobin Và Các Bệnh Liên Quan - GENTIS
-
XÉT NGHIỆM ĐIỆN DI HUYẾT SẮC TỐ-HEMOGLOBIN
-
Điện Di Hemoglobin - Hello Bacsi
-
Xét Nghiệm điện Di Huyết Sắc Tố Giúp Xác định Hemoglobin Bất Thường
-
Chỉ Số HgB Và Tình Trạng Cơ Thể Mà Nó Biểu Hiện | Medlatec
-
Hemoglobin Là Gì? Những Chỉ Số Hemoglobin Cảnh Báo Vấn đề Gì?
-
[PDF] HUYẾT SẮC TỐ E (Hemoglobin E Trait - Vietnamese)
-
Đánh Giá Thiếu Máu - Huyết Học Và Ung Thư Học - MSD Manuals
-
Bệnh Hồng Cầu Liềm - Huyết Học Và Ung Thư Học - Cẩm Nang MSD
-
Hemoglobin Là Gì? Khi Nào Bạn Nên Xét Nghiệm - Bệnh Viện Thu Cúc
-
[PDF] THALASSEMIA VÀ BỆNH HEMOGLOBIN