Hiện Tượng Khi Cho Viên Kẽm (Zn) Vào Dung Dịch Axit Clohiđric (HCl) Là
Có thể bạn quan tâm
Tạo tài khoản Doctailieu
Để sử dụng đầy đủ tính năng và tham gia cộng đồng của chúng tôi Tạo tài khoảnTạo tài khoản với Facebook Google AppleKhi bấm tạo tài khoản bạn đã đồng ý với quy định của tòa soạnLấy lại mật khẩuNhập Email của bạn để lấy lại mật khẩu Lấy lại mật khẩu Trang chủ Trắc nghiệm Lớp 8Trắc nghiệm môn Hóa học Lớp 8
Hướng dẫn trả lời câu hỏi Hiện tượng khi cho viên kẽm vào dung dịch axit clohiđric (Zn + HCl) là gì ? ... nằm trong bộ đề Trắc nghiệm Hóa 8 bài 33: Điều chế hidro - phản ứng thế
Câu Hỏi Và Trả lời
CÂU HỎIHiện tượng khi cho viên kẽm vào dung dịch axit clohiđric (Zn + HCl) là gì ?TRẢ LỜI
Hiện tượng khi cho viên kẽm vào dung dịch axit clohiđric (Zn + HCl) là viên kẽm tan dần, có khí không màu thoát ra.Giải thích:
Ta có phương trình hóa học của phản ứng khi cho viên kẽm (Zn) tác dụng với dung dịch axit clohiđric (HCl) là:
Zn + 2HCl → ZnCl2 + H2↑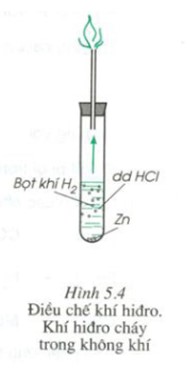 Câu hỏi trong đề: Trắc nghiệm Hóa 8 bài 33: Điều chế hidro - phản ứng thếCâu hỏi liên quan Cho hỗn hợp X gồm Fe và Cu, tác dụng với O2, thu được m gam chất rắn Y. Cho Y tác dụng với 200 ml dung dịch HNO3 4M, thu được 2,24 lít khí NO (sản phẩm khử duy nhất) và 11 gam chất rắn Z. Cho Z tác dụng với dung dịch HCl, thu được khí H2. Giá trị của m là
Câu hỏi trong đề: Trắc nghiệm Hóa 8 bài 33: Điều chế hidro - phản ứng thếCâu hỏi liên quan Cho hỗn hợp X gồm Fe và Cu, tác dụng với O2, thu được m gam chất rắn Y. Cho Y tác dụng với 200 ml dung dịch HNO3 4M, thu được 2,24 lít khí NO (sản phẩm khử duy nhất) và 11 gam chất rắn Z. Cho Z tác dụng với dung dịch HCl, thu được khí H2. Giá trị của m là
Giá trị của m là 33,8g. nHNO3 = 0,8; nNO = 0,1 nH+ = 4nNO + 2nO → nO = 0,2 Z + HCl tạo H2 nên Z chứa Cu, Fe dư → Y + HNO3 chỉ tạo muối Fe(NO3)2. Bảo toàn N → nFe(NO3)2 = (0,8 – 0,1)/2 = 0,35 → mY = 0,35.56 + 11 + 0,2.16 = 33,8 gam. Oxi hóa hoàn toàn 11,5 gam hỗn hợp X (gồm Mg, Al và Zn) bằng O2, thu được 17,1 gam hợp Y gồm các oxit. Để hòa tan hết Y cần vừa đủ V ml dung dịch HCl 2M. Giá trị của V là:
Để hòa tan hết Y cần vừa đủ 350ml dung dịch HCl 2M. Cho 2,82 gam hỗn hợp X gồm Al và Al2O3 tác dụng vừa đủ với 180 ml dung dịch HCl 1M thu được V lít khí H2. Giá trị của V là
Đặt nAl = a; nAl2O3 = b → 27a + 102b = 2,82 nHCl = 3a + 6b = 0,18 → a = 0,01; b = 0,025 nH2 = 1,5a = 0,015 → V = 0,336 lít ${B}{a} + {2}{H}{C}{l} → {B}{a}{C}{l}_{2} + {H}_{2}$ Để thu được dung dịch chứa 4,16 g ${B}{a}{C}{l}_{2}$ cần bao nhiêu mol HCl
Ba + 2HCl → BaCl2 + H2. Để thu được dung dịch chứa 4,16 g BaCl2 cần 0,04 mol HCl. Đáp án A Giải thích ${n}_{{{B}{a}{C}{l}_{2}}} = {4},{16}/{208} = {0},{02} {m}{o}{l} {B}{a} + {2}{H}{C}{l} → {B}{a}{C}{l}_{2} + {H}_{2} {0},{04} ← {0},{02} {m}{o}{l}$ Cho 8,934 gam hỗn hợp chất rắn X gồm Fe, Fe3O4 và Fe(NO3)2 vào dung dịch chứa 0,36 mol HCl và 0,03 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y (không chứa NH4+) và 0,045 mol hỗn hợp khí Z gồm NO và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, sau phản ứng thấy thoát .....
Thêm AgNO3 vào Y thấy xuất hiện khí NO chứng tỏ Y chứa Fe2+, H+ dư và không có NO3-. nAgCl = 0,36 → nAg = 0,015 Bảo toàn electron: nFe2+ = 3nNO + nAg = 0,06 nH+ dư = 4nNO = 0,06 Dung dịch Y chứa Fe2+ (0,06), H+ dư (0,06), Cl- (0,36), bảo toàn điện tích → nFe3+ = 0,06 Hỗn hợp X gồm etylamin và đimetylamin. Đốt cháy hoàn toàn m gam X bằng O2, cần vừa đủ V lít O2. Mặt khác, cho m gam X phản ứng với dung dịch HCl vừa đủ, thu được 24,45 gam muối. Giá trị của V là
nC2H7N = nC2H8NCl = 0,3 —> nO2 = 0,3.3,75 = 1,125 —> V = 25,2 lít Hợp chất nào sau đây tác dụng với dung dịch HCl tạo ra FeCl3?
Fe2(SO4)3 và HCl không phản ứng với nhau vì sản phẩm không có chất kết tủa , bay hơi, hay chất điện li yếu. Các phương trình phản ứng còn lại xảy ra như sau: Cho m gam hỗn hợp X gồm 2 amin, no, mạch hở phản ứng vừa đủ với 200ml dung dịch HCl 1M thu được 14,90 gam muối. Giá trị của m là
nHCl = 0,2, bảo toàn khối lượng: mX = m muối – mHCl = 7,6 gam Cho 9,97 gam hỗn hợp X gồm lysin và alanin tác dụng vừa đủ với dung dịch NaOH thu được 11,73 gam muối. Mặt khác 9,97 gam hỗn hợp X trên tác dụng với dung dịch HCl dư thu được dung dịch Y. Cô cạn dung dịch Y được m gam muối khan. Giá trị của m là:
Đặt a, b là số mol Ala, Lys mX = 89a + 146b = 9,97 nX = a + b = (11,73 – 9,97)/22 → a = 0,03; b = 0,05 nHCl = nN = a + 2b = 0,13 → m muối = mX + mHCl = 14,715 gam Hòa tan hoàn toàn 4,32 gam hỗn hợp X gồm FeO, MgO và ZnO bằng một lượng vừa đủ 150 ml dung dịch HCl 1M, thu được dung dịch chứa m gam muối. Giá trị của m là
nHCl = 0,15 → nH2O = 0,075 Bảo toàn khối lượng → m muối = 8,445 gam Báo đáp án sai Facebook twitter
các câu hỏi khác

Trắc nghiệm Hóa 8 bài 33: Điều chế hidro - phản ứng thế

Trắc nghiệm Hóa 8 bài 32: Phản ứng oxi hoá - khử

Trắc nghiệm Hóa 8 bài 31: Tính chất - ứng dụng của hidro

Trắc nghiệm Hóa 8 bài 29: Bài luyện tập 5

Trắc nghiệm Hóa 8 bài 28: Không khí - sự cháy

Trắc nghiệm Hóa 8 bài 27: Điều chế oxi - Phản ứng phân huỷ
Mới cập nhật
XChúc mừng!!!Đáp án bạn đưa ra hoàn toàn chính xác!Xem đáp án×Từ khóa » Khi Cho Kẽm Tác Dụng Với Axit Clohidric
-
Khi Cho Kẽm Tác Dụng Với Axit Clohiđric Thì Khối Lượng Của ... - Hoc24
-
Viết PTHH Khi Cho Kẽm Tác Dụng Với Axit Clohidric?
-
A) Cho Kẽm Tác Dụng Với Dung Dịch Axit Clohiđric HCL. B) Dẫn
-
Cho Kẽm Tác Dụng Với Axit Clohiđric (HCl) Thu được Kẽm Clorua ...
-
Hiện Tượng Khi Cho Viên Kẽm (Zn) Vào Dung Dịch Axit Clohiđric (HCl) Là
-
Hiện Tượng Khi Cho Viên Kẽm (Zn) Vào Dung Dịch Axit Clohiđric (HCl) Là
-
Kẽm Tác Dụng Với Dung Dịch Axit Clohidric HCl Theo Sơ đồ Phản ứng
-
Cho 5,2g Kẽm Tác Dụng Với 5,84g Axit Clohidric HCl, Sau Phản ứng ...
-
Kẽm Tác Dụng Với Dung Dịch Axit Clohiđric Sinh Ra - TopLoigiai
-
Cho Kẽm Tác Dụng Với Axit Clohidric Zn+HCl —> ZnCl2+H2 A ) Lập ...
-
Cho 13 Gam Kim Loại Kẽm Tác Dụng Với Axit Sunfuric | HoiCay
-
Cho Kim Loại Kẽm Tác Dụng Với Axit Clohidric Thu được 4,48 Lít Khí ...