Hô Hấp Sáng – Wikipedia Tiếng Việt
Có thể bạn quan tâm
Hô hấp sáng, quang hô hấp hay hô hấp ánh sáng là một quá trình hô hấp xảy ra ở thực vật trong điều kiện có nhiều ánh sáng nhưng ít CO2. Trong quá trình này, đường RuBP bị oxy hóa bởi enzyme RuBisCO - thay vì nhận phân tử carbonic như trong chu trình Calvin của quá trình quang hợp. Hô hấp sáng được đánh giá là tác nhân làm giảm đáng kể hiệu suất quang hợp của các thực vật C3, cho dù một số nghiên cứu cho thấy quá trình hô hấp sáng có một số vai trò tích cực đối với thực vật.
Ở các thực vật C4 và thực vật CAM, chức năng oxy hóa của Rubisco bị ngăn chặn và vì vậy hô hấp sáng bị triệt tiêu, đảm bảo được hiệu suất quang hợp cao của chúng trong các điều kiện khô nóng.
Điều kiện xảy ra hô hấp sáng
[sửa | sửa mã nguồn]Hô hấp sáng xảy ra khi enzyme Rubisco thực thi chức năng oxy hóa của nó, điều này chỉ làm được khi nồng độ carbonic bị sụt giảm mạnh và trở nên rất thấp so với oxy - ví dụ như khi hạn hán buộc lỗ khí phải đóng chặt để chống mất nước. Đối với các thực vật C3, hô hấp sáng tăng cao khi nhiệt độ môi trường tăng.
Trong môi trường không khí bình thường (21% oxy), tỉ lệ của hô hấp sáng là chừng 17% của tổng năng suất quang hợp. Tuy nhiên do một carbonic sản sinh cần đến 2 oxy tham gia, tỉ lệ này dôi lên 34%, tương ứng với 3 carbonic: 1 oxy.[1]
Cơ chế
[sửa | sửa mã nguồn]Miêu tả đơn giản
[sửa | sửa mã nguồn]Rubisco là một enzyme có hai chức năng. Khi nồng độ carbonic trong tế bào ở mức rất cao so với oxy, nó sẽ xúc tác cho RiDP phản ứng với carbonic và chu trình Calvin xảy ra bình thường. Tuy nhiên khi nồng độ oxy trở nên rất cao so với carbonic thì hô hấp sáng xảy ra: RuBisCO xúc tác quá trình oxy hóa RiDP để RiDP bị cắt thành một phân tử acid 3-phosphoglyceric (PGA) và phosphoglycerate(PG) APG sẽ quay trở lại chu trình Calvin và được chuyển trở lại thành RiDP. Tuy nhiên AG thì rất khó được "tái chế" như vậy, vì thế nó rời khỏi lục lạp mà tiến vào peroxisome và ti thể, lúc đó nó sẽ biến đổi do trải qua nhiều phản ứng và cuối cùng các phân tử carbon của nó mới về được chu trình Calvin.
Miêu tả chi tiết
[sửa | sửa mã nguồn]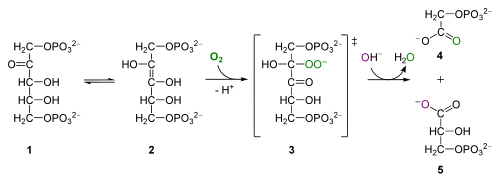
Như đã nói, quá trình hô hấp sáng được tiến hành nhờ hoạt tính oxygenase của enzyme RuBisCO. Cụ thể Rubisco sẽ xúc tác phản ứng oxy hóa RuBP như sau:
RuBP + O2 → Phosphoglycolat + 3-phosphoglycerat + 2H+Phosphorglycolat (PPG) sau đó sẽ được cơ thể tái sử dụng bởi một loạt các phản ứng xảy ra trong thể peroxi và ti thể, nơi nó được biến đổi thành glycin, serin và sau đó là phosphoglycerat (PGC). Glycerat lại "chui" trở vào lục lạp và tái tham gia chu trình Calvin. Việc chuyển đổi một PGC thành PPG tiêu tốn một ATP trong lục lạp, và đối với 2 phân tử O2 tiêu tốn trong hô hấp sáng thì một phân tử carbonic sẽ được sản sinh. Toàn bộ quá trình chuyển hóa PPG trong hô hấp sáng được gọi là chu trình C2 glycolat hay chu trình oxy hóa carbon quang hợp (viết tắt là chu trình PCO).[1]
Tổng cộng trong chu trình này một nguyên tử carbon sẽ bị thất thoát[2] dưới dạng CO2. Nitơ trong serine sẽ bị chuyển thành amonia, nhưng nó không bị hao hụt mà nhanh chóng được chuyển về lục lạp trong chu trình glutamat synthase.[1]

Hô hấp sáng có lợi hay có hại ?
[sửa | sửa mã nguồn]Xét về khía cạnh hiệu suất quang hợp thuần túy, hô hấp sáng là một quá trình hoàn toàn lãng phí vì việc sản sinh G3P diễn ra với năng suất thấp trong khi năng lượng tiêu tốn lại nhiều hơn (5ATP và 3NADH) so với việc cố định carbonic trong chu trình Calvin (3ATP và 2NADH). Đó là chưa kể, so với chu trình Calvin, hô hấp sáng còn làm mất đi một nguyên tử carbon.[2] Và trong khi hô hấp sáng cuối cùng cũng sản sinh ra G3P - nguồn năng lượng và nguyên liệu chủ chốt của thực vật - nó cũng sinh ra một sản phẩm phụ là amonia - đây là một chất độc mà nội việc khử nó cũng tiêu tốn khá nhiều năng lượng và nguyên vật liệu. Do hô hấp sáng không hề sản sinh ra ATP cũng như làm hao hụt đi carbon và nitơ (dưới dạng ammoniac), nó sẽ làm suy giảm hiệu suất quang hợp cũng như tốc độ sinh trưởng của cây. Trên thực tế, hô hấp sáng có thể làm sụt giảm đến 25% năng suất quang hợp của các thực vật C3.[3]
Có giả thuyết cho rằng hô hấp sáng được cho là một "di vật" còn sót lại trong quá trình tiến hóa và hiện nay nó không còn tác dụng gì nữa. Trên thực tế, bầu khí quyền Trái Đất thời cổ xưa - thời điểm RuBisCO hình thành trong bộ máy quang hợp - hàm chứa rất ít oxy và hàm lượng carbonic tương đối cao - vì vậy đã có giả thuyết cho rằng chức năng carboxylase của RuBisCO lúc đó không bị ảnh hưởng mấy bởi nồng độ O2 và carbonic.[2]
Tuy nhiên, một số nghiên cứu cho thấy, hô hấp sáng không hoàn toàn là "có hại" cho cây. Việc làm giảm hoặc triệt tiêu hô hấp sáng - do biến đổi gene hay do hàm lượng carbonic tăng lên trong thời gian gần đây - nhiều lúc không giúp cây phát triển tốt được. Ví dụ, trong thí nghiệm như một thực vật thuộc chi Arabidopis, đột biến bất hoạt gien quy định hô hấp sáng của loài này sẽ gây ra những ảnh hưởng tai hại cho nó trong một số điều kiện môi trường nhất định. Những bất lợi của việc hô hấp sáng cũng chưa cho thấy ảnh hưởng nghiêm trọng nào đến "đời sống" của các thực vật C3. Và các nhà khoa học cũng chưa tìm thấy bằng chứng nào cho thấy sức ép thích nghi của tự nhiên sẽ/đã tạo ra một loại Rubisco mới ít gắn kết với oxy hơn hiện tại.[2]
Mặc dù chức năng của hô hấp sáng hiện nay còn nhiều tranh cãi, giới khoa học đã chấp nhận rằng hô hấp sáng có một ảnh hưởng rộng đến các quá trình sinh hóa của thực vật, tỉ như chức năng của hệ thống quang hợp II, biến dưỡng carbon, cố định đạm và hô hấp thông thường. Chu trình hô hấp sáng cung cấp một lượng lớn H2O2 cho các tế bào quang hợp, vì thế đóng góp đáng kể vào quá trình nội cân bằng oxy hóa-khử trong tế bào thông qua tương tác giữa H2O2 nucleotide pyridine. Cũng bằng cách đó mà hô hấp sáng cũng có ảnh hưởng tới nhiều quá trình truyền tín hiệu tế bào, cụ thể như quá trình điều tiết sự phản ứng của tế bào đối với các yếu tố liên quan tới việc sinh trưởng, miễn dịch, thích ứng với môi trường và sự chết tế bào theo lập trình.[4] Đồng thời, các nghiên cứu cũng cho thấy hô hấp sáng là quá trình cần thiết nhằm làm tăng hàm lượng nitrat trong đất.[5]
Gần đây, nhiều bằng chứng khoa học đã củng cố một giả thuyết về chức năng bảo vệ của hô hấp sáng khi thực vật "hứng" phải quá nhiều quang năng trong điều kiện nồng độ carbonic ở mức thấp. Cụ thể, hô hấp sáng sẽ thủ tiêu toàn bộ lượng NADPH và ATP dư thừa trong pha sáng của quang hợp, nhờ đó không cho chúng thực hiện các phản ứng oxy hóa quang sản sinh ra các gốc tự do làm hại đến thành phần cấu trúc của bào quan và tế bào. Thật vậy, đối với loài Arabidopis kể trên, khi phải "tắm nắng" thì các cá thể đột biến mất khả năng hô hấp sáng tỏ ra dễ tổn thương hơn các cá thể bình thường.[2]
Hô hấp sáng bị triệt tiêu hoặc bị làm giảm trong thực vật C4 và CAM
[sửa | sửa mã nguồn] Xem thêm: Thực vật C4 và Thực vật CAM
Một bộ phận các loài thực vật đã sử dụng một số cơ chế nhằm làm giảm sự tương tác của RuBisCO với oxy và qua đó, làm giảm hoặc triệt tiêu hoạt tính oxygenase của enzyme này. Nguyên lý chung của các cơ chế này là làm nồng độ CO2 tăng cao đến mức Rubisco gần như không thể thực hiện chức năng oxy hóa RuBP như trong hô hấp sáng nữa.
Thực vật C4 "bắt" và cố định carbonic trong các tế bào thịt lá (bằng cách sử dụng một enzyme mang tên là phosphoenolpyruvat carboxylase, viết tắt PEP carboxylase) bằng cách gắn CO2 vào một acid hữu cơ để hình thành oxaloacetat. Oxaloacetat sau đó sẽ được chuyển đổi thành malic và được đưa vào trong các tế bào vòng bao bó mạch, nơi nồng độ oxy thấp và hô hấp sáng khó xảy ra. Tại đây, malic sẽ giải phóng CO2 để chúng tham gia vào chu trình Calvin mà không bị hô hấp sáng cản trở. Khả năng tránh được hô hấp sáng khiến các thực vật C4 chịu hạn và chịu nắng tốt hơn nhiều so với các thực vật C3: trong điều khiện khô nắng thì lỗ khí sẽ phải đóng chặt khiến cây không thể hấp thu thêm CO2 để tăng nồng độ carbonic. Các loài thực vật C4 phần nhiều là các cây sinh trưởng ở vùng cận nhiệt và nhiệt đới, trong đó có những loài cây nông nghiệp quan trọng như mía, ngô và lúa miến.[6][7]
Thực vật CAM - tỉ như các thực vật mọng nước hay các loài thuộc họ Xương rồng - cũng sử dụng enzyme PEP carboxylase để cố định carbonic nhưng theo một cơ chế khác với thực vật C4. Cụ thể là, việc cố định CO2 diễn ra trong mọi tế bào nhưng chỉ diễn ra vào ban đêm. Còn vào ban ngày, carbonic sẽ được phóng thích khỏi "kho" và tham gia vào chu trình Calvin. Việc này giúp cho lỗ khí của các thực vật CAM chỉ cần phải mở vào ban đêm - thời điểm ít nắng và ít bị mất nước - để "đón" CO2 - một ưu thế tối quan trọng cho việc tồn tại ở những nơi cực kì khô nóng như sa mạc.[7]
Áp chế hô hấp sáng cũng có cái giá của nó. Chu trình cố định carbonic không phải là cỗ máy hoạt động không công: việc cố định mỗi phân tử CO2 nhờ PEP carboxylase tiêu tốn mất chừng 2 ATP của thực vật.[8] Đối với thực vật CAM, năng suất hấp thu carbonic của nó thấp thảm hại so với thực vật C3 và C4 và tốc độ sinh trưởng của chúng thậm chí có thể sụt giảm trong điều kiện độ ẩm cao,[9] nguyên do là trong điều kiện này, bản chất của cơ chế CAM khiến tế bào hấp thu quá nhiều nước và vỡ ra, gây thương tổn cho cây.[10] Trên thực tế, khi cùng đặt trong môi trường không quá nắng nóng và đủ ẩm, năng suất quang hợp của thực vật C3 có thể ngang bằng và thậm chí vượt trội hơn. Bản thân hoạt động của chu trình PEP carboxylase cũng sẽ bị tổn hại ở nhiệt độ thấp và vì vậy thời tiết lạnh là điều không hay đối với các loài dùng chu trình này.[11] Tuy nhiên, như đã nói, các thực vật C4 và CAM vốn sinh trưởng ở các khu vực nhiều nắng và nhiệt độ cao, vì vậy cái giá phải trả này cũng không là gì so với lợi ích quá lớn mà chúng thu được. Thật vậy, rất nhiều loài thực vật C4 nằm trong danh sách những loài cỏ dại hung hăng nhất cũng như các cây nông nghiệp năng suất cao nhất.[11] Đối với thực vật CAM, việc quang hợp và tích trữ vật liệu vẫn diễn ra đều đều ở các sa mạc khô cằn, nơi các loài cây khác không thể thực hiện được.[9]
Xem thêm
[sửa | sửa mã nguồn]- Thực vật CAM
- Thực vật C4
- Thực vật C3
Chú thích
[sửa | sửa mã nguồn]- ^ a b c Hopkins, Hüner, trang 143
- ^ a b c d e Hopkins, Hüner, trang 144
- ^ Sharkey, Thomas (1988). "Estimating the rate of photorespiration in leaves". Physiologia Plantarum. Quyển 73 số 1. tr. 147–152. doi:10.1111/j.1399-3054.1988.tb09205.x.
- ^ doi:10.1146/annurev.arplant.043008.091948
- ^ Rachmilevitch S, Cousins AB, Bloom AJ (2004). "Nitrate assimilation in plant shoots depends on photorespiration". Proc. Natl. Acad. Sci. U.S.A. Quyển 101 số 31. tr. 11506–10. doi:10.1073/pnas.0404388101. PMC 509230. PMID 15272076.{{Chú thích tạp chí}}: Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ Hopkins, Hüner, trang 263
- ^ a b Levetin, McMahon, trang 62
- ^ Hopkins, Hüner, trang 264
- ^ a b Hopkins, Hüner, trang 269
- ^ E. Londers; J. Ceusters; I. Vervaeke; R. Deroose; M.P. De Proft (2005). "Organic acid analysis and plant water status of two Aechmea cultivars grown under greenhouse conditions: implications on leaf quality". Scientia Horticulturae. Quyển 105. tr. 249–262. doi:10.1093/aob/mcn105. Truy cập ngày 11 tháng 2 năm 2012.{{Chú thích tạp chí}}: Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ a b Hopkins, Hüner, trang 266-267
Tham khảo
[sửa | sửa mã nguồn]- William G. Hopkins (2009). Introduction to Plant Physiology. Norman P. A. Hüner (ấn bản thứ 4). Hoa Kỳ: John Wileys & Sons, Inc. ISBN 978-0-470-24766-2.
- Levetin, Estelle (2003). Plant and society. McMahon, Karen. New York: McGraw-Hill. ISBN 0072909498.
- Stern, Kingsley (2003). Introductory Plant Biology. New York: McGraw-Hill. ISBN 0072909412.
- Siedow, James N.; Day, David (2000). "14. Respiration and Photorespiration". Biochemistry and Molecular Biology of Plants. American Society of Plant Physiologists.{{Chú thích sách}}: Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
Từ khóa » Khi Nào Xảy Ra Hô Hấp ở Thực Vật C3
-
Điều Kiện Xảy Ra Quá Trình Hô Hấp Sáng ở Thực Vật C3 Là...
-
Điều Kiện Xảy Ra Quá Trình Hô Hấp Sáng ở Thực Vật C3 Là
-
Điều Kiện Xảy Ra Quá Trình Hô Hấp Sáng ở Thực Vật C3 Là
-
Điều Kiện Xảy Ra Quá Trình Hô Hấp Sáng ở Thực Vật C3 Là
-
Quá Trình Hô Hấp Của Thực Vật C3 Diễn Ra Trong điều Kiện Nào Sau đây
-
Hô Hấp Sáng ở Thực Vật C3 Là Gì? Cơ Chế Hô Hấp ... - DINHNGHIA.VN
-
Khi Nào Xảy Ra Hô Hấp Sáng ở Thực Vật C3
-
Điều Kiện Xảy Ra Quá Trình Hô Hấp Sáng ở Thực Vật C3 Là - Tự Học 365
-
Hô Hấp Sáng ở Thực Vật C3 Là Gì? Cơ Chế Hô Hấp Sáng ở Thực Vật C3
-
Tại Sao Thực Vật C3 Lại Có Hô Hấp Sáng Còn Thực Vật C4 Và CAM Là ...
-
Hô Hấp Sáng Xảy Ra ở Nhóm Thực Vật Nào - TopLoigiai
-
Top 15 Hô Hấp Sáng ở Thực Vật C3 Xảy Ra Khi 2022
-
Vì Sao Hô Hấp Sáng Chỉ Xảy Ra ở Thực Vật C3 - Hỏi Đáp
-
Hô Hấp Sáng ở Thực Vật C3 Là Gì? Cơ Chế Hô Hấp Sáng ở ... - TIP HAY