Hoá Học 10 Bài 12: Liên Kết Ion - Tinh Thể Ion - HOC247
Nguyên tử kim loại và phi kim muốn đạt đến cấu hình electron bền thì phải thực hiện quá trình nhường nhận electron, biến thành ion trái dấu liên kết nhau, gọi là liến kết ion.
ATNETWORK YOMEDIA1. Tóm tắt lý thuyết
1.1. Sự tạo thành ion, cation, anion
1.2. Sự tạo thành liên kết ion
1.3. Tinh thể ion
2. Bài tập minh hoạ
3. Luyện tập Bài 12 Hóa học 10
3.1. Trắc nghiệm
3.2. Bài tập SGK và Nâng cao
4. Hỏi đáp về Bài 12 Chương 3 Hóa học 10

Tóm tắt lý thuyết
1.1. SỰ TẠO THÀNH ION, CATION, ANION
1.1.1. Ion, Cation, Anion
Sự tạo thành ion
Nguyên tử luôn trung hòa về điện, nhưng khi nguyên tử nhường hay nhận thêm electron thì nó trở thành phần tử mang điện gọi là ion.
Sự tạo thành Cation
- Khi nguyên tử kim loại nhường đi e ngoài cùng thì biến thành ion dương (hay Cation).
- Các nguyên tử kim loại lớp ngoài cùng có 1,2,3 electron → dễ nhường electron để tạo ra cation (ion dương) có cấu hình bền vững của khí hiếm.
Hình 1: Sự hình thành ion Li+
Li → Li+ + 1e
- Cấu hình electron của Li: 1s22s1, Nguyên tử Li dễ nhường 1 electron ở lớp ngoài cùng (1s22s1), trở thành ion dương Li+ (1s2)
- Ví dụ:
Na → Na+ + 1e (cation Natri)
Mg → Mg2+ + 2e (cation Magie)
Al → Al3+ + 3e (cation Nhôm)
- Kết luận:
Trong các phản ứng hóa học, để đạt cấu hình electron bền của khí hiếm nguyên tử kim loại có khuynh hướng nhường e cho nguyên tử nguyên tố khác để trở thành ion dương, gọi là cation.
Tổng quát: M → Mn+ + ne
Sự tạo thành Cation
- Khi nguyên tử phi kim nhận thêm electron thì biến thành ion âm (hay Anion).
- Các nguyên tử phi kim lớp ngoài cùng có 5,6,7e có khả năng nhận thêm electron và biến thành anion (ion âm) có cấu hình bền vững của khí hiếm.
Hình 2: Sự hình thành ion F-
F + 1e → F-
-
Cấu hình e của nguyên tử F : 1s2 2s2 2p5
-
Do có 7e lớp ngoài cùng nên Flo có xu hướng nhận thêm 1e để đạt được cấu hình bền vững của khí hiếm Ne
Hình 3: Sự hình thành ion Cl-
Cl + 1e → Cl-
- Ví dụ: O + 2e → O2-
- Các anion được gọi theo tên gốc axit (trừ oxi). F- (ion florua), Cl- (ion clorua) ...
- Kết luận:
Trong các phản ứng hóa học, để đạt cấu hình electron bền của khí hiếm nguyên tử phi kim có khuynh hướng nhận e từ nguyên tử các nguyên tố khác để trở thành ion âm, gọi là anion.
Tổng quát: A + ne → An-
1.1.2. Ion đơn nguyên tử Và Ion Đa nguyên tử
Ion đơn nguyên tử
- Là các ion tạo nên từ một nguyên tử.
- Ví dụ: Cation: Na+, Ca2+… Anion: Cl- ,S2- …
Ion đa nguyên tử
- Là những nhóm nguyên tử mang điện tích dương hay âm.
- Ví dụ: Cation: NH4+ ... Anion: SO42-, OH-…
1.2. SỰ TẠO THÀNH LIÊN KẾT ION
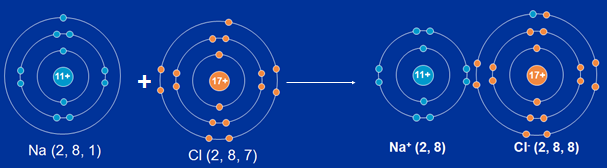
Ví dụ: Xét phân tử NaCl
- Nguyên tử Na nhường 1e cho nguyên tử Cl để biến thành ion dương Na+.
Na → Na+ + 1e
- Mỗi nguyên tử Cl nhận 1e để biến thành ion âm Cl-
Cl + 1e → Cl-
Hình 4: Quá trình hình thành liên kết ion giữa Natri và Clo
- Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện trái dấu.
- Phản ứng hóa học: 2Na + Cl2 → 2 NaCl
1.3. TINH THỂ ION
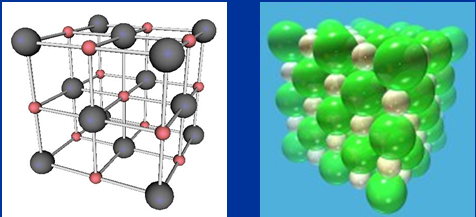
1.3.1. Tinh thể NaCl
-
Ở thể rắn, NaCl tồn tại dưới dạng tinh thể. Trong mạng tinh thể NaCl các ion Na+,Cl- được phân bố luân phiên đều đặn và có trật tự trên các đỉnh của hình lập phương nhỏ. Xung quanh mỗi ion đều có 6 ion ngược dấu liên kết với nó.
Hình 5: Tinh thể ion NaCl
1.3.2. Tính chất chung của hợp chất ion
- Tinh thể ion rất bền vững vì lực hút tĩnh điện giữa các ion ngược dấu trong tinh thể lớn. Các hợp chất ion đều khá rắn, khó nóng chảy, khó bay hơi.
- Các hợp chất ion thường tan nhiều trong nước. Khi nóng chảy, khi hòa tan trong nước chúng tạo thành dung dịch dẫn được điện, còn ở trạng thái rắn thì không dẫn được điện.
Bài tập minh họa
Bài 1:
Nguyên tố X và Y thuộc nhóm A; nguyên tử nguyên tố X có 7 electron trên các phân lớp s, nguyên tử nguyên tố Y có 17 electron trên các phân lớp p. Công thức hợp chất tạo bởi X và Y; liên kết hóa học trong hợp chất đó là:
Hướng dẫn:
Nguyên tử nguyên tố X có 7 electron trên các phân lớp s ⇒ X: 1s22s23s24s25s1 Vì thuộc nhóm A nên X thuộc nhóm IA Nguyên tử nguyên tố Y có 17 electron trên các phân lớp p ⇒ Y: 2p63p64p5 ⇒ 4s24p5 Vì Y thuộc nhóm A ⇒ X thuộc nhóm VIIA ⇒ Hợp chất XY: liên kết ion
Bài 2:
Nguyên tử nguyên tố X có electron cuối cùng thuộc phân lớp s, nguyên tử nguyên tố Y có electron cuối cùng thuộc phân lớp p. Biết rằng tổng số electron trong nguyên tử của X và Y là 20. Bản chất của liên kết hóa học trong hợp chất X – Y là:
Hướng dẫn:
X có e cuối thuộc phân lớp s ⇒ nhóm A (I hoặc II). Y có e cuối thuộc phân lớp p ⇒ nhóm A (III → VIII). eX + eY = 20 ⇒ pX + pY = 20 Ta có: X chỉ có thể là: H (p = 1); He (p = 2); Na (p = 11) và K (p = 19). ⇒ Ta thấy chỉ có Na (p = 11) ⇒ pY = 9 (Flo) thỏa mãn. ⇒ X - Y: NaF (liên kết ion).
3. Luyện tập Bài 12 Hóa học 10
Sau bài học cần nắm:
- Cấu hình electron của ion đơn nguyên tử cụ thể
- Xác định ion đơn nguyên tử, ion đa nguyên tử trong một phân tử chất cụ thể.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Liên kết ion - Tinh thể ion có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
Câu 1:
Liên kết hóa học trong phân tử nào sau đây là liên kết ion:
- A. NaCl
- B. HCl
- C. H2O
- D. Cl2
-
Câu 2:
Cho 3 ion Na+, Mg2+, F- . Tìm câu khẳng định sai:
- A. 3 ion trên có cấu hình electron giống nhau
- B. 3 ion trên có số nowtron khác nhau
- C. 3 ion trên có số electron bằng nhau
- D. 3 ion trên có số proton bằng nhau
-
Câu 3:
Nguyên tử Oxi có cấu hình electron là 1s2 2s2 2p4. Sau khi tạo liên kết, nó có cấu hình là:
- A. 1s2 2s2 2p2
- B. 1s2 2s2 2p4 3s2
- C. 1s2 2s2 2p6
- D. 1s2 2s2 2p5
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Liên kết ion - Tinh thể ion.
Bài tập 1 trang 59 SGK Hóa học 10
Bài tập 2 trang 59 SGK Hóa học 10
Bài tập 3 trang 60 SGK Hóa học 10
Bài tập 4 trang 60 SGK Hóa học 10
Bài tập 5 trang 60 SGK Hóa học 10
Bài tập 6 trang 60 SGK Hóa học 10
Bài tập 12.1 trang 29 SBT Hóa học 10
Bài tập 12.2 trang 29 SBT Hóa học 10
Bài tập 12.3 trang 29 SBT Hóa học 10
Bài tập 12.4 trang 29 SBT Hóa học 10
Bài tập 12.5 trang 29 SBT Hóa học 10
Bài tập 12.6 trang 30 SBT Hóa học 10
Bài tập 12.7 trang 30 SBT Hóa học 10
Bài tập 12.8 trang 30 SBT Hóa học 10
Bài tập 12.9 trang 30 SBT Hóa học 10
Bài tập 12.10 trang 30 SBT Hóa học 10
Bài tập 12.11 trang 30 SBT Hóa học 10
Bài tập 12.12 trang 30 SBT Hóa học 10
Bài tập 12.13 trang 30 SBT Hóa học 10
Bài tập 12.14 trang 31 SBT Hóa học 10
Bài tập 12.15 trang 31 SBT Hóa học 10
Bài tập 12.16 trang 31 SBT Hóa học 10
Bài tập 12.17 trang 31 SBT Hóa học 10
Bài tập 12.18 trang 31 SBT Hóa học 10
Bài tập 12.19 trang 31 SBT Hóa học 10
Bài tập 12.20 trang 31 SBT Hóa học 10
Bài tập 12.21 trang 31 SBT Hóa học 10
Bài tập 12.22 trang 31 SBT Hóa học 10
Bài tập 1 trang 70 SGK Hóa học 10 nâng cao
Bài tập 2 trang 70 SGK Hóa học 10 nâng cao
Bài tập 3 trang 70 SGK Hóa học 10 nâng cao
Bài tập 4 trang 70 SGK Hóa học 10 nâng cao
Bài tập 5 trang 70 SGK Hóa học 10 nâng cao
Bài tập 6 trang 70 SGK Hóa học 10 nâng cao
Bài tập 7 trang 70 SGK Hóa học 10 nâng cao
Bài tập 8 trang 70 SGK Hóa học 10 nâng cao
4. Hỏi đáp về Bài 12 Chương 3 Hóa học 10
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
 NONE
NONE Bài học cùng chương
 Hoá học 10 Bài 13: Liên kết cộng hóa trị
Hoá học 10 Bài 13: Liên kết cộng hóa trị  Hoá học 10 Bài 14: Tinh thể nguyên tử và tinh thể phân tử
Hoá học 10 Bài 14: Tinh thể nguyên tử và tinh thể phân tử  Hoá học 10 Bài 15: Hóa trị và số oxi hóa
Hoá học 10 Bài 15: Hóa trị và số oxi hóa  Hoá học 10 Bài 16: Luyện tập Liên kết hóa học ADSENSE ADMICRO Bộ đề thi nổi bật
Hoá học 10 Bài 16: Luyện tập Liên kết hóa học ADSENSE ADMICRO Bộ đề thi nổi bật  UREKA AANETWORK
UREKA AANETWORK 
XEM NHANH CHƯƠNG TRÌNH LỚP 10
Toán 10
Toán 10 Kết Nối Tri Thức
Toán 10 Chân Trời Sáng Tạo
Toán 10 Cánh Diều
Giải bài tập Toán 10 Kết Nối Tri Thức
Giải bài tập Toán 10 CTST
Giải bài tập Toán 10 Cánh Diều
Trắc nghiệm Toán 10
Ngữ văn 10
Ngữ Văn 10 Kết Nối Tri Thức
Ngữ Văn 10 Chân Trời Sáng Tạo
Ngữ Văn 10 Cánh Diều
Soạn Văn 10 Kết Nối Tri Thức
Soạn Văn 10 Chân Trời Sáng tạo
Soạn Văn 10 Cánh Diều
Văn mẫu 10
Tiếng Anh 10
Giải Tiếng Anh 10 Kết Nối Tri Thức
Giải Tiếng Anh 10 CTST
Giải Tiếng Anh 10 Cánh Diều
Trắc nghiệm Tiếng Anh 10 KNTT
Trắc nghiệm Tiếng Anh 10 CTST
Trắc nghiệm Tiếng Anh 10 CD
Giải Sách bài tập Tiếng Anh 10
Vật lý 10
Vật lý 10 Kết Nối Tri Thức
Vật lý 10 Chân Trời Sáng Tạo
Vật lý 10 Cánh Diều
Giải bài tập Lý 10 Kết Nối Tri Thức
Giải bài tập Lý 10 CTST
Giải bài tập Lý 10 Cánh Diều
Trắc nghiệm Vật Lý 10
Hoá học 10
Hóa học 10 Kết Nối Tri Thức
Hóa học 10 Chân Trời Sáng Tạo
Hóa học 10 Cánh Diều
Giải bài tập Hóa 10 Kết Nối Tri Thức
Giải bài tập Hóa 10 CTST
Giải bài tập Hóa 10 Cánh Diều
Trắc nghiệm Hóa 10
Sinh học 10
Sinh học 10 Kết Nối Tri Thức
Sinh học 10 Chân Trời Sáng Tạo
Sinh học 10 Cánh Diều
Giải bài tập Sinh 10 Kết Nối Tri Thức
Giải bài tập Sinh 10 CTST
Giải bài tập Sinh 10 Cánh Diều
Trắc nghiệm Sinh học 10
Lịch sử 10
Lịch Sử 10 Kết Nối Tri Thức
Lịch Sử 10 Chân Trời Sáng Tạo
Lịch Sử 10 Cánh Diều
Giải bài tập Lịch Sử 10 KNTT
Giải bài tập Lịch Sử 10 CTST
Giải bài tập Lịch Sử 10 Cánh Diều
Trắc nghiệm Lịch sử 10
Địa lý 10
Địa Lý 10 Kết Nối Tri Thức
Địa Lý 10 Chân Trời Sáng Tạo
Địa Lý 10 Cánh Diều
Giải bài tập Địa Lý 10 KNTT
Giải bài tập Địa Lý 10 CTST
Giải bài tập Địa Lý 10 Cánh Diều
Trắc nghiệm Địa lý 10
GDKT & PL 10
GDKT & PL 10 Kết Nối Tri Thức
GDKT & PL 10 Chân Trời Sáng Tạo
GDKT & PL 10 Cánh Diều
Giải bài tập GDKT & PL 10 KNTT
Giải bài tập GDKT & PL 10 CTST
Giải bài tập GDKT & PL 10 CD
Trắc nghiệm GDKT & PL 10
Công nghệ 10
Công nghệ 10 Kết Nối Tri Thức
Công nghệ 10 Chân Trời Sáng Tạo
Công nghệ 10 Cánh Diều
Giải bài tập Công nghệ 10 KNTT
Giải bài tập Công nghệ 10 CTST
Giải bài tập Công nghệ 10 CD
Trắc nghiệm Công nghệ 10
Tin học 10
Tin học 10 Kết Nối Tri Thức
Tin học 10 Chân Trời Sáng Tạo
Tin học 10 Cánh Diều
Giải bài tập Tin học 10 KNTT
Giải bài tập Tin học 10 CTST
Giải bài tập Tin học 10 Cánh Diều
Trắc nghiệm Tin học 10
Cộng đồng
Hỏi đáp lớp 10
Tư liệu lớp 10
Xem nhiều nhất tuần
Đề thi giữa HK1 lớp 10
Đề thi giữa HK2 lớp 10
Đề thi HK1 lớp 10
Đề thi HK2 lớp 10
Đề cương HK1 lớp 10
Video bồi dưỡng HSG môn Toán
Toán 10 Cánh Diều Bài tập cuối chương 1
Toán 10 Chân trời sáng tạo Bài 2: Tập hợp
Toán 10 Kết nối tri thức Bài 1: Mệnh đề
Soạn bài Ra-ma buộc tội - Ngữ văn 10 Tập 1 Cánh Diều
Soạn bài Chữ người tử tù - Nguyễn Tuân - Ngữ văn 10 KNTT
Soạn bài Thần Trụ Trời - Ngữ văn 10 CTST
Văn mẫu về Tây Tiến
Văn mẫu về Cảm xúc mùa thu (Thu hứng)
Văn mẫu về Bình Ngô đại cáo
Văn mẫu về Chữ người tử tù
YOMEDIA YOMEDIA ×Thông báo
Bạn vui lòng đăng nhập trước khi sử dụng chức năng này.
Bỏ qua Đăng nhập ×Thông báo
Bạn vui lòng đăng nhập trước khi sử dụng chức năng này.
Đồng ý ATNETWORK ON QC Bỏ qua >>
QC Bỏ qua >> Từ khóa » Tính Ion Là Gì
-
Liên Kết Ion Là Gì? Sự Hình Thành Liên Kết Ion Như Thế Nào?
-
Lý Thuyết Liên Kết Ion - Tinh Thể Ion | SGK Hóa Lớp 10
-
Liên Kết Ion – Wikipedia Tiếng Việt
-
Liên Kết Ion Là Gì? Tinh Thể Ion Là Gì? Sự Hình Thành Liên Kết Ion
-
Liên Kết Ion Là Gì, được Hình Thành Như Thế Nào? Giải đáp Chi Tiết Nhất
-
Bài 12. Liên Kết Ion - Tinh Thể Ion - Củng Cố Kiến Thức
-
Công Thức Của Hợp Chất Ion Hoạt động Như Thế Nào
-
Liên Kết Ion Là Gì? - Thư Viện Khoa Học
-
Liên Kết Ion Sự Hình Thành Ion Cation, Anion Và Bài Tập - Hóa 10 Bài 12
-
Tổng Hợp Lý Thuyết Liên Kết Ion - Hóa Học 10 - CungHocVui
-
Liên Kết Ion Là Gì? Tìm Hiểu Sự Hình Thành Liên Kết Ion
-
Ion Là Gì? Lợi ích Của Ion đối Với Sức Khỏe - Điện Máy XANH
-
Liên Kết Ion Là Gì? Định Nghĩa, Khái Niệm - LaGi.Wiki
.PNG)
.PNG)