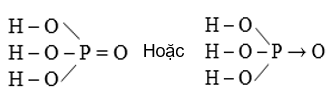Hoá Học 11 Bài 11: Axit Photphoric Và Muối Photphat - Hoc247
Có thể bạn quan tâm
Nội dung bài học Axit photphoric và muối photphat nghiên cứu về cấu tạo phân tử, tính chất vật lí (trạng thái, màu, tính tan), ứng dụng, cách điều chế H3PO4 trong phòng thí nghiệm và trong công nghiệp. Tính chất của muối photphat (tính tan, tác dụng với axit, phản ứng với dung dịch muối khác), ứng dụng.
ATNETWORK YOMEDIA1. Tóm tắt lý thuyết
1.1. Axit photphoric
1.2. Muối photphat
2. Bài tập minh hoạ
3. Luyện tập Bài 11 Hóa học 11
3.1. Trắc nghiệm
3.2. Bài tập SGK và Nâng cao
4. Hỏi đáp về Bài 11 Chương 2 Hóa học 11

Tóm tắt lý thuyết
1.1. Axit photphoric
1.1.1. Cấu tạo phân tử
Hình 1: Cấu tạo phân tử H3PO4
- Photpho có số oxi hóa là +5
1.1.2. Tính chất vật lí
- Tinh thể trong suốt, nóng chảy ở 42,50C. Rất háo nước nên dễ chảy rữa, tan trong nước ở bất kì tỉ lệ nào.
- Dung dịch axit sunfuric là dung dịch đặc, sánh, không màu, có nồng độ 85%.
1.1.3. Tính chất hóa học
1.1.3.1. Tính axít
- Trong nước H3PO4 phân li theo 3 nấc:
H3PO4 \(\leftrightarrows\) H+ + H2PO4-
H2PO4- \(\leftrightarrows\) H+ + HPO42-
HPO4 2- \(\leftrightarrows\) H+ + PO43-
- Dung dịch H3PO4 có tính chất chung của 1 axít và có độ mạnh TB: Nấc 1 > nấc 2 > nấc 3
1.1.3.2. Tác dụng với bazơ
- Tuỳ theo tỉ lệ chất tham gia phản ứng mà H3PO4 sinh ra muối axít hoặc muối trung hoà
H3PO4 + NaOH → NaH2PO4 + H2O (1)
H3PO4 + 2 NaOH → Na2HPO4+ 2H2O (2)
H3PO4 + 3 NaOH → Na3PO4 + 3H2O (3)
- \(a = \frac{{{n_{NaOH}}}}{{{n_{{H_3}P{O_4}}}}}\)
Nếu a \(\leq\) 1 → NaH2PO4 (1)
Nếu a = 2 → Na2HPO4 (2)
Nếu a \(\geq\) 3 → Na3PO4 (3)
Nếu 1< a < 2 xảy ra (1) và (2)
Nếu 2< a < 3 xảy ra (2) và (3)
1.1.3.3. H3PO4 không có tính oxi hóa
- Mặc dù Photpho có số oxi hóa cao nhất +5 nhưng H3PO4 không có tính oxi hoá như HNO3 vì trong ion PO43- rất bền vững.
- H3PO4 là axít 3 nấc có độ mạnh trung bình và không có tính oxi hoá.
1.1.4. Điều chế
- Từ quặng photphorit hoặc apatit: Ca3(PO4)2 + 3 H2SO4 (đ) → 2H3PO4 + 3CaSO4
→ H3PO4 thu được không tinh khiết.
- Từ photpho:
4 P + 5O2 → 2 P2O5
P2O5 + 3 H2O → 2 H3PO4
→ Phương pháp này H3PO4 có độ tinh khiết và nồng độ cao hơn.
1.1.5. Ứng dụng
- Điều chế muối photphat
- Sản xuất phân lân, thuốc trừ sâu
- Dược phẩm
1.2. Muối photphat
1.2.1. Tính tan
- Muối trung hoà và muối axit của kim loại Na, K đều tan trong nước
- Với các kim loại khác: Chỉ muối đihiđrophotphat tan, còn lại đều không tan hoặc ít tan
1.2.2. Nhận biết ion photphat
- Thuốc thử: Dung dịch AgNO3
- Hiện tượng: Kết tủa màu vàng
- Phương trình hóa học: 3Ag+ + PO4 3- → Ag3PO4 (màu vàng)
Video 2: Nhận biết ion photphat
Bài tập minh họa
Bài 1:
Chia dung dịch H3PO4 thành 3 phần bằng nhau: Trung hoà phần một vừa đủ bởi 300ml dung dịch NaOH 1,5M. Trộn phần hai với phần ba rồi cho tiếp vào một lượng dung dịch NaOH như đã dùng ở phần một, cô cạn dung dịch sau phản ứng thu được m gam muối. Giá trị m là:
Hướng dẫn:
\(\\ P1 : n_{NaOH}.\frac{1}{3} = n_{H_{3}PO_{4}} = 0,15 \ mol \\ P2 + P3 : n_{H_{3}PO_{4}} = 0,3 \ mol \Rightarrow n_{NaOH} = 1,5n_{H_{3}PO_{4}}\) ⇒ Tạo muối: NaH2PO4: x mol và Na2HPO4: y mol ⇒ nNaOH = x + 2y = 0,45; x + y = 0,3 ⇒ x = y = 0,15 mol ⇒ Muối gồm 0,15 mol NaH2PO4 và 0,15 mol Na2HPO4 ⇒ m = 39,3g
Bài 2:
Cho sơ đồ phản ứng sau: Ca3(PO4)2 → P → P2O5 → H3PO4. Để điều chế được 5 lít H3PO4 2M cần dùng hết bao nhiêu kg quặng photphorit? Biết hiệu suất của cả quá trình là 80%, hàm lượng Ca3(PO4)2 trong quặng chiếm 95%.
Hướng dẫn:
Giả sử cần mg quặng ⇒ \(m_{Ca_{3}(PO_{4})_{2}}= 0,95m \ (g)\) ⇒ Thực tế chỉ có 0,8.0,95m = 0,76m (g) Ca3(PO4)2 phản ứng Ca3(PO4)2 → 2H3PO4 310g 2.98g 0,76m(g) 980g ⇒ m = 2040g = 2,04 kg
Bài 3:
Cho H3PO4 tác dụng hết với dung dịch chứa m gam NaOH, sau phản ứng thu được dung dịch X có chứa 2,51m gam chất tan. Các chất tan trong dung dịch X là:
Hướng dẫn:
Các phản ứng có thể xảy ra: (1) 3NaOH + H3PO4 → Na3PO4 + 3H2O (2) 2NaOH + H3PO4 → Na2HPO4 + 2H2O (3) NaOH + H3PO4 → NaH2PO4 + H2O Ta thấy: \(n_{NaOH} = n_{H_{2}O} = 0,025m \ (mol)\) Bảo toàn khối lượng: \(m_{H_{3}PO_{4}} + m_{NaOH}= m\)chất tan \(+ \ m_{H_{2}O}\) \(\Rightarrow m_{H_{3}PO_{4}} = 1,61m \ (g) \Rightarrow n_{H_{3}PO_{4}} = 0,016m \ (mol)\) \(\Rightarrow n_{NaOH}: n_{H_{3}PO_{4}} = 0,025m : 0,016m = 1,52 \ ( 1 < 1,52 < 2)\) ⇒ Xảy ra phản ứng (2) và (3) Chất tan là Na2HPO4 và NaH2PO4
3. Luyện tập Bài 11 Hóa học 11
Sau bài học cần nắm:
- Cấu tạo phân tử, tính chất vật lí (trạng thái, màu, tính tan), ứng dụng
- Cách điều chế H3PO4 trong phòng thí nghiệm và trong công nghiệp.
- Tính chất của muối photphat (tính tan, tác dụng với axit, phản ứng với dung dịch muối khác)
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 11 Bài 11 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
Câu 1:
Axit photphoric và axit nitric có công thức tương ứng là?
- A. H3PO4, H2SO4.
- B. H3PO4, HPO3.
- C. H3PO4, H2SiO3.
- D. H3PO4, HNO3.
-
Câu 2:
Trong phòng thí nghiệm, để điều chế axit H3PO4 người ta làm cách nào sau đây?
- A. Cho dung dịch axit H2SO4 đặc, nóng tác dụng với quặng apatit.
- B. Cho dung dịch axit H2SO4 đặc, nóng tác dụng với quặng photphorit.
- C. Cho photpho tác dụng với dung dịch HNO3 đặc, nóng.
- D. Đốt cháy photpho trong oxi dư, cho sản phẩm tác dụng với nước.
-
Câu 3:
Cho dung dịch AgNO3 tác dụng với dung dịch chứa chất X thấy tạo kết tủa T màu vàng. Cho kết tủa T tác dụng với dung dịch HNO3 dư thấy kết tủa tan. Chất X là:
- A. KCl.
- B. KBr.
- C. KI.
- D. K3PO4.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 11 Bài 11.
Bài tập 1 trang 54 SGK Hóa học 11
Bài tập 2 trang 54 SGK Hóa học 11
Bài tập 3 trang 54 SGK Hóa học 11
Bài tập 4 trang 54 SGK Hóa học 11
Bài tập 5 trang 54 SGK Hóa học 11
Bài tập 11.1 trang 18 SBT Hóa học 11
Bài tập 11.2 trang 18 SBT Hóa học 11
Bài tập 11.3 trang 18 SBT Hóa học 11
Bài tập 11.4 trang 18 SBT Hóa học 11
Bài tập 11.5 trang 18 SBT Hóa học 11
Bài tập 11.6 trang 18 SBT Hóa học 11
Bài tập 11.7 trang 18 SBT Hóa học 11
Bài tập 11.8 trang 18 SBT Hóa học 11
Bài tập 1 trang 66 SGK Hóa học 11 nâng cao
Bài tập 2 trang 66 SGK Hóa học 11 nâng cao
Bài tập 3 trang 66 SGK Hóa học 11 nâng cao
Bài tập 4 trang 66 SGK Hóa học 11 nâng cao
Bài tập 5 trang 66 SGK Hóa học 11 nâng cao
Bài tập 6 trang 66 SGK Hóa học 11 nâng cao
Bài tập 7 trang 66 SGK Hóa học 11 nâng cao
Bài tập 8 trang 66 SGK Hóa học 11 nâng cao
4. Hỏi đáp về Bài 11 Chương 2 Hóa học 11
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
 NONE
NONE Bài học cùng chương
 Hoá học 11 Bài 7: Nitơ
Hoá học 11 Bài 7: Nitơ  Hoá học 11 Bài 8: Amoniac và muối amoni
Hoá học 11 Bài 8: Amoniac và muối amoni  Hoá học 11 Bài 9: Axit nitric và muối nitrat
Hoá học 11 Bài 9: Axit nitric và muối nitrat  Hoá học 11 Bài 10: Photpho
Hoá học 11 Bài 10: Photpho  Hoá học 11 Bài 12: Phân bón hóa học
Hoá học 11 Bài 12: Phân bón hóa học  Hoá học 11 Bài 13: Luyện tập Tính chất của nitơ, photpho và các hợp chất của chúng ADSENSE ADMICRO Bộ đề thi nổi bật
Hoá học 11 Bài 13: Luyện tập Tính chất của nitơ, photpho và các hợp chất của chúng ADSENSE ADMICRO Bộ đề thi nổi bật  UREKA AANETWORK
UREKA AANETWORK 
XEM NHANH CHƯƠNG TRÌNH LỚP 11
Toán 11
Toán 11 Kết Nối Tri Thức
Toán 11 Chân Trời Sáng Tạo
Toán 11 Cánh Diều
Giải bài tập Toán 11 KNTT
Giải bài tập Toán 11 CTST
Trắc nghiệm Toán 11
Ngữ văn 11
Ngữ Văn 11 Kết Nối Tri Thức
Ngữ Văn 11 Chân Trời Sáng Tạo
Ngữ Văn 11 Cánh Diều
Soạn Văn 11 Kết Nối Tri Thức
Soạn Văn 11 Chân Trời Sáng Tạo
Văn mẫu 11
Tiếng Anh 11
Tiếng Anh 11 Kết Nối Tri Thức
Tiếng Anh 11 Chân Trời Sáng Tạo
Tiếng Anh 11 Cánh Diều
Trắc nghiệm Tiếng Anh 11 KNTT
Trắc nghiệm Tiếng Anh 11 CTST
Tài liệu Tiếng Anh 11
Vật lý 11
Vật lý 11 Kết Nối Tri Thức
Vật Lý 11 Chân Trời Sáng Tạo
Vật lý 11 Cánh Diều
Giải bài tập Vật Lý 11 KNTT
Giải bài tập Vật Lý 11 CTST
Trắc nghiệm Vật Lý 11
Hoá học 11
Hoá học 11 Kết Nối Tri Thức
Hoá học 11 Chân Trời Sáng Tạo
Hoá Học 11 Cánh Diều
Giải bài tập Hoá 11 KNTT
Giải bài tập Hoá 11 CTST
Trắc nghiệm Hoá học 11
Sinh học 11
Sinh học 11 Kết Nối Tri Thức
Sinh Học 11 Chân Trời Sáng Tạo
Sinh Học 11 Cánh Diều
Giải bài tập Sinh học 11 KNTT
Giải bài tập Sinh học 11 CTST
Trắc nghiệm Sinh học 11
Lịch sử 11
Lịch Sử 11 Kết Nối Tri Thức
Lịch Sử 11 Chân Trời Sáng Tạo
Giải bài tập Sử 11 KNTT
Giải bài tập Sử 11 CTST
Trắc nghiệm Lịch Sử 11
Địa lý 11
Địa Lý 11 Kết Nối Tri Thức
Địa Lý 11 Chân Trời Sáng Tạo
Giải bài tập Địa 11 KNTT
Giải bài tập Địa 11 CTST
Trắc nghiệm Địa lý 11
GDKT & PL 11
GDKT & PL 11 Kết Nối Tri Thức
GDKT & PL 11 Chân Trời Sáng Tạo
Giải bài tập KTPL 11 KNTT
Giải bài tập KTPL 11 CTST
Trắc nghiệm GDKT & PL 11
Công nghệ 11
Công nghệ 11 Kết Nối Tri Thức
Công nghệ 11 Cánh Diều
Giải bài tập Công nghệ 11 KNTT
Giải bài tập Công nghệ 11 Cánh Diều
Trắc nghiệm Công nghệ 11
Tin học 11
Tin học 11 Kết Nối Tri Thức
Tin học 11 Cánh Diều
Giải bài tập Tin học 11 KNTT
Giải bài tập Tin học 11 Cánh Diều
Trắc nghiệm Tin học 11
Cộng đồng
Hỏi đáp lớp 11
Tư liệu lớp 11
Xem nhiều nhất tuần
Đề thi HK1 lớp 11
Đề thi giữa HK1 lớp 11
Đề thi HK2 lớp 12
Đề thi giữa HK2 lớp 11
Video bồi dưỡng HSG môn Toán
Công nghệ 11 Bài 16: Công nghệ chế tạo phôi
Vội vàng
Lưu biệt khi xuất dương
Văn mẫu và dàn bài hay về bài thơ Đây thôn Vĩ Dạ
Cấp số cộng
Giới hạn của dãy số
Giới hạn của dãy số
Hầu trời- Tản Đà
Cấp số nhân
YOMEDIA YOMEDIA ×Thông báo
Bạn vui lòng đăng nhập trước khi sử dụng chức năng này.
Bỏ qua Đăng nhập ×Thông báo
Bạn vui lòng đăng nhập trước khi sử dụng chức năng này.
Đồng ý ATNETWORK ON QC Bỏ qua >>
QC Bỏ qua >> Từ khóa » Sơ đồ Tư Duy Bài Axit Photphoric Và Muối Photphat
-
Lý Thuyết Axit Photphoric Và Muối Photphat. | SGK Hóa Lớp 11
-
Lý Thuyết Hóa 11: Bài 11. Axit Photphoric Và Muối Photphat
-
Top 13 Hóa 11 Bài 11 Sơ đồ Tư Duy 2022
-
Giải Hóa Học 11 Bài 11: Axit Photphoric Và Muối Photphat
-
Axit Photphoric Và Muối Photphat
-
Lý Thuyết Axit Photphoric Và Muối Photphat. - Học Tốt
-
Giai Bai Tap Mon Hoa Hoc Lop 11 Bai 11 Axit Photphoric Va Muoi ...
-
SƠ ĐỒ TƯ DUY TRONG LỚP HỌC ĐẢO NGƯỢC NHẰM PHÁT ...
-
Soạn Hoá Học 11 Bài 11: Axit Photphoric Và Muối Photphat
-
Thiết Kế Grap Và Lập Sơ đồ Tư Duy Nội Dung Kiến Thức Cần Nhớ Bài ôn ...
-
Bài Giảng Axit Nitric Và Muối Nitrat - Hóa Học 11 - CungHocVui