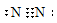Hoá Học 11 Bài 7: Nitơ - Hoc247
Có thể bạn quan tâm
Nitơ là nguyên tố có nhiều chuyện lạ: nó là 1 khí không duy trì sự sống nhưng không có cuộc sống nào lại không có mặt nitơ. Lịch sử tìm ra nitơ gắn liền việc tìm ra thành phần không khí và các chất khí như oxi, hiđro. Lúc đầu người ta đặt tên nitơ là azot (nghĩa là ko duy trì sự sống), về sau phát hiện nó chứa trong diêm tiêu nên đặt tên là NITROGEN (sinh ra diêm tiêu). Vậy nitơ có cấu tạo và tính chất như thế nào, dựa vào đó chúng ta sẽ biết những ứng dụng của nitơ trong sản xuất và đời sống. Vậy Nitơ có tính chất vật lí, hóa học, cách điều chế như thế nào chúng ta cùng nhau đi vào nội dung bài học ngày hôm nay.
ATNETWORK YOMEDIA1. Tóm tắt lý thuyết
1.1. Vị trí và cấu hình electron nguyên tử
1.2. Tính chất vật lí
1.3. Tính chất hóa học
1.4. Ứng dụng
1.5. Trạng thái tự nhiên
1.6. Điều chế
2. Bài tập minh hoạ
3. Luyện tập Bài 7 Hóa học 11
3.1. Trắc nghiệm
3.2. Bài tập SGK và Nâng cao
4. Hỏi đáp về Bài 7 Chương 2 Hóa học 11

Tóm tắt lý thuyết
1.1. Vị trí và cấu hình electron nguyên tử
- Vị trí nitơ: ô thứ 7, chu kỳ 2, nhóm VA.
- Cấu hình e: 1s22s22p3
- Cấu tạo phân tử nitơ:
- CTPT: N2.
- Công thức electron:
- CTCT: N≡N
⇒ 2 nguyên tử trong phân tử nitơ có 3 liên kết cộng hóa trị không cực.
1.2. Tính chất vật lí
Ở đk thường:
- Là chất khí không màu, không mùi, không vị.
- dN2/ kk = 28/29 ⇒ hơi nhẹ hơn kk.
- Hóa lỏng ở -1960C, hóa rắn ở -2100C.
- Rất ít tan trong nước.
- Không duy trì sự cháy và sự sống.
1.3. Tính chất hóa học
- Nitơ là phi kim khá hoạt động (độ âm điện = 3), nhưng ở nhiệt độ thường khá trơ về mặt hóa học. Do 2 nguyên tử N liên kết với nhau bằng 1liên kết ba không phân cực nên rất bền do năng lượng liên kết lớn, nên nitơ khá trơ về mặt hóa học ở nhiệt độ thường.
- Số oxi hóa của nitơ trong hợp chất với hidro, kim loại là -3, trong hợp chất với oxi, flo là từ +1 → +5.
-
Tùy thuộc vào sự thay đổi số oxi hóa, nitơ có thể thể hiện tính khử hay tính oxi hóa. (chủ yếu là tính oxi hóa).
a. Tính oxi hóa
* Tác dụng với kim loại: (kim loại mạnh như Li, Na, K, Mg, Ba...)
- Liti là kim loại duy nhất tác dụng được với Nitơ ở nhiệt độ thường: \(6\mathop {Li}\limits^0 + \mathop {{N_2}}\limits^0 \to 2\mathop {L{i_3}}\limits^{ + 1} \mathop N\limits^{ - 3}\)(Liti nitrua)
- Ở nhiệt độ cao, Nitơ tác dụng được với một số kim loại hoạt động như Ca, Mg, Al tạo nitrua kim loại:
\(3\mathop {Mg}\limits^0 + \mathop {{N_2}}\limits^0\) 
*Tác dụng với hidro: \(3\mathop {{H_2}}\limits^0 + \mathop {{N_2}}\limits^0\)
b. Tính khử

Hình 1: Sấm chớp cung cấp năng lượng cho phản ứng giữa Nito và Oxi
- ở nhiệt độ khoảng 30000C (hoặc hồ quang điện, hoặc tia lửa điện hình thành sấm sét) đã cung cấp năng lượng cho phản ứng nitơ kết hợp trực tiếp với O2 tạo nitơ monoxit NO
\(\mathop {{N_2}}\limits^0 + \mathop {{O_2}}\limits^0\)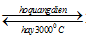
-
NO kết hợp dễ dàng với oxi: 2NO + O2 \(\rightleftharpoons\) 2NO2
-
Một số oxit khác của nitơ như: N2O, N2O3, N2O5 chúng ko điều chế trực tiếp từ nitơ và oxi.
* Kết luận: N2 thể hiện tính khử khi td với nguyên tố có độ âm điện lớn hơn (như O2), thể hiện tính oxi hóa khi tác dụng với nguyên tố có độ âm điện nhỏ hơn như (kim loại mạnh, H2).
1.4. Ứng dụng
- Là thành phần cấu tạo nên protêin, thành phần dinh dưỡng chính của thực vật. N2 có nhiệt độ sôi thấp nên dùng làm lạnh trong công nghiệp và trong phòng thí nghiệm.
- Công nghiệp:
- Tổng hợp NH3, sản xuất HNO3, phân đạm…
- Môi trường trơ trong luyện kim, thực phẩm, điện tử…
- Y tế: N2 lỏng: bảo quản mẫu máu, các mẫu vật sinh học khác…
- Dựa vào tính trơ của nitơ mà bảo quan tranh vẽ trong viện bảo tàng chứa đầy khí nitơ trong ống của cuộn tranh tránh các phân tử khác bị oxi hóa hư màu vẽ.
- Bơm vào bóng đèn điện để giảm sự bốc hơi kim loại trên bề mặt dây tóc.
- Bơm nitơ vào phổi bệnh nhân lao để ép lá phổi cho nó nghỉ ngơi…
1.5. Trạng thái tự nhiên
Hình 2: Phần trăm mỗi đồng vị của Nito
- Ở dạng hợp chất, nitơ có nhiều trong khoáng chất natri nitrat NaNO3 với tên gọi là diêm tiêu natri
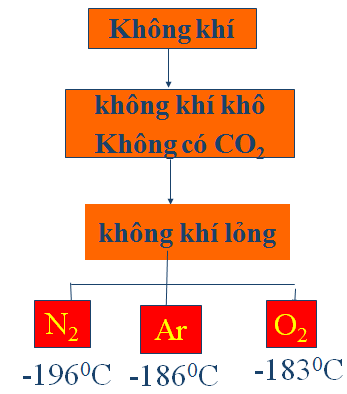
1.6. Điều chế
a. Trong công nghiệp
Hình 3: Chưng cất phân đoạn không khí lỏng
b. Trong phòng thí nghiệm
NH4NO2 .PNG)
NH4Cl + NaNO2.PNG)
Bài tập minh họa
Bài 1:
Hãy nêu số oxi hóa của nitơ các chất sau: NH3, Mg3N2, N2, N2O, NO, NF3, NO2, HNO3. Nhận xét số oxi hóa của nitơ trong hợp chất với hidro, kim loại và trong hợp chất với oxi, flo?
Hướng dẫn:
- Số oxi hóa của N ở các chất NH3, Mg3N2, N2, N2O, NO, NF3, NO2, HNO3 lần lượt là: (-3), (-3), (0), (+1), (+2), (+3), (+4), (+5)
- Số oxi hóa của nitơ trong hợp chất với hidro, kim loại là -3, trong hợp chất với oxi, flo là từ +1 → +5.
3. Luyện tập Bài 7 Hóa học 11
Sau bài học cần nắm:
- vị trí của nitơ trong bảng tuần hoàn
- cấu hình electron và cấu tạo phân tử nitơ
- tính chất hóa học của nitơ, ứng dụng của nitơ và điều chế nitơ.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 11 Bài 7 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
Câu 1:
Nitơ phản ứng với tất cả các chất trong dãy chất nào dưới đây?
- A. H2, Li, O2, Ag
- B. H2, Li, O2, Cu
- C. H2, Na, O2, Mg.
- D. H2, Li, O2, Hg.
-
Câu 2:
Câu nào sai ?
- A. Phân tử N2 bền ở nhiệt độ thường.
- B. Phân tử N2 có liên kết ba giữa 2 nguyên tử.
- C. Phân tử N2 còn 1 cặp e chưa tham gia liên kết.
- D. Phân tử N2 có năng lượng liên kết lớn.
-
Câu 3:
Nhận xét nào sau đây là đúng?
- A. N2 thể hiện tính khử khi tác dụng với H2, kim loại.
- B. N2 thể hiện tính oxi hóa khi tác dụng với Cu.
- C. N2 thể hiện tính oxi hóa khi tác dụng với O2.
- D. N2 thể hiện tính oxi hóa khi tác dụng với kim loại mạnh và hiđro, thể hiện tính khử khi tác dụng với O2.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 11 Bài 7.
Bài tập 1 trang 31 SGK Hóa học 11
Bài tập 2 trang 31 SGK Hóa học 11
Bài tập 3 trang 31 SGK Hóa học 11
Bài tập 4 trang 31 SGK Hóa học 11
Bài tập 5 trang 31 SGK Hóa học 11
Bài tập 7.1 trang 10 SBT Hóa học 11
Bài tập 7.2 trang 10 SBT Hóa học 11
Bài tập 7.3 trang 10 SBT Hóa học 11
Bài tập 7.4 trang 10 SBT Hóa học 11
Bài tập 7.5 trang 11 SBT Hóa học 11
Bài tập 7.6 trang 11 SBT Hóa học 11
Bài tập 7.7 trang 11 SBT Hóa học 11
Bài tập 1 trang 40 SGK Hóa học 11 nâng cao
Bài tập 2 trang 40 SGK Hóa học 11 nâng cao
Bài tập 3 trang 40 SGK Hóa học 11 nâng cao
Bài tập 4 trang 40 SGK Hóa học 11 nâng cao
Bài tập 5 trang 40 SGK Hóa học 11 nâng cao
Bài tập 6 trang 40 SGK Hóa học 11 nâng cao
4. Hỏi đáp về Bài 7 Chương 2 Hóa học 11
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
 NONE
NONE Bài học cùng chương
 Hoá học 11 Bài 8: Amoniac và muối amoni
Hoá học 11 Bài 8: Amoniac và muối amoni  Hoá học 11 Bài 9: Axit nitric và muối nitrat
Hoá học 11 Bài 9: Axit nitric và muối nitrat  Hoá học 11 Bài 10: Photpho
Hoá học 11 Bài 10: Photpho  Hoá học 11 Bài 11: Axit photphoric và muối photphat
Hoá học 11 Bài 11: Axit photphoric và muối photphat  Hoá học 11 Bài 12: Phân bón hóa học
Hoá học 11 Bài 12: Phân bón hóa học  Hoá học 11 Bài 13: Luyện tập Tính chất của nitơ, photpho và các hợp chất của chúng ADSENSE TRACNGHIEM
Hoá học 11 Bài 13: Luyện tập Tính chất của nitơ, photpho và các hợp chất của chúng ADSENSE TRACNGHIEM  Bộ đề thi nổi bật
Bộ đề thi nổi bật  UREKA AANETWORK
UREKA AANETWORK 
XEM NHANH CHƯƠNG TRÌNH LỚP 11
Toán 11
Toán 11 Kết Nối Tri Thức
Toán 11 Chân Trời Sáng Tạo
Toán 11 Cánh Diều
Giải bài tập Toán 11 KNTT
Giải bài tập Toán 11 CTST
Trắc nghiệm Toán 11
Ngữ văn 11
Ngữ Văn 11 Kết Nối Tri Thức
Ngữ Văn 11 Chân Trời Sáng Tạo
Ngữ Văn 11 Cánh Diều
Soạn Văn 11 Kết Nối Tri Thức
Soạn Văn 11 Chân Trời Sáng Tạo
Văn mẫu 11
Tiếng Anh 11
Tiếng Anh 11 Kết Nối Tri Thức
Tiếng Anh 11 Chân Trời Sáng Tạo
Tiếng Anh 11 Cánh Diều
Trắc nghiệm Tiếng Anh 11 KNTT
Trắc nghiệm Tiếng Anh 11 CTST
Tài liệu Tiếng Anh 11
Vật lý 11
Vật lý 11 Kết Nối Tri Thức
Vật Lý 11 Chân Trời Sáng Tạo
Vật lý 11 Cánh Diều
Giải bài tập Vật Lý 11 KNTT
Giải bài tập Vật Lý 11 CTST
Trắc nghiệm Vật Lý 11
Hoá học 11
Hoá học 11 Kết Nối Tri Thức
Hoá học 11 Chân Trời Sáng Tạo
Hoá Học 11 Cánh Diều
Giải bài tập Hoá 11 KNTT
Giải bài tập Hoá 11 CTST
Trắc nghiệm Hoá học 11
Sinh học 11
Sinh học 11 Kết Nối Tri Thức
Sinh Học 11 Chân Trời Sáng Tạo
Sinh Học 11 Cánh Diều
Giải bài tập Sinh học 11 KNTT
Giải bài tập Sinh học 11 CTST
Trắc nghiệm Sinh học 11
Lịch sử 11
Lịch Sử 11 Kết Nối Tri Thức
Lịch Sử 11 Chân Trời Sáng Tạo
Giải bài tập Sử 11 KNTT
Giải bài tập Sử 11 CTST
Trắc nghiệm Lịch Sử 11
Địa lý 11
Địa Lý 11 Kết Nối Tri Thức
Địa Lý 11 Chân Trời Sáng Tạo
Giải bài tập Địa 11 KNTT
Giải bài tập Địa 11 CTST
Trắc nghiệm Địa lý 11
GDKT & PL 11
GDKT & PL 11 Kết Nối Tri Thức
GDKT & PL 11 Chân Trời Sáng Tạo
Giải bài tập KTPL 11 KNTT
Giải bài tập KTPL 11 CTST
Trắc nghiệm GDKT & PL 11
Công nghệ 11
Công nghệ 11 Kết Nối Tri Thức
Công nghệ 11 Cánh Diều
Giải bài tập Công nghệ 11 KNTT
Giải bài tập Công nghệ 11 Cánh Diều
Trắc nghiệm Công nghệ 11
Tin học 11
Tin học 11 Kết Nối Tri Thức
Tin học 11 Cánh Diều
Giải bài tập Tin học 11 KNTT
Giải bài tập Tin học 11 Cánh Diều
Trắc nghiệm Tin học 11
Cộng đồng
Hỏi đáp lớp 11
Tư liệu lớp 11
Xem nhiều nhất tuần
Đề thi HK1 lớp 11
Đề thi HK2 lớp 12
Đề thi giữa HK1 lớp 11
Đề thi giữa HK2 lớp 11
Video bồi dưỡng HSG môn Toán
Công nghệ 11 Bài 16: Công nghệ chế tạo phôi
Đây thôn Vĩ Dạ
Từ ấy
Cấp số nhân
Văn mẫu và dàn bài hay về bài thơ Đây thôn Vĩ Dạ
Cấp số cộng
YOMEDIA YOMEDIA ×Thông báo
Bạn vui lòng đăng nhập trước khi sử dụng chức năng này.
Bỏ qua Đăng nhập ×Thông báo
Bạn vui lòng đăng nhập trước khi sử dụng chức năng này.
Đồng ý ATNETWORK ON QC Bỏ qua >>
QC Bỏ qua >> 
Từ khóa » Bài Nito
-
Hóa Học 11: Tổng Hợp Lí Thuyết Chương Nitơ - Photpho Đầy Đủ ...
-
Bài 7. Nitơ
-
Soạn Hoá Học 11 Bài 7: Nitơ | Học Cùng
-
Lý Thuyết Hóa 11: Bài 7. Nitơ - Toploigiai
-
Giải Hóa 11 Bài 7 : Nitơ
-
Nito - Bài 7 - Hóa Học 11 - Cô Nguyễn Nhàn (HAY NHẤT) - YouTube
-
Hướng Dẫn Giải Bài Tập Về Nitơ Và Các Hợp Chất - Baitap123
-
Giải Bài Tập Hóa Học 11 - Bài 7 : Nitơ
-
Top 7 Bài Nito Lớp 11
-
Khí Nitơ (N2): Chi Tiết Lý Thuyết Và Bài Tập áp Dụng - Monkey
-
Hóa 11 Bài 7: Nitơ
-
Giáo án Hóa Học 11 - Bài: Nito
-
Giải Bài 7: Nitơ | Hóa Lớp 11 (Trang 28 - 31) - Tech12h
-
Giải Bài Tập SGK Bài 7: NiTơ - Chương 2 - Hóa Học Lớp 11