Hoá Học 12 Bài 20: Sự ăn Mòn Kim Loại - HOC247
Có thể bạn quan tâm
Bài học cung cấp các kiến thức về Ăn mòn; Biết được Ăn mòn là gì, các dạng ăn mòn kim loại gồm những loại nào cũng như cách chống ăn mòn.
ATNETWORK YOMEDIA1. Video bài giảng
2. Tóm tắt lý thuyết
2.1. Khái niệm về Ăn mòn kim loại
2.2. Các dạng ăn mòn
2.3. Chống ăn mòn kim loại
3. Bài tập minh hoạ
3.1. Bài tập Sự ăn mòn kim loại - Cơ bản
3.2. Bài tập Sự ăn mòn kim loại - Nâng cao
4. Luyện tập bài 20 Hóa học 12
4.1. Trắc nghiệm
4.2. Bài tập SGK & Nâng cao
5. Hỏi đáp về Bài 20 Chương 5 Hoá học 12

Tóm tắt lý thuyết
2.1. Khái niệm về Ăn mòn kim loại
- Sự ăn mòn kim loại là sự phá huỷ kim loại hoặc hợp kim do tác dụng của các chất trong môi trường xung quanh
- Kim loại bị oxi hoá thành ion dương
M → Mn+ + ne
2.2. Các dạng ăn mòn
a. Ăn mòn hóa học.
Ví dụ: Cổng sắt bị rỉ sét do ăn mòn hóa học:
\(3Fe+2O_{2}\overset{t^{0}}{\rightarrow}Fe_{3}O_{4}\)
\(3Fe+2H_{2}O\overset{t^{0}}{\rightarrow}Fe_{3}O_{4}+2H_{2}\)

⇒ Ăn mòn hoá học là quá trình oxi hoá – khử, trong đó các electron của kim loại được chuyển trực tiếp đến các chất trong môi trường.
b. Ăn mòn điện hóa học
Thí nghiệm: Ăn mòn điện hóa với 2 điện cực là Zn và Cu
- Giải thích hiện tượng:
+ Điện cực âm (anot); Zn bị ăn mòn theo phản ứng: Zn → Zn2+ + 2e. Ion Zn2+ đi vào dung dịch, các electron theo dây dẫn sang điện cực Cu.
+ Điện cực dương (catot): ion H+ của dung dịch H2SO4 nhận electron biến thành nguyên tử H rồi thành phân tử H2 thoát ra. 2H+ + 2e → H2
- Ăn mòn điện hoá là quá trình oxi hoá – khử, trong đó kim loại bị ăn mòn do tác dụng của dung dịch chất điện li và tạo nên dòng electron chuyển dời từ cực âm đến cực dương.
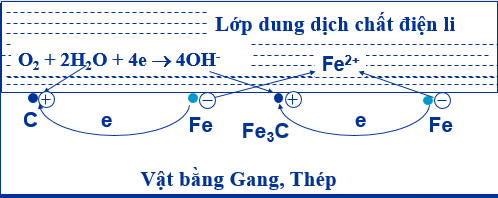
- Ăn mòn điện hoá học hợp kim sắt trong không khí ẩm
- Tại anot: Fe → Fe2+ + 2e; Tại catot: O2 + 2H2O + 4e → 4OH-
- Điều kiện để xảy ra ăn mòn điện hóa học
+ Các điện cực phải khác nhau về bản chất. Cặp KL – KL; KL – PK; KL – Hợp chất hoá học
+ Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp qua dây dẫn.
+ Các điện cực cùng tiếp xúc với một dung dịch chất điện li.
2.3. Chống ăn mòn kim loại
a. Phương pháp bảo vệ bề mặt
- Dùng những chất bền vững với môi trường để phủ mặt ngoài những đồ vật bằng kim loại như bôi dầu mỡ, sơn, mạ, tráng men,…
- Ví dụ: Mạ tượng, sơn phủ bên ngoài đồ vật,...


b. Phương pháp điện hóa
- Nối kim loại cần bảo vệ với một kim loại hoạt động hơn để tạo thành pin điện hoá và kim loại hoạt động hơn sẽ bị ăn mòn, kim loại kia được bảo vệ.
- Ví dụ: Bảo vệ vỏ tàu biển làm bằng thép bằng cách gán vào mặt ngoài của vỏ tàu (phần chìm dưới nước) những khối Zn, kết quả là Zn bị nước biển ăn mòn thay cho thép.
Bài tập minh họa
3.1. Bài tập Sự ăn mòn kim loại - Cơ bản
Bài 1:
Cho các hợp kim sau: Cu-Fe (I); Zn-Fe (II); Fe-C (III); Sn-Fe (IV). Khi tiếp xúc với dung dịch chất điện li thì các hợp kim mà trong đó Fe đều bị ăn mòn trước là:
Hướng dẫn:
- Trong cặp điện cực: kim loại – kim loại thì kim loại nào có tính khử mạnh hơn đóng vai trò là cực âm (anot) thì kim loại đó bị ăn mòn khi tiếp xúc với dung dịch chất điện li. (Mẹo: Dựa vào dãy điện hóa của kim loại. .Cái nào càng mạnh thì càng bị ăn mòn. Ví dụ như cặp Cu - Fe. Fe là kim loại mạnh hơn Cu nên Fe bị ăn mòn)
- Trong cặp điện cực: kim loại – phi kim thường hay gặp nhất là Fe – C thì kim loại đóng vai trò là cực âm và bị ăn mòn khi tiếp xúc với dung dịch chất điện li.
- Do vậy các cặp hợp kim thỏa mãn là: I, III, IV.
Bài 2:
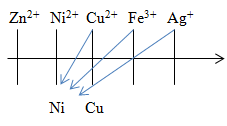
Có 4 dung dịch riêng biệt: CuSO4, ZnCl2, FeCl3, AgNO3. Nhúng vào mỗi dung dịch một thanh Ni. Số trường hợp xuất hiện ăn mòn điện hoá là
Hướng dẫn:
Ăn mòn điện hóa
điều kiện: 2 kim loại, kim loại - phi kim (gang, thép)
Ni + Cu2+ \(\rightarrow\) Ni2+ + Cu\(\downarrow\)
Ni + Fe3+ \(\rightarrow\) Ni2+ + Fe2+
Ni + Ag+ \(\rightarrow\) Ni2+ + Ag\(\downarrow\)
Vậy số trường ăn mòn điện hóa là 2.
Bài 3:
Nhúng thanh kim loại Fe vào các dung dịch sau: FeCl3; CuCl2; H2SO4 (loãng) + CuSO4; H2SO4 loãng; AgNO3. Số trường hợp thanh kim loại sắt tan theo cơ chế ăn mòn điện hóa là:
Hướng dẫn:
CuCl2; H2SO4 loãng + CuSO4; AgNO3
3.2. Bài tập Sự ăn mòn kim loại - Nâng cao
Bài 1:
Cho hỗn hợp X gồm 0,56 gam Fe và Mg tác dụng với 250 ml dung dịch CuSO4. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,92 gam kim loại. Nồng độ mol/l của dung dịch CuSO4 là:
Hướng dẫn:
Sử dụng phương pháp tăng giảm khối lượng :
\(\begin{array}{l} {n_{Mg}}.\Delta {M_{Cu - Mg}} + {n_{Fe(p/u)}}.\Delta {M_{Cu - Fe}} = {m_{ran}} - {m_{Fe,Mg(ban{\rm{ d}}au)}}\\ \Leftrightarrow 0,005.40 + 8{\rm{x}} = 0,24\\ \Rightarrow x = 0,005 \end{array}\)
Bảo toàn electron:
\({n_{CuS{O_4}}} = {n_{Mg}} + {n_{Fe(p/u)}} = 0,01(mol) \Rightarrow {C_M} = 0,04M\)
Bài 2:
Cho một thanh sắt có khối lượng m gam vào dung dịch chứa 0,012 mol AgNO3 và 0,02 mol Cu(NO3)2, sau một thời gian khối lượng của thanh sắt là (m + 1,04) gam. Tính khối lượng của kim loại bám trên thanh sắt?
Hướng dẫn:
Fe + 2Ag+ → Fe2+ + 2Ag Fe + Cu2+ → Fe2+ + Cu Nếu chỉ có Ag phản ứng ⇒ mKL tăng = 0,012 × 108 - 0,006 × 56 = 0,96 g < 1,04 g Có x mol Cu2+ phản ứng ⇒ mKL tăng = 1,04 = (0,012 × 108 + 64x) - (0,006 + x) × 56 ⇒ x = 0,01 mol ⇒ mKL bám = mAg + mCu = 1,936 g
4. Luyện tập Bài 20 Hóa học 12
Sau bài học cần nắm:
- Ăn mòn là gì
- các dạng ăn mòn kim loại gồm những loại nào?
- Biện pháp chống ăn mòn
4.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 12 Bài 20 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
Câu 1:
Người ta gắn tấm Zn vào vỏ ngoài của tàu thủy ở phần chìm trong nước biển để:
- A. Chống ăn mòn kim loại bằng phương pháp điện hóa.
- B. Chống ăn mòn kim loại bằng phương pháp cách li kim loại với môi trường.
- C. Vỏ tàu được chắc hơn.
- D. Chống ăn mòn bằng cách dùng chất chống ăn mòn.
-
Câu 2:
Sắt tây là sắt tráng Thiếc. Nếu lớp thiếc bị xước sâu tới lớp sắt thì kim loại bị ăn mòn trước là:
- A. Thiếc
- B. Sắt
- C. Cả hai đều bị ăn mòn như nhau
- D. Không kim loại nào bị ăn mòn
-
Câu 3:
Khi hoà tan b gam oxit kim loại hóa trị II bằng một lượng vừa đủ axit dung dịch H2SO4 15,8%, thu được dung dịch muối có nồng độ 18,21%. Vậy kim loại hoá trị II là:
- A. Be
- B. Mg
- C. Ba
- D. Ca
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
4.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 12 Bài 20.
Bài tập 1 trang 95 SGK Hóa học 12
Bài tập 2 trang 95 SGK Hóa học 12
Bài tập 3 trang 95 SGK Hóa học 12
Bài tập 4 trang 95 SGK Hóa học 12
Bài tập 5 trang 95 SGK Hóa học 12
Bài tập 6 trang 95 SGK Hóa học 12
Bài tập 1 trang 136 SGK Hóa học 12 nâng cao
Bài tập 2 trang 136 SGK Hóa 12 Nâng cao
Bài tập 3 trang 136 SGK Hóa 12 Nâng cao
Bài tập 4 trang 136 SGK Hóa học 12 nâng cao
Bài tập 5 trang 136 SGK Hóa 12 Nâng cao
Bài tập 20.1 trang 43 SBT Hóa học 12
Bài tập 20.2 trang 43 SBT Hóa học 12
Bài tập 20.3 trang 43 SBT Hóa học 12
Bài tập 20.4 trang 43 SBT Hóa học 12
Bài tập 20.5 trang 44 SBT Hóa học 12
Bài tập 20.6 trang 44 SBT Hóa học 12
Bài tập 20.7 trang 44 SBT Hóa học 12
Bài tập 20.8 trang 44 SBT Hóa học 12
Bài tập 20.9 trang 44 SBT Hóa học 12
Bài tập 20.10 trang 44 SBT Hóa học 12
Bài tập 20.11 trang 44 SBT Hóa học 12
Bài tập 20.12 trang 45 SBT Hóa học 12
Bài tập 20.13 trang 45 SBT Hóa học 12
Bài tập 20.14 trang 45 SBT Hóa học 12
Bài tập 20.15 trang 45 SBT Hóa học 12
Bài tập 20.16 trang 45 SBT Hóa học 12
Bài tập 20.17 trang 45 SBT Hóa học 12
Bài tập 20.18 trang 45 SBT Hóa học 12
Bài tập 20.19 trang 45 SBT Hóa học 12
Bài tập 20.20 trang 46 SBT Hóa học 12
Bài tập 20.21 trang 46 SBT Hóa học 12
5. Hỏi đáp về Bài 20 Chương 5 Hoá học 12
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
 NONE
NONE Bài học cùng chương
 Hoá học 12 Bài 17: Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại
Hoá học 12 Bài 17: Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại  Hoá học 12 Bài 18: Tính chất của kim loại và Dãy điện hóa của kim loại
Hoá học 12 Bài 18: Tính chất của kim loại và Dãy điện hóa của kim loại  Hoá học 12 Bài 19: Hợp kim
Hoá học 12 Bài 19: Hợp kim  Hoá học 12 Bài 21: Điều chế kim loại
Hoá học 12 Bài 21: Điều chế kim loại  Hoá học 12 Bài 22: Luyện tập Tính chất của kim loại
Hoá học 12 Bài 22: Luyện tập Tính chất của kim loại  Hoá học 12 Bài 23: Luyện tập Điều chế kim loại và sự ăn mòn kim loại ADSENSE TRACNGHIEM
Hoá học 12 Bài 23: Luyện tập Điều chế kim loại và sự ăn mòn kim loại ADSENSE TRACNGHIEM  Bộ đề thi nổi bật
Bộ đề thi nổi bật  UREKA AANETWORK
UREKA AANETWORK 
XEM NHANH CHƯƠNG TRÌNH LỚP 12
Toán 12
Lý thuyết Toán 12
Giải bài tập SGK Toán 12
Giải BT sách nâng cao Toán 12
Trắc nghiệm Toán 12
Ôn tập Hình học 12 Chương 3
Ngữ văn 12
Lý thuyết Ngữ Văn 12
Soạn văn 12
Soạn văn 12 (ngắn gọn)
Văn mẫu 12
Soạn bài Rừng xà nu
Tiếng Anh 12
Giải bài Tiếng Anh 12
Giải bài Tiếng Anh 12 (Mới)
Trắc nghiệm Tiếng Anh 12
Unit 13 Lớp 12 The 22nd Sea Game
Tiếng Anh 12 mới Unit 6
Vật lý 12
Lý thuyết Vật Lý 12
Giải bài tập SGK Vật Lý 12
Giải BT sách nâng cao Vật Lý 12
Trắc nghiệm Vật Lý 12
Vật lý 12 Chương 5
Hoá học 12
Lý thuyết Hóa 12
Giải bài tập SGK Hóa 12
Giải BT sách nâng cao Hóa 12
Trắc nghiệm Hóa 12
Hoá Học 12 Chương 6
Sinh học 12
Lý thuyết Sinh 12
Giải bài tập SGK Sinh 12
Giải BT sách nâng cao Sinh 12
Trắc nghiệm Sinh 12
Sinh Học 12 Chương 3 Sinh thái học
Lịch sử 12
Lý thuyết Lịch sử 12
Giải bài tập SGK Lịch sử 12
Trắc nghiệm Lịch sử 12
Lịch Sử 12 Chương 4 Lịch Sử VN
Địa lý 12
Lý thuyết Địa lý 12
Giải bài tập SGK Địa lý 12
Trắc nghiệm Địa lý 12
Địa Lý 12 PT và PB nông nghiệp
GDCD 12
Lý thuyết GDCD 12
Giải bài tập SGK GDCD 12
Trắc nghiệm GDCD 12
GDCD 12 Học kì 2
Công nghệ 12
Lý thuyết Công nghệ 12
Giải bài tập SGK Công nghệ 12
Trắc nghiệm Công nghệ 12
Công nghệ 12 Chương 5
Tin học 12
Lý thuyết Tin học 12
Giải bài tập SGK Tin học 12
Trắc nghiệm Tin học 12
Tin học 12 Chương 4
Cộng đồng
Hỏi đáp lớp 12
Tư liệu lớp 12
Xem nhiều nhất tuần
Video: Vợ nhặt của Kim Lân
Video ôn thi THPT QG môn Hóa
Video ôn thi THPT QG môn Toán
Video ôn thi THPT QG môn Văn
Video ôn thi THPT QG môn Sinh
Video ôn thi THPT QG môn Vật lý
Video ôn thi THPT QG Tiếng Anh
Rừng xà nu
Việt Bắc
Vợ chồng A Phủ
Những đứa con trong gia đình
Tuyên Ngôn Độc Lập
Khái quát văn học Việt Nam từ đầu CMT8 1945 đến thế kỉ XX
Vợ Nhặt
Đất Nước- Nguyễn Khoa Điềm
Chiếc thuyền ngoài xa
Tiếng Anh Lớp 12 Unit 11
Tiếng Anh Lớp 12 Unit 12
YOMEDIA YOMEDIA ×Thông báo
Bạn vui lòng đăng nhập trước khi sử dụng chức năng này.
Bỏ qua Đăng nhập ×Thông báo
Bạn vui lòng đăng nhập trước khi sử dụng chức năng này.
Đồng ý ATNETWORK ON QC Bỏ qua >>
QC Bỏ qua >> 
Từ khóa » Khái Niệm ăn Mòn Kim Loại
-
Ăn Mòn Kim Loại Là Gì? - Vina Trade Synergy
-
Lý Thuyết Sự ăn Mòn Kim Loại | SGK Hóa Lớp 12
-
Sự ăn Mòn Kim Loại Là Gì? - LaGi.Wiki
-
Lý Thuyết Sự ăn Mòn Kim Loại: Ăn Mòn Hóa Học Và ăn Mòn điện Hóa
-
Lý Thuyết Về Sự ăn Mòn Kim Loại đầy đủ Chi Tiết Nhất - HocThatGioi
-
Lý Thuyết Hóa 12: Bài 20. Sự ăn Mòn Kim Loại - TopLoigiai
-
KHÁI NIỆM, PHÂN LOẠI VÀ BIỆN PHÁP CHỐNG ĂN MÒN KIM LOẠI
-
Sự ăn Mòn Kim Loại, ăn Mòn Hóa Học, ăn Mòn điện Hóa Và Cách Bảo ...
-
Lý Thuyết ăn Mòn Kim Loại Hóa 12
-
Ăn Mòn Kim Loại Là Gì? Ăn Mòn điện Hóa Ăn Mòn Hóa Học (Tóm Tắt Lý ...
-
Lý Thuyết Khái Niệm ăn Mòn Kim Loại Hóa 12
-
Lý Thuyết ăn Mòn Kim Loại Dễ Hiểu Nhất - Vnkienthuc
-
Sự ăn Mòn Kim Loại - Null - ICAN
-
Bài 20: Sự ăn Mòn Kim Loại - Hoc24