Hợp Chất X Tạo Bởi Hai Nguyên Tố A, B Và Có Phân Tử Khối Là 76. A Và ...
Có thể bạn quan tâm
a. A, B có số oxi hóa cao nhất trong các oxit là +nO và + mO nên lớp ngoài cùng của A, B có số electron là nO và mO.
A, B có số oxi hóa âm trong các hợp chất với hiđro là -nH và - mH nên ta thấy để hoàn thành lớp vỏ bão hòa 8 electron, lớp ngoài cùng của A, B cần nhận thêm số electron là nH và mH.
Như vậy: nO + nH = 8 và mO + mH = 8.
Theo bài: nO = nH và mO = 3mH.
Từ đây tìm được nO = nH = 4, mO = 6, nH = 2.
A có số oxi hóa dương cao nhất là +4 nên A thuộc nhóm IV, B có số oxi hóa dương cao nhất là +6 nên B thuộc nhóm VI.
Trong hợp chất X, A có số oxi hóa +4 (nhường 4 electron) nên một nguyên tử A liên kết với 2 nguyên tử B, trong đó B có số oxi hóa -2.
Công thức phân tử của X là AB2.
Theo bài: khối lượng phân tử của X là 76u nên MA + 2MB = 76u.
→ \({M_B} < \frac{{76u}}{2} = 38u\)
Mặt khác, B thuộc nhóm VI và tạo được số oxi hóa cao nhất trong oxit là +6 nên B là lưu huỳnh. Vậy MB = 32u, suy ra MA = 76u - 2.32u = 12u.
→ A là cacbon.
Công thức của X là CS2.
b. Theo bài, CS2 có cấu trúc thẳng nên nguyên tử C ở trạng thái lai hóa sp.
Cấu hình electron lớp ngoài cùng của nguyên tử lưu huỳnh:
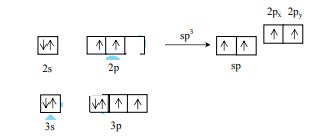
Liên kết trong phân tử CS2 được hình thành như sau:
Hai obitan lai hóa sp của C xen phủ trục với hai obitan 3p chứa electron độc thân của 2 lưu huỳnh tạo thành 2 liên kết xích ma.
Hai obitan 2px, 2py không tham gia lai hóa của C xen phủ bên với hai obitan 3p chứa electron độc thân của 2 lưu huỳnh tạo thành 2 liên kết pi.
Như vậy, nguyên tử cacbon tạo với mỗi nguyên tử lưu huỳnh 1 liên kết xích ma và 1 liên kết pi
Công thức cấu tạo của phân tử CS2 như sau S = C = S
Từ khóa » Nguyên Tử Khối 76
-
Osmi: Nguyên Tố Hóa Học Của Số Nguyên Tử 76 ... - Du Học Trung Quốc
-
Osmi: Nguyên Tố Hóa Học Của Số Nguyên Tử 76 ... - Du Học Trung Quốc
-
Chương 1. Nguyên Tử - Hoc24
-
Nguyên Tử Khối Trung Bình Của Sb Là 121,76. Sb Có 2 đồng Vị Biết
-
Hợp Chất X Tạo Bởi 2 Nguyên Tố AB Và Có Phân Tử Khối Là 76 A
-
Bài 937 - Hóa
-
Nguyên Tử A Có Tổng Số Hạt Cơ Bản Bằng 76 Và Có ... - MTrend
-
Nguyen Tử Khối Trung Bình Của Sb Là 121,76 . Sb Có 2 đồng Vị , Biết ...
-
Hợp Chất X Tạo Bởi Hai Nguyen Tố A, B Có Khối Lượng Phân Tử Là 76.
-
[LỜI GIẢI] Nguyên Tử Khối Trung Bình Của Sb Là 121,76. Sb Có 2 đồng Vị
-
[LỜI GIẢI] Tổng Hạt Trong Nguyên Tử R Là 76 Số Hạt Mang điện Nhiều ...
-
Nguyên Tử Khối Trung Bình Của Sb Là 121,76. Sb Có... - CungHocVui