Kc = 4. Suy Ra Hằng Số Cân Bằng Của Phản ứng Thủy Phân ...
Có thể bạn quan tâm
- TIỂU HỌC
- THCS
- THPT
- ĐẠI HỌC
- HƯỚNG NGHIỆP
- FLASHCARD
- TÀI LIỆU THAM KHẢO
- Trang chủ
- Đại học
- 800+ câu trắc nghiệm môn Hóa học đại cương có lời giải cụ thể
Xét phản ứng: CH3COOH + C2H5OH ⇌ CH3COOC2H5 + H2O; Kc = 4. Suy ra hằng số cân bằng của phản ứng thủy phân CH3COOC2H5 là:
A.K’C = ¼
B.K’C = ½
C.K’C = 4
D.K’C = -4
Trả lời:Đáp án đúng: A
Phản ứng thủy phân CH3COOC2H5 là phản ứng ngược lại của phản ứng este hóa CH3COOH + C2H5OH ⇌ CH3COOC2H5 + H2O. Vì vậy, hằng số cân bằng của phản ứng thủy phân sẽ là nghịch đảo của hằng số cân bằng của phản ứng este hóa. K'c = 1 / Kc = 1 / 4 = 0.25 Vậy, đáp án đúng là K’C = ¼800+ câu trắc nghiệm môn Hóa học đại cương có lời giải cụ thể - Phần 3
Sưu tầm và chia sẻ hơn 850 câu trắc nghiệm môn Hóa học đại cương (kèm đáp án) dành cho các bạn sinh viên, sẽ giúp bạn hệ thống kiến thức chuẩn bị cho kì thi sắp diễn ra. Mời các bạn tham khảo!
50 câu hỏi 60 phút Bắt đầu thiCâu hỏi liên quan
Câu 19:Trong giản đồ pha sau, có bao nhiêu điểm ơtecti:
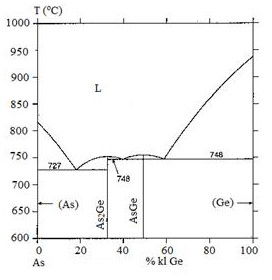
1
B.2
C.3
D.4
Lời giải:Đáp án đúng: CĐiểm ơtecti là điểm mà tại đó hợp kim nóng chảy hoàn toàn ở một nhiệt độ xác định. Trên giản đồ pha, điểm ơtecti là điểm thấp nhất trên đường liquidus. Trong giản đồ pha đã cho, ta thấy có 1 điểm ơtecti.Câu 20:Đại lượng nào sau đây của phản ứng sẽ thay đổi khi được thêm xúc tác:
A.∆H
B.∆G
C.E*
D.Kcb
Lời giải:Đáp án đúng: CXúc tác làm giảm năng lượng hoạt hóa (E*) của phản ứng bằng cách cung cấp một cơ chế phản ứng khác với năng lượng hoạt hóa thấp hơn. Các đại lượng nhiệt động như ∆H, ∆G và hằng số cân bằng Kcb không bị ảnh hưởng bởi xúc tác vì chúng chỉ phụ thuộc vào trạng thái đầu và cuối của phản ứng, không phụ thuộc vào con đường phản ứng.Câu 21:Chọn phát biểu đúng: (1) Ở nhiệt độ không đổi, độ tan của chất khí tỉ lệ thuận với áp suất riêng phần của nó. (2) Thể tích chất khí hòa tan trong một thể tích xác định chất lỏng phụ thuộc vào áp suất. (3) Tất cả các chất lỏng đều có thể tan vô hạn vào nhau. (4) Ở mọi điều kiện áp suất khác nhau, áp suất hầu như không có ảnh hưởng đến độ tan tương hỗ của hai chất lỏng. (5) Nhiệt độ không ảnh hưởng đến sự hòa tan chất rắn trong chất lỏng.
A.1, 2, 3 đúng
B.1, 4, 5
C.1, 2 đúng
D.Tất cả đều đúng
Lời giải:Đáp án đúng: CTa xét từng phát biểu:(1) Đúng theo định luật Henry: Ở nhiệt độ không đổi, độ tan của chất khí tỉ lệ thuận với áp suất riêng phần của nó.(2) Đúng, thể tích chất khí hòa tan trong một thể tích chất lỏng xác định phụ thuộc vào áp suất.(3) Sai, không phải tất cả các chất lỏng đều tan vô hạn vào nhau, có những chất lỏng tan có giới hạn hoặc không tan vào nhau.(4) Đúng, áp suất ít ảnh hưởng đến độ tan tương hỗ của hai chất lỏng.(5) Sai, nhiệt độ ảnh hưởng đến sự hòa tan chất rắn trong chất lỏng. Thường thì độ tan của chất rắn tăng khi nhiệt độ tăng, nhưng cũng có trường hợp ngược lại.Vậy, các phát biểu 1, 2 và 4 đúng.
Câu 22:Xác định độ giảm áp suất hơi bão hòa của dung dịch C6H12O6 bão hòa ở 20oC, biết độ tan của C6H12O6 ở nhiệt độ này là 200,0 g/100 ml H2O và nước tinh khiết có áp suất hơi bão hòa bằng 23,76mmHg.
A.19,79 mm Hg
B.3,79 mm Hg
C.3,97 mm Hg
D.1,73 mm Hg
Lời giải:Đáp án đúng: CĐộ giảm áp suất hơi bão hòa của dung dịch được tính theo công thức:ΔP = P° * x(chất tan)Trong đó:- ΔP là độ giảm áp suất hơi.- P° là áp suất hơi bão hòa của dung môi (nước) tinh khiết, bằng 23,76 mmHg.- x(chất tan) là phần mol của chất tan (C6H12O6) trong dung dịch.Tính số mol của C6H12O6:- Khối lượng mol của C6H12O6 = 180 g/mol- Độ tan là 200g C6H12O6 trong 100g H2O.- Số mol C6H12O6 = 200g / 180 g/mol ≈ 1,11 molTính số mol của H2O:- Khối lượng mol của H2O = 18 g/mol- Số mol H2O = 100g / 18 g/mol ≈ 5,56 molTính phần mol của C6H12O6:- x(C6H12O6) = số mol C6H12O6 / (số mol C6H12O6 + số mol H2O)- x(C6H12O6) = 1,11 / (1,11 + 5,56) ≈ 0,166Tính độ giảm áp suất hơi:- ΔP = 23,76 mmHg * 0,166 ≈ 3,94 mmHgGiá trị này gần nhất với phương án 3,97 mmHg.Câu 23:Chọn đáp án đúng: Trong quá trình sôi của dung dịch loãng chứa chất tan không bay hơi, nhiệt độ sôi của dung dịch:
A.Không đổi
B.Giảm xuống
C.Tăng dần
D.Lúc tăng lúc giảm
Lời giải:Đáp án đúng: CKhi đun nóng một dung dịch loãng chứa chất tan không bay hơi, nhiệt độ của dung dịch sẽ tăng lên cho đến khi đạt đến điểm sôi. Tại điểm sôi, áp suất hơi của dung dịch bằng áp suất khí quyển. Do chất tan không bay hơi làm giảm áp suất hơi của dung dịch so với dung môi nguyên chất (hiện tượng áp suất hơi giảm), dung dịch sẽ sôi ở nhiệt độ cao hơn so với dung môi nguyên chất. Trong suốt quá trình sôi, nhiệt độ của dung dịch sẽ tăng dần vì nồng độ chất tan tăng lên khi dung môi bay hơi.Câu 24:Chọn câu đúng. Cho các dung dịch nước loãng của C6H12O6, NaCl, MgCl2, Na3PO4. Biết chúng có cùng nồng độ molan và độ điện li của các muối NaCl, MgCl2 và Na3PO4 đều bằng 1. Ở cùng điều kiện áp suất ngoài, nhiệt độ sôi của các dung dịch theo dãy trên có đặc điểm:
A.Tăng dần
B.Bằng nhau
C.Giảm dần
D.Không có quy luật
Lời giải: Bạn cần đăng ký gói VIP để làm bài, xem đáp án và lời giải chi tiết không giới hạn. Nâng cấp VIP Câu 25:Chọn phương án đúng: Trật tự sắp xếp nào của các dung dịch 0,01M của những chất cho dưới đây là phù hợp với sự giảm dần áp suất thẩm thấu (các muối điện li hoàn toàn):
A.CH3COOH – NaCl– C6H12O6 - CaCl2
B.C6H12O6 - CH3COOH– NaCl - CaCl2
C.CaCl2 - CH3COOH– C6H12O6 – NaCl
D.CaCl2 – NaCl – CH3COOH – C6H12O6
Lời giải: Bạn cần đăng ký gói VIP để làm bài, xem đáp án và lời giải chi tiết không giới hạn. Nâng cấp VIP Câu 26:Chọn phương án đúng: Cho 3 dung dịch nước BaCl2, Na2CO3 và NaCl và nước nguyên chất. BaCO3 tan nhiều hơn cả trong:
A.Dung dịch BaCl2
B.Dung dịch NaCl
C.Dung dịch Na2CO3
D.H2O
Lời giải: Bạn cần đăng ký gói VIP để làm bài, xem đáp án và lời giải chi tiết không giới hạn. Nâng cấp VIP Câu 27:Chọn phát biểu đúng: Dựa vào ái lực proton của các dung môi NH3 và HCl cho biết rượu thể hiện tính chất gì trong dung môi đó:
A.Tính base trong cả 2 dung môi
B.Tính base trong HCl, tính acid trong NH3
C.Tính base trong NH3, tính acid trong HCl
D.Tính acid trong cả 2 dung môi
Lời giải: Bạn cần đăng ký gói VIP để làm bài, xem đáp án và lời giải chi tiết không giới hạn. Nâng cấp VIP Câu 28:Tính pH của dung dịch chứa NH2OH và [NH3OH]Cl với tỷ lệ mol 4:1, biết \({K_{N{H_2}OH}} = {10^{ - 7.91}}\)
A.6,09
B.6,39
C.6,69
D.6,93
Lời giải: Bạn cần đăng ký gói VIP để làm bài, xem đáp án và lời giải chi tiết không giới hạn. Nâng cấp VIP
Bộ Đồ Án Tốt Nghiệp Ngành Trí Tuệ Nhân Tạo Và Học Máy
89 tài liệu310 lượt tải
Bộ 120+ Đồ Án Tốt Nghiệp Ngành Hệ Thống Thông Tin
125 tài liệu441 lượt tải
Bộ Đồ Án Tốt Nghiệp Ngành Mạng Máy Tính Và Truyền Thông
104 tài liệu687 lượt tải
Bộ Luận Văn Tốt Nghiệp Ngành Kiểm Toán
103 tài liệu589 lượt tải
Bộ 370+ Luận Văn Tốt Nghiệp Ngành Kế Toán Doanh Nghiệp
377 tài liệu1030 lượt tải
Bộ Luận Văn Tốt Nghiệp Ngành Quản Trị Thương Hiệu
99 tài liệu1062 lượt tảiĐĂNG KÝ GÓI THI VIP
- Truy cập hơn 100K đề thi thử và chính thức các năm
- 2M câu hỏi theo các mức độ: Nhận biết – Thông hiểu – Vận dụng
- Học nhanh với 10K Flashcard Tiếng Anh theo bộ sách và chủ đề
- Đầy đủ: Mầm non – Phổ thông (K12) – Đại học – Người đi làm
- Tải toàn bộ tài liệu trên TaiLieu.VN
- Loại bỏ quảng cáo để tăng khả năng tập trung ôn luyện
- Tặng 15 ngày khi đăng ký gói 3 tháng, 30 ngày với gói 6 tháng và 60 ngày với gói 12 tháng.
Từ khóa » C2h5oh Tạo Ra Ch3cooc2h5
-
CH3COOH + C2H5OH → CH3COOC2H5 + H2O
-
CH3COOH + C2H5OH → CH3COOC2H5 + H2O - THPT Sóc Trăng
-
C2H5OH CH3COOH = H2O CH3COOC2H5 | Phản ứng Hóa Học
-
C2H5OH + CH3COOH → H2O + CH3COOC2H5 | , Phản ứng Thế
-
C2H5OH + CH3COOH - Cân Bằng Phương Trình Hóa Học
-
C2H5OH + CH3COOH | H2O + CH3COOC2H5 | Phương Trình Hóa Học
-
CH3COOH + C2H5OH = CH3COOC2H5 + H3O - Trình Cân Bằng ...
-
CH3COOH + C2H5OH → CH3COOC2H5 + H2O - Trường THPT ...
-
Biết Rằng Phản ứng Este Hoá CH3COOH+C2H5OH - Vietjack.online
-
CH3COOC2H5 + H2O → CH3COOH + C2H5OH
-
CH3COOH + C2H5OH Overset(())(<=ftrightarrows) CH3COOC2H5 + ...
-
CH3COOH + C2H5OH → CH3COOC2H5 + H2O - Đọc Thú Vị
-
Trong Phản ứng Thủy Phân Sau: CH3COOH + C2H5OH ... - Hoc247
-
C2H5OH; CH3COOH; CH3COOC2H5 . 2. Viết PT - By TopList24h