Liệu Pháp Truyền Dịch Qua đường Tĩnh Mạch Trong Môi Trường Chu ...
Có thể bạn quan tâm
nhathuocngocanh.com – Để tải file PDF của bài viết Liệu pháp truyền dịch qua đường tĩnh mạch trong môi trường chu phẫu và chăm sóc tích cực: Tóm tắt thực hành của Học viện dịch truyền quốc tế (IFA), xin vui lòng click vào link ở đây.
Dịch bài: BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Tóm tắt
Việc truyền dịch qua đường tĩnh mạch nên được coi như bất kỳ đơn thuốc nào khác. Có ba chỉ định chính: hồi sức, thay thế và duy trì. Hơn nữa, tác động của việc sử dụng dịch truyền như chất pha loãng thuốc hoặc để giữ thông catheter, tức là dịch truyền giữ vein, cũng cần được xem xét. Như đối với kháng sinh, việc truyền dịch qua đường tĩnh mạch cần tuân theo bốn điều D: loại thuốc, liều lượng, thời gian, xuống thang. Trong số các dung dịch tinh thể, các dung dịch cân bằng hạn chế sự thay đổi toan kiềm và tải lượng clorua và nên được ưu tiên hơn, vì điều này có thể ngăn ngừa rối loạn chức năng thận. Trong số các dung dịch keo, albumin, dung dịch keo tự nhiên duy nhất có sẵn, có thể có những tác dụng hữu ích. Thập kỷ qua người ta ngày càng quan tâm đến những tác hại tiềm ẩn liên quan đến quá tải dịch truyền. Trong bối cảnh chu phẫu, quản lý dịch truyền thích hợp để duy trì tưới máu cơ quan đầy đủ trong khi hạn chế truyền dịch phải là tiêu chuẩn chăm sóc. Các phác đồ bao gồm truyền dịch liên tục hạn chế cùng với tiêm bolus để đạt được các mục tiêu huyết động đã được đề xuất. Một cách tiếp cận tương tự cũng nên được xem xét đối với những bệnh nhân bị bệnh nặng, trong đó tính thấm nội mạc tăng lên làm cho chiến lược này phù hợp hơn. Các giao thức xuống thang tích cực có thể cần thiết trong giai đoạn sau. R.O.S.E (Hồi sức, Tối ưu hóa, Ổn định, Dẫn lưu) là mô hình khái niệm, tóm tắt chính xác cách tiếp cận năng động đối với liệu pháp dịch truyền, tối đa hóa lợi ích và giảm thiểu tác hại. Ngay cả trong các loại bệnh nhân nặng cụ thể, tức là bị chấn thương hoặc bỏng, liệu pháp dịch truyền nên được áp dụng cẩn thận, xem xét tầm quan trọng của các mục đích cụ thể của họ; duy trì cung cấp oxy ngoại vi, đồng thời tránh hậu quả của quá tải dịch truyền.
Giới thiệu
Dịch truyền tĩnh mạch đã được sử dụng trong lâm sàng hơn một thế kỷ, nhưng cộng đồng y tế và khoa học gần đây mới bắt đầu đánh giá cao tầm quan trọng của việc truyền dịch một cách thận trọng, sự cần thiết phải xử lý chúng như bất kỳ loại thuốc nào khác mà chúng tôi kê đơn [1,2,3,4], và các tác dụng phụ đáng kể mà chúng có thể đi kèm [5, 6].
Có ba chỉ định chính để truyền dịch qua đường tĩnh mạch [1, 4, 7, 8, 9]: hồi sức (resuscitation), thay thế (replacement) và duy trì (maintenance). Dịch hồi sức được sử dụng để điều chỉnh tình trạng thiếu hụt thể tích nội mạch hoặc giảm thể tích tuần hoàn cấp tính; các dung dịch thay thế được chỉ định để điều chỉnh tình trạng mất dịch hiện có hoặc đang phát triển mà không thể bù đắp bằng đường uống [6]; Các dung dịch duy trì được chỉ định ở những bệnh nhân ổn định về huyết động mà không thể/được phép uống nước để đáp ứng nhu cầu hàng ngày của họ về nước và chất điện giải [10, 11]. Ngoài các chỉ định cổ điển này, mức độ liên quan về mặt định lượng của dịch truyền được sử dụng pha loãng thuốc và để đảm bảo thông catheter, còn gọi là dịch truyền giữ vein, gần đây đã được nhấn mạnh [12, 13].
Mặc dù việc sử dụng dịch truyền truyền tĩnh mạch là một trong những biện pháp can thiệp phổ biến nhất trong y học, nhưng dịch truyền lý tưởng không tồn tại. Dựa trên các bằng chứng gần đây, cần phải đánh giá lại cách sử dụng dịch truyền tĩnh mạch trong cơ sở chăm sóc chu phẫu và chăm sóc tích cực. Sau đây, chúng tôi trình bày tóm tắt điều hành về lĩnh vực này của Học viện Dịch truyền Quốc tế.
Bốn điểm D của quản lý dịch truyền
Tương tự như kháng sinh, 4 D của liệu pháp truyền dịch cần được xem xét (Bảng 1) [4].
Thuốc
Dịch là thuốc có chỉ định, chống chỉ định, có tác dụng phụ. Các chỉ định khác nhau cần các loại dịch truyền khác nhau, ví dụ, dịch truyền hồi sức nên tập trung vào việc phục hồi nhanh chóng thể tích tuần hoàn; dịch truyền thay thế phải bắt chước dịch truyền đã bị mất; dịch duy trì phải cung cấp các chất điện giải cơ bản và glucose cho nhu cầu trao đổi chất.
Liều lượng
Theo Paracelsus, liều lượng tạo ra chất độc. Tuy nhiên, thời gian và tốc độ truyền dịch cũng quan trọng như nhau [14, 15]. Lưu ý, trái ngược với hầu hết các loại thuốc, không có liều điều trị tiêu chuẩn cho dịch truyền.
Thời gian
Thời gian điều trị bằng dịch truyền là rất quan trọng và thể tích phải được giảm dần khi tình trạng sốc được giải quyết. Tuy nhiên, trong khi “các yếu tố khởi động” để hồi sức bằng dịch khá rõ ràng, thì các bác sĩ lâm sàng lại ít biết về “việc dừng các yếu tố khởi phát” của hồi sức bằng dịch.
Bảng 1 Sự tương tự giữa 4D của liệu pháp kháng sinh và quản lý dịch truyền.
| Mô tả | Kháng sinh | Dịch truyền | |
| Drug (Thuốc) | Liệu pháp không phù hợp | Suy cơ quan nhiều hơn, thời gian ICU/ nằm viện dài hơn, thời gian thở máy (MV) dài hơn | Nhiễm toan chuyển hóa tăng clo máu, tổn thương thận cấp tính nhiều hơn, cần điều trị thay thế thận nhiều hơn, tăng tỷ lệ tử vong |
| Liệu pháp thích hợp | Yếu tố chính trong việc lựa chọn AB theo kinh nghiệm là xem xét các yếu tố nguy cơ của bệnh nhân (sử dụng AB trước đó, thời gian thở máy, corticosteroid, nhập viện gần đây, sống trong viện dưỡng lão, v.v.) | Yếu tố chính trong liệu pháp truyền dịch theo kinh nghiệm là xem xét các yếu tố nguy cơ của bệnh nhân (cân bằng dịch, quá tải dịch, rò rỉ mao mạch, kiểm soát nguồn, chức năng thận, chức năng cơ quan). Không sử dụng glucose làm dịch truyền hồi sức | |
| Liệu pháp phối hợp | Lợi ích có thể có: phổ rộng hơn, sức mạnh tổng hợp, tránh tình trạng kháng thuốc khẩn cấp, ít độc tính hơn | Lợi ích có thể có: dịch truyền cụ thể cho các chỉ định khác nhau (thay thế so với duy trì và hồi sức), ít độc tính hơn | |
| Thời gian thích hợp | Tỷ lệ sống sót giảm khi trì hoãn 7% mỗi giờ. Cần kỷ luật và tổ chức thực tế | Trong sốc kháng trị, liệu pháp theo mục tiêu sớm (EGDT) đã được chứng minh là có lợi. Thời gian trì hoãn càng lâu, giảm tưới máu vi tuần hoàn càng nhiều | |
| Dosing (Liều lượng) | Dược động học | Phụ thuộc vào thể tích phân phối, độ thanh thải (chức năng thận và gan), mức albumin, sự thâm nhập của mô | Phụ thuộc vào loại dịch truyền: glucose vẫn còn 10% trong lòng mạch, tinh thể tinh thể 25%, so với dung dịch keo 100% sau 1 giờ, và các yếu tố khác (thể tích phân phối, áp lực thẩm thấu, áp lực keo, chức năng thận) |
| Dược lực học | Được phản ánh bởi nồng độ ức chế tối thiểu. Được phản ánh bởi các đặc điểm “tiêu diệt”, phụ thuộc vào thời gian (T> MIC) so với nồng độ (Cmax/MIC) | Phụ thuộc vào loại dịch truyền và nơi bạn muốn chúng đi: nội mạch (hồi sức), mô kẽ so với nội bào (mất nước tế bào) | |
| Độc tính | Một số AB gây độc cho thận, cần có khuyến cáo về việc điều chỉnh liều lượng. Tuy nhiên, không kiểm soát được tình trạng nhiễm trùng cũng không giúp ích gì cho thận | Một số dịch truyền (HES) độc hại cho thận. Tuy nhiên, không kiểm soát được tình trạng sốc cũng không giúp ích gì cho thận | |
| Duration (Thời gian) | Thời lượng thích hợp | Không có bằng chứng chắc chắn nhưng có xu hướng thời gian ngắn hơn. Không sử dụng AB để điều trị sốt, CRP, thâm nhiễm, nhưng sử dụng AB để điều trị nhiễm trùng | Không có bằng chứng chắc chắn nhưng có xu hướng thời gian ngắn hơn. Không sử dụng dịch để điều trị giảm áp lực tĩnh mạch trung tâm hoặc huyết áp động mạch trung bình, lượng nước tiểu, nhưng sử dụng dịch để điều trị giảm thể tích tuần hoàn |
| Xử lý để đáp ứng | Ngừng ABs khi các dấu hiệu và triệu chứng của nhiễm trùng đang hoạt động hồi phục. Vai trò trong tương lai đối với các dấu ấn sinh học (PCT) | Có thể ngừng truyền dịch khi hết sốc (lactate bình thường). Vai trò trong tương lai đối với các dấu ấn sinh học (NGAL, cystatin C, citrullin, L- FABP) | |
| De- escalation (Xuống thang) | Giám sát | Trước tiên hãy xem xét các kết quả nuối cấy và có đủ can đảm để thay đổi một AB còn nhạy | Sau khi ổn định với quản lý dịch đầy đủ sớm (PPV bình thường, cung lượng tim bình thường, lactate bình thường), ngừng hồi sức liên tục và chuyển sang hạn chế dịch muộn và loại bỏ dịch theo mục tiêu muộn (= deresuscitation) |
AB: Kháng sinh, Cmax: nồng độ đỉnh tối đa, CRP C: protein phản ứng, EGDT: liệu pháp hướng đến mục tiêu sớm, HES: tinh bột hydroxyl-ethyl, L-FABP: protein liên kết axit béo loại, MIC: nồng độ ức chế trung bình, MV: thở máy, NGAL gelatinase bạch cầu trung tính liên kết lipocalin, PCT: procalcitonin, PPV: biến đổi áp lực xung
Xuống thang
Bước cuối cùng trong liệu pháp truyền dịch là ngưng/giảm bớt dịch truyền khi không còn cần thiết, do đó làm giảm nguy cơ quá tải dịch truyền và các tác dụng có hại liên quan [16].
Các dung dịch cân bằng
Cơ bản
Các dung dịch “cân bằng” tiêm tĩnh mạch bao gồm dung dịch tinh thể và dung dịch keo có tác dụng tối thiểu đến cân bằng nội môi của ngăn ngoại bào, và đặc biệt đối với cân bằng toan kiềm và nồng độ chất điện giải [3]. Ngoài ra, thuật ngữ “cân bằng” cũng đã được áp dụng gần đây cho các dịch truyền có hàm lượng clorua thấp (Cl−). Do đó, có hai loại dung dịch cân bằng chính (Bảng 2): (1) dịch truyền gây ra ảnh hưởng tối thiểu đến cân bằng toan kiềm, có hàm lượng chất điện giải với sự chênh lệch ion mạnh in vivo (SID), tức là SID sau khi chuyển hóa của anion hữu cơ, gần 24–29 mEq/L; (2) dịch truyền có hàm lượng Cl− bình thường hoặc dưới bình thường (Cl− ≤ 110 mEq/L).
Theo cách tiếp cận định lượng đối với trạng thái cân bằng toan kiềm [17, 18], ba biến số điều chỉnh độ pH của dịch truyền sinh học một cách độc lập là (1) áp lực riêng phần của carbon dioxide (PCO2); (2) nồng độ của axit yếu không bay hơi (ATOT); (3) hiệu số ion mạnh (SID), được định nghĩa là hiệu số giữa tổng của tất cả các cation mạnh và tổng của tất cả các anion mạnh [19]. Các nguyên tắc này cho thấy rõ ràng rằng dịch truyền tĩnh mạch có thể ảnh hưởng đến pH do (i) hàm lượng chất điện giải cụ thể đặc trưng cho dung dịch, do đó làm thay đổi SID của ngăn ngoại bào và (ii) hiệu ứng pha loãng do thể tích được truyền, do đó làm giảm nồng độ ATOT. [20,21,22]. Lý tưởng nhất là dịch truyền có thể không thay đổi pH huyết tương sau khi sử dụng, ở PCO2 không đổi, nên cân bằng các biến thể này. Các nghiên cứu gần đây cho thấy dung dịch cân bằng lý tưởng phải có SID in vivo bằng với nồng độ cơ bản của HCO3− [23]. Nếu SID của dịch truyền lớn hơn HCO3− trong huyết tương, pH huyết tương sẽ có xu hướng kiềm hóa; nếu SID của dịch truyền thấp hơn HCO3- trong huyết tương, pH huyết tương sẽ có xu hướng nhiễm toan, như trường hợp này luôn xảy ra đối với NaCl 0,9%, được gọi là nước muối “sinh lý” [24].
Bảng 2 Thành phần điện giải của các dung dịch cân bằng chính có sẵn để tiêm tĩnh mạch.
| Crystalloids | Gelatins | Starches | ||||||||
| Lactated Ringer’s | Acetated Ringer’s | Hartmann’s | PlasmaLyte | Sterofundi n ISOa | ELO-MEL isoton | Isoplex | Gelaspan | Hextend | Tetraspan | |
| Na+ [mEq/L] | 130 | 132 | 131 | 140 | 145 | 140 | 145 | 151 | 143 | 140 |
| K+ [mEq/L] | 4 | 4 | 5 | 5 | 4 | 5 | 4 | 4 | 3 | 4 |
| Ca2+ [mEq/L] | 3 | 3 | 4 | – | 5 | 5 | – | 2 | 5 | 5 |
| Mg2+ [mEq/L] | – | – | 3 | 3 | 2 | 3 | 1.8 | 2 | 0.9 | 2 |
| Cl− [mEq/L] | 109 | 110 | 111 | 98 | 127 | 108 | 105 | 103 | 124 | 118 |
| Lactate [mEq/L] | 28 | – | 29 | – | – | – | 25 | – | 28 | – |
| Acetate [mEq/L] | – | 29 | – | 27 | 24 | 45 | – | 24 | – | 24 |
| Malate [mEq/L] | – | – | – | – | 5 | – | – | – | – | 5 |
| Gluconate [mEq/L] | – | – | – | 23 | – | – | – | – | – | – |
| Dextrose [g L-1] | – | – | – | – | – | – | – | – | – | – |
| Gelatin [g/L] | – | – | – | – | – | – | 40 | 40 | – | – |
| HES [g/L] | – | – | – | – | – | – | – | – | 60 | 60 |
| Dextran [g/L] | – | – | – | – | – | – | – | – | – | – |
| In-vivo SID [mEq/L] | 28 | 29 | 29 | 50 | 29 | 45 | 45.8 | 56 | 28 | 29b |
| Osmolarity [mOsm/L] | 278 | 277 | 279 | 294 | 309 | 302 | 284 | 284 | 307 | 297 |
In-vivo SID — tất cả các phân tử hữu cơ chứa trong các dung dịch cân bằng đều là anion mạnh. Kết quả tính toán SID (in vitro-SID) bằng 0 mEq/L, do tính trung tính về điện. Sau khi được truyền vào cơ thể, các phân tử hữu cơ được chuyển hóa thành CO2 và nước; kết quả là vivo-SID tương ứng với lượng anion hữu cơ được chuyển hóa
a, Sterofundin-ISO hoặc Ringerfundin
b, In vivo-SID của Tetraspan được báo cáo trong Bảng kết quả từ tổng các anion hữu cơ; lưu ý, có sự khác biệt so với SID được tính là sự khác biệt giữa các cation vô cơ và anion vô cơ (29 mEq/L so với 33 mEq/L). Không có lời giải thích rõ ràng đã được báo cáo từ người bán
Như đã nêu ở trên, định nghĩa của dung dịch “cân bằng” cũng bao gồm một loại dịch truyền đẳng trương và gần đẳng trương với hàm lượng Cl− thấp (bằng hoặc thấp hơn 110 mEq/L), so với NaCl 0,9%. Tuy nhiên, thành phần cuối cùng của một dịch truyền như vậy, đặc biệt là khi xem xét các dung dịch tinh thể, sẽ phụ thuộc vào (1) trương lực; (2) trung tính điện và (3) SID. Thật vậy, một dung dịch cân bằng đẳng trương để lại trạng thái cân bằng toan kiềm không thay đổi (nghĩa là với SID gần 24 mEq/L) sẽ nhất thiết phải có hàm lượng Cl−> 110 mEq/L (như trong Sterofundin-ISO). Ngược lại, một dịch truyền có SID là 24 mEq/L và hàm lượng Cl− thấp hơn nhất thiết sẽ có một chút nhược trương (như với Lactated Ringer’s). Cuối cùng, một dịch truyền đẳng trương có hàm lượng Cl− thấp nhất thiết sẽ có SID cao hơn (như với PlasmaLyte), với tác dụng kiềm hóa.
Trường hợp cho các dung dịch cân bằng
Các dung dịch cân bằng và không cân bằng (NaCl 0,9%) có thể có tác dụng hơi khác nhau đối với việc mở rộng thể tích máu, tùy theo tình trạng lâm sàng. Thật vậy, các động học khác nhau cho thấy giảm sự mở rộng thể tích huyết tương của dung dịch cân bằng khoảng 10% so với NaCl 0,9% đã được mô tả ở những người tình nguyện khỏe mạnh có thể tích máu bình thường [25, 26]. Mặt khác, trong một mô hình thực nghiệm về sốc xuất huyết gần tử vong, cần dùng liều thấp hơn của dung dịch cân bằng, so với NaCl 0,9% để khôi phục huyết áp mục tiêu [27]. Những kết quả mâu thuẫn này nhấn mạnh một thực tế rằng những phát hiện về liệu pháp truyền dịch là điều kiện cụ thể và kết quả thu được từ bệnh nhân nhiễm trùng huyết hoặc mô hình thử nghiệm không nên ngoại suy cho tất cả các tình huống.
Bất chấp những tranh cãi này, cần được làm rõ thêm, vẫn tồn tại một số khác biệt rõ ràng giữa hai loại dung dịch này. Đầu tiên, NaCl 0,9% giàu clorua gây ra tình trạng nhiễm toan và tăng clo máu phụ thuộc vào liều lượng cao hơn, có thể tạo điều kiện cho sự co thắt của các cơ trơn mạch máu [28, 29], có khả năng dẫn đến giảm tưới máu thận.
Khi những người tình nguyện khỏe mạnh nhận được 2 L nước muối hoặc Plasma-Lyte trong 1 giờ, nước muối làm giảm đáng kể vận tốc máu động mạch thận, giảm tưới máu mô vỏ thận, giảm lượng nước tiểu và tăng tích tụ dịch ngoài mạch so với Plasma-Lyte [30]. Những phát hiện này có thể ủng hộ ý kiến rằng tăng clo huyết có thể gây tăng phản hồi ống thận-cầu thận và giảm tưới máu vỏ thận [31].
Thật vậy, một phân tích quan sát về dữ liệu bảo hiểm của Hoa Kỳ cho thấy rằng việc sử dụng PlasmaLyte® so với NaCl 0,9% vào ngày đầu tiên của cuộc phẫu thuật lớn ở bụng ít dẫn đến suy thận cần lọc máu hơn [32]. Ngoài tác dụng lên tưới máu thận, NaCl 0,9% có tính ưu trương nhẹ, có thể gây tăng arginin vasopressin. Hai tác dụng này có thể góp phần vào việc bài tiết NaCl 0,9% qua thận chậm hơn so với các dung dịch cân bằng [33, 34]. Thật vậy, nhiều dịch truyền hơn sẽ được giữ lại trong khoảng kẽ, do đó có khuynh hướng gây phù nhiều hơn [35, 36]. Tuy nhiên, nó không chỉ đơn thuần là chức năng thận có thể bị rối loạn do nồng độ clorua cao; truyền NaCl 0,9% có thể gây khó chịu ở bụng ở người tình nguyện khỏe mạnh [37] và giảm tưới máu dạ dày ở bệnh nhân phẫu thuật lớn tuổi [38].
Hai thử nghiệm đối chứng ngẫu nhiên quan trọng và lớn so sánh việc sử dụng các dung dịch cân bằng và nước muối sinh lý đã được công bố trong những năm qua. Nghiên cứu SPLIT là thử nghiệm đối chứng ngẫu nhiên mù đôi đa trung tâm đầu tiên được thực hiện trên 2092 bệnh nhân, so sánh dịch truyền cân bằng và không cân bằng trong các đơn vị chăm sóc đặc biệt. Nó cho thấy không có sự khác biệt đáng kể về kết quả chính, tức là tỷ lệ tổn thương thận cấp tính [39]. Tuy cung cấp nhiều bằng chứng nhưng phiên tòa này đã không đưa ra được câu trả lời dứt khoát. Thật vậy, thể tích trung bình của dịch truyền nghiên cứu chỉ là 2 L trong 90 ngày. Hơn nữa, cả hai nhóm nghiên cứu đã nhận được thể tích trung bình từ 1,0-1,2 L PlasmaLyte trong vòng 24 giờ trước khi nhập khoa, do đó, việc sử dụng PlasmaLyte trước đó cân bằng tác dụng của liều thấp NaCl 0,9% là hợp lý. Thử nghiệm SMART là một nghiên cứu lớn được thực hiện trong năm đơn vị chăm sóc đặc biệt của một trung tâm học thuật duy nhất [40]. Tổng cộng có 15.802 bệnh nhân được chọn ngẫu nhiên để nhận NaCl 0,9% hoặc dung dịch cân bằng (Plasma-Lyte A hoặc Lactated Ringer’s). Trong cả hai nhóm, bệnh nhân được truyền một lượng dịch truyền cực kỳ nhỏ: trung bình là 1 L từ khi nhập viện đến ngày thứ 30 hoặc xuất viện, tùy điều kiện nào đến trước. Mặc dù thể tích tinh thể thấp bất ngờ, các tác giả đã tìm thấy một sự khác biệt nhỏ về kết cục chính, tức là tỷ lệ các biến cố thận nghiêm trọng trong vòng 30 ngày (tổng hợp tử vong, điều trị thay thế thận mới hoặc rối loạn chức năng thận dai dẳng) ủng hộ các dung dịch cân bằng. Nhìn vào kết quả chung, điều quan trọng cần nhấn mạnh là không có sự giảm tỷ lệ tử vong khi nhập viện và tỷ lệ điều trị thay thế thận (2,5% so với 2,9%, p = 0,08) cũng như tỷ lệ rối loạn chức năng thận dai dẳng ( 6,4% so với 6,6%, p = 0,60) là có ý nghĩa thống kê. Một nghiên cứu tương tự được thực hiện bởi cùng tác giả và được công bố trên cùng số báo của Tạp chí Y học New England, thử nghiệm SALT-ED, đã tìm thấy sự khác biệt tương tự về tỷ lệ các biến cố thận nghiêm trọng ở người lớn không bị bệnh nặng [41].
Tóm lại, chúng ta có thể tránh nhiễm toan chuyển hóa do dịch truyền và nạp quá nhiều clorua chỉ bằng cách sử dụng các dung dịch cân bằng. Ngày càng có nhiều bằng chứng cho thấy việc sử dụng quá nhiều clorua có thể có tác dụng bất lợi đối với chức năng thận, ngay cả ở liều thấp. Do đó, việc sử dụng các dung dịch cân bằng, đặc biệt ở những bệnh nhân có khả năng cần một
lượng đáng kể dịch truyền tĩnh mạch, dường như là một lựa chọn thực tế hợp lý [42]. Ngược lại, nước muối có thể là một lựa chọn trực quan cho những bệnh nhân bị hạ natri máu do giảm thể tích hoặc nhiễm kiềm chuyển hóa do giảm clo máu. Trong bất kỳ môi trường nào khác, lý do quan trọng nhất để chọn NaCl 0,9% thay vì các dung dịch cân bằng có thể là kinh tế về bản chất. Do đó, clo huyết thanh của bệnh nhân là một yếu tố quan trọng để xác định loại dịch truyền thích hợp.
Albumin
Cơ bản
Albumin chiếm khoảng 50% hàm lượng protein huyết tương [43] và là yếu tố chính quyết định áp lực keo huyết tương, đóng một vai trò quan trọng trong việc điều hòa động lực của nước trong vi mạch [44, 45]. Nồng độ albumin trong huyết tương bình thường nằm trong khoảng từ 35 đến 55 g/L, tương ứng với khoảng 0,54–0,85 mmol/L, và áp lực keo trong ống nghiệm khoảng 9,2 mmHg. Ngược lại, áp lực keo in vivo thấp hơn, vì tính thấm của hàng rào nội mô đối với albumin là thay đổi, ngay cả ở những người khỏe mạnh. Tuy nhiên, theo định luật Starling, áp lực keo là lực chống lại áp lực thủy tĩnh trong lòng mạch, do đó tác động để tái hấp thu nước và các chất hòa tan nhỏ từ mô kẽ vào khoang nội mạch. Vai trò quan trọng của đặc tính keo của albumin trong việc điều chỉnh động lực học của nước trong vi tuần hoàn dường như cũng áp dụng cho lớp glycocalyx nội mô [46, 47]. Lớp giống như gel này, lót phía bên trong của nội mạc, được cho là chiếm 20% thể tích nội mạch. Quan điểm hiện tại của glycocalyx là nó chứa nhiều hợp chất bắt buộc đối với hoạt động của nội mô và làm trung gian cho một số quá trình sinh lý quan trọng, chẳng hạn như duy trì hàng rào mạch máu, cầm máu, ngăn ngừa sự kết dính của tế bào vào nội mạc và truyền ứng suất cắt (shear stress) [48]. Tuy nhiên, vai trò của glycocalyx vẫn đang được nghiên cứu liên tục và vai trò và chức năng của nó có thể cần được sửa đổi trong tương lai [49]. Cần lưu ý, sự rụng (shedding) glycocalyx xảy ra khi có các gốc oxy tự do, tăng đường huyết, cytokine và endotoxin, và do đó thường xảy ra ở những bệnh nhân bị bệnh nặng [50]. Trong bối cảnh cân bằng nội môi dịch truyền, mất chức năng hàng rào do glycocalyx rụng có liên quan đến sự hình thành phù [51]. Hơn nữa, bản thân liệu pháp dịch truyền được biết là có khả năng gây hại cho chức năng nội mô [27], có thể là do dẫn đến stress oxy hóa. Tuy nhiên, các nguy cơ có thể liên quan đến bối cảnh lâm sàng cụ thể. Thật vậy, mặc dù việc nạp thể tích không gây ra rụng glycocalyx ở bệnh nhân phẫu thuật và người tình nguyện khỏe mạnh [52, 53], lượng glycocalyx thải ra tỷ lệ thuận với thể tích dịch truyền ở bệnh nhân sốc nhiễm trùng [54].
Trường hợp của albumin
Nghiên cứu ALBIOS, một thử nghiệm đối chứng ngẫu nhiên lớn ở Ý, đã đưa ra một số gợi ý về việc dùng albumin có cải thiện kết cục trong nhiễm trùng huyết nặng và sốc nhiễm trùng hay không [55]. Bệnh nhân nhiễm trùng huyết nặng được chọn ngẫu nhiên để nhận albumin 20% và dung dịch tinh thể hoặc dung dịch tinh thể đơn thuần sau khi hồi sức ban đầu theo mục tiêu sớm. Ở những bệnh nhân được điều trị albumin ngẫu nhiên, albumin được bổ sung trong 28 ngày, để duy trì nồng độ albumin ≥ 30 g/L. Mặc dù có một số tác dụng sinh lý có lợi (nhịp tim thấp hơn, áp lực động mạch trung bình cao hơn và cân bằng dịch dương thuần hàng ngày thấp hơn trong 7 ngày đầu tiên), không có sự khác biệt nào về tỷ lệ tử vong ở 90 ngày (41,1% so với 43,6%) hoặc nói chung điểm số suy cơ quan. Tuy nhiên, khi phân tích kết quả theo mức độ bệnh, những bệnh nhân sốc nhiễm trùng được ngẫu nhiên bổ sung albumin cho thấy nguy cơ tử vong thấp hơn (nguy cơ tương đối 0,87; khoảng tin cậy 95% 0,77–0,99) so với những bệnh nhân chỉ được bổ sung dung dịch tinh thể. Điều đáng nói là thử nghiệm này không sử dụng albumin như một dịch truyền hồi sức, mà như một loại thuốc để điều chỉnh tình trạng hạ albumin máu.
Trường hợp chống lại albumin
Dung dịch keo lưu lại trong khoang nội mạch lâu hơn dung dịch tinh thể, với điều kiện là hàng rào nội mô còn nguyên vẹn, điều này thường không xảy ra ở những bệnh nhân nặng [56]. Với cuộc thảo luận gần đây về tác dụng phụ có thể xảy ra của dung dịch keo nhân tạo, đặc biệt là tinh bột hydroxyetyl (HES), mối quan tâm mới về việc sử dụng albumin đã xuất hiện. Tuy nhiên, mặc dù có cơ sở lý luận vững chắc và nỗ lực khoa học đáng kể [55, 57], cho đến nay, không có thử nghiệm ngẫu nhiên có đối chứng nào cho thấy bất kỳ lợi ích đáng kể nào của việc hồi sức dịch truyền bằng albumin so với các loại dịch truyền khác, bao gồm cả dung dịch tinh thể [58]. Một số báo cáo thậm chí còn gợi ý rằng việc sử dụng albumin trong phẫu thuật tim có thể liên quan đến sự phát triển của chấn thương thận cấp tính [59]. Như đã nêu trước đây, một trong những thử nghiệm albumin lớn nhất cho đến nay, nghiên cứu ALBIOS, đã báo cáo giảm tỷ lệ tử vong trong 90 ngày ở một nhóm nhỏ bệnh nhân bị sốc nhiễm trùng. Tuy nhiên, kết quả này dựa trên một phân tích hậu kỳ thay vì xác định trước và do đó, nên được diễn giải một cách thận trọng. Kết quả của hai thử nghiệm ngẫu nhiên đang diễn ra, Thử nghiệm ALBumin Italian Outcome Septic Shock-BALANCED (ALBIOSS-BALANCED) và Albumin Replacement Therapy in Septic Shock (ARISS), có thể cung cấp một số câu trả lời cho các vấn đề nêu trên.
Chi phí đáng kể và sự sẵn có của các lựa chọn thay thế giá rẻ hiệu quả tương đương không có lợi cho albumin, mặc dù phân tích nhóm con của bộ dữ liệu ALBIOS có thể gợi ý rằng truyền albumin có khả năng tiết kiệm chi phí của bệnh nhân trong sốc nhiễm trùng [60]. Cho đến nay, lợi ích lý thuyết của albumin không được chứng minh bằng các bằng chứng lâm sàng rõ ràng, và trường hợp của albumin vẫn còn gây tranh cãi.
Quản lý dịch truyền chu phẫu
Mục đích của liệu pháp truyền dịch chu phẫu, song song với việc duy trì thể tích máu tuần hoàn hiệu quả, là để tránh cả quá tải dịch và thiếu nước, đồng thời duy trì sự cân bằng dịch của bệnh nhân càng gần bằng 0 càng tốt. Bất chấp lý do này, không có gì bất thường khi bệnh nhân phẫu thuật nhận được 5–10 L dịch truyền và 600–1000 mmol natri, dẫn đến phù và các kết cục bất lợi [61], điều này cũng được tạo điều kiện bởi sự giảm khả năng đào thải của các dung dịch tinh thể phụ thuộc vào áp lực động mạch trung bình [62, 63]. Mặt khác, nhịn ăn qua đêm và chuẩn bị ruột, khi được áp dụng theo cách truyền thống, dẫn đến thiếu hụt dịch truyền. Rõ ràng, bệnh nhân phát triển các biến chứng sau phẫu thuật khi giữ nước vượt quá 2,5 L [32, 64]. Tất nhiên, tăng dịch truyền không chỉ phụ thuộc vào lượng dịch truyền được cung cấp mà còn phụ thuộc vào khả năng bài tiết quá nhiều dịch truyền và muối của thận [32].
Quản lý dịch truyền trước phẫu thuật
Điều trị bằng dịch truyền không chỉ nhằm bù đắp mất dịch trong phẫu thuật mà còn phải tính đến những mất dịch xảy ra trước khi phẫu thuật, gây ra do uống nước kém, chuẩn bị ruột, viêm liên quan đến phản ứng căng thẳng, và có thể, xuất huyết. Tuy nhiên, tình trạng mất nước rất khó phát hiện thông qua các phương pháp lâm sàng.
Nhiều nghiên cứu đã kiểm tra xem liệu truyền dịch có khả năng làm giảm hạ huyết áp do gây mê toàn thân/vùng hay không. Tuy nhiên, các kết quả liên quan đến chiến lược tiền tải đã không được khuyến khích [65, 66].
Quản lý dịch truyền trong phẫu thuật
Để đối phó với việc sử dụng liên tục một lượng lớn tinh thể cho bệnh nhân trải qua cuộc phẫu thuật lớn, một chiến lược ‘hạn chế dịch truyền’ đã được đề xuất. Ví dụ, Brandstrup et al. đã chứng minh trong một thử nghiệm đối chứng ngẫu nhiên đa trung tâm rằng chế độ điều trị hạn chế hơn có liên quan đến kết quả tốt hơn sau phẫu thuật đại trực tràng [61]. Tuy nhiên, chế độ điều trị còn hạn chế so với tiêu chuẩn chăm sóc quá mức (ví dụ, cân bằng dương tính 5 L do thể tích tinh thể nhiều) [67]. Do đó, có thể hình dung rằng nhóm có kết quả tốt hơn được hưởng lợi từ việc tránh thừa dịch truyền hơn là hạn chế dịch truyền. Việc giải thích các tài liệu về chủ đề này bị cản trở bởi việc sử dụng các định nghĩa rất không đồng nhất [68]. Tuy nhiên, điều rõ ràng từ các nghiên cứu quan sát là cả quá nhiều và quá ít dịch truyền đều có liên quan đến kết quả kém [69,70,71,72]. Gần đây, một nghiên cứu thuần tập lớn từ 500 bệnh viện Hoa Kỳ bao gồm cả những bệnh nhân trưởng thành được phẫu thuật đại tràng, trực tràng hoặc phẫu thuật hông hoặc đầu gối đã được kết luận [72]. Một mối liên quan đáng kể được tìm thấy giữa việc truyền dịch tự do vào ngày phẫu thuật và kết quả xấu hơn (tăng tổng chi phí và thời gian nằm viện ở tất cả bệnh nhân), cũng như tăng sự hiện diện của tắc ruột sau phẫu thuật ở những bệnh nhân phẫu thuật đại trực tràng. Điều thú vị là các tác giả cũng quan sát thấy việc hạn chế sử dụng dịch truyền (25% thể tích thấp nhất) cũng có liên quan đến kết quả tồi tệ hơn.
Thông thường trong các giao thức Enhanced Recovery after Surgery (ERAS) để tìm ra thuật ngữ “hạn chế dịch truyền trong phẫu thuật” [73]. Tuy nhiên, các thuật ngữ thay thế, chẳng hạn như “cân bằng không” hoặc tránh dư thừa muối và nước, cũng có sẵn. Các giao thức ủng hộ việc truyền dịch tinh thể cân bằng từ 1-3 ml/kg/h và chỉ cung cấp thêm lượng dịch bổ sung để phù hợp với nhu cầu được đánh giá bằng thể tích đo được bị mất trong quá trình phẫu thuật, hoặc đánh giá tưới máu ngoại vi (chẳng hạn như được gọi là ‘Hạn chế dịch truyền hướng đến mục tiêu’) [74]. Nhìn chung, các tài liệu cho thấy rằng các phác đồ truyền dịch chu phẫu dựa trên thuật toán giúp cải thiện kết quả của bệnh nhân.
Quản lý dịch truyền sau phẫu thuật
Quản lý dịch truyền ở bệnh nhân sau phẫu thuật là yếu tố quyết định chính đến kết quả của họ. Mặc dù phục hồi thể tích hiệu quả là rất quan trọng đối với những bệnh nhân này, việc quản lý dịch truyền không nên làm ảnh hưởng đến quá trình chữa bệnh. Do đó, quản lý dịch truyền tối ưu nên nhắm đến hiệu quả huyết động trung tâm và tưới máu mô trong khi tránh cân bằng dịch ròng dương tính. Về lý thuyết, dung dịch keo có ưu điểm hơn dung dịch tinh thể là khả năng mở rộng thể tích cao hơn và thời gian bán hủy dài hơn. Chúng có nhược điểm về mặt lý thuyết là kéo dài thời gian đông máu và tăng nguy cơ chấn thương thận. Trong các thử nghiệm ngẫu nhiên, tỷ lệ giữa liều tích lũy của dung dịch keo so với liều tích lũy của dung dịch tinh thể dao động trong khoảng từ 0,41 đến 1 [75]. Ở những bệnh nhân bị giảm thể tích tuần hoàn trên lâm sàng, dung dịch keo vượt trội hơn dung dịch tinh thể trong việc cải thiện hiệu suất và áp lực làm đầy tim [76]. Tương tự như vậy, trong một thử nghiệm ngẫu nhiên đa quốc gia lớn được thực hiện ở những bệnh nhân bị bệnh nặng với giảm thể tích tuần hoàn cấp tính, dung dịch keo làm giảm sự phụ thuộc vào thuốc vận mạch và máy thở khi so sánh với dung dịch tinh thể [77]. Một đánh giá hệ thống gần đây về hồi sức với HES ở những bệnh nhân nặng do phẫu thuật đã xác định được 13 thử nghiệm ngẫu nhiên [78]. Tuy nhiên, tổng quan này không tìm thấy sự khác biệt có ý nghĩa thống kê giữa HES và dung dịch tinh thể, về tỷ lệ tử vong (tỷ lệ nguy cơ 2,97; KTC 95% 0,96-9,19; I2 = 0%), cần điều trị thay thế thận (tỷ lệ nguy cơ 1,11; KTC 95% 0,26 đến 4,69; I2 = 34%), và các biến chứng nhiễm trùng nặng (tỷ lệ nguy cơ 1,19; KTC 95% 0,59 đến 2,39; I2 = 0%).
Điều đáng nói là các thử nghiệm đủ điều kiện quá nhỏ để đưa ra kết luận chắc chắn về vấn đề này.
Cũng cần nói rõ rằng có những quan điểm đối lập liên quan đến việc sử dụng tinh bột [79]. Ví dụ, một số chỉ trích liên quan đến thử nghiệm CHEST đã được đưa ra mà vẫn cần được giải quyết [80, 81]. Hơn nữa, có thể nói rằng trong thử nghiệm CHEST, tinh bột được sử dụng cho những bệnh nhân không bị giảm thể tích. Mặt khác, thử nghiệm CRISTAL (trong đó 70% nhóm keo nhận được HES) kết luận rằng cần thể tích ít hơn đáng kể để đạt được sự ổn định huyết động đối với HES so với NaCl trong giai đoạn đầu của hồi sức dịch ở bệnh nhân nhiễm trùng huyết nặng mà không có bất kỳ sự khác biệt nào đối với các tác dụng ngoại ý ở cả hai nhóm [77]. Cân nhắc những quan điểm đối lập này, cuộc tranh luận đang diễn ra về việc sử dụng tinh bột ở những bệnh nhân nặng giảm thể tích vẫn cần thêm dữ liệu.
Trong số các bệnh nhân được phẫu thuật bụng lớn, các kết quả gần đây của thử nghiệm FLASH, cho thấy không có sự khác biệt đáng kể về kết quả tổng hợp là tử vong hoặc các biến chứng lớn sau phẫu thuật trong vòng 14 ngày sau phẫu thuật [82].
Trong khi chờ kết quả của các thử nghiệm đang diễn ra, hiện vẫn chưa có đủ dữ liệu để cấm sử dụng dung dịch keo trong phòng chăm sóc đặc biệt dành cho phẫu thuật.
Nhiều bệnh nhân trải qua phẫu thuật không thể ăn thức ăn hoặc dịch truyền trong một thời gian sau phẫu thuật và sẽ phải truyền dịch duy trì. Gần đây, một cuộc tranh luận nổi lên về trương lực của các dung dịch này: mặc dù các hướng dẫn truyền thống khuyến cáo sử dụng các dịch truyền duy trì giảm trương lực, trong các tài liệu về nhi khoa, chúng được chứng minh là có liên quan đến việc gia tăng tỷ lệ hạ natri máu có triệu chứng [83, 84]. Thử nghiệm TOPMAST ngẫu nhiên có đối chứng gần đây ở người lớn trải qua phẫu thuật lồng ngực lớn cho thấy vấn đề này là nhẹ ở những bệnh nhân này. Mặt khác, dịch truyền duy trì đẳng trương có liên quan đến cân bằng dịch truyền tích lũy dương tính lớn hơn đáng kể (ước tính khoảng 1,4L dương tính hơn khi dịch truyền chứa 154 so với 54 mmol/L natri) [85].
Tình trạng quá tải dịch truyền
Quá tải dịch truyền chu phẫu
Tăng thể tích máu ở một mức độ nhất định là cần thiết để duy trì tưới máu các cơ quan trong quá trình gây mê và phẫu thuật. Tuy nhiên, dịch truyền sau khi khởi mê chủ yếu làm tăng thể tích máu “không bị ép”, vì hiện tượng giãn mạch xảy ra do hậu quả của việc gây mê. Tại thời điểm này, cần bổ sung thêm dịch truyền để tối ưu hóa thể tích nhát bóp, tức là để thêm vào thể tích nội mạch “stress” [86]. Nhiều bác sĩ vẫn coi cách tiếp cận “ướt” này là tiêu chuẩn vàng cho điều trị bằng dịch trong phẫu thuật [87], mặc dù việc mở rộng thể tích nội mạch chắc chắn có một số nguy hiểm. Hoạt động của cơ tim và áp lực tim tăng lên khi dịch truyền vượt quá mức độ giãn mạch do gây mê. Hơn nữa, quá tải dịch truyền làm giảm áp lực thẩm thấu keo, cùng với tăng áp lực tim, có thể thúc đẩy phù phổi [88]. Những vấn đề này đặc biệt liên quan ở những bệnh nhân có tình trạng tim mạch kém. Cuối cùng, tăng thể tích máu có thể gây ra một tác dụng quan trọng khác: giải phóng các peptit natri lợi niệu (ANPs) của tâm nhĩ vào tuần hoàn do sự kéo căng của các sợi cơ tâm nhĩ [68, 89]. Thật vậy, để đáp ứng với việc truyền nhanh các dung dịch tinh thể, nồng độ ANP tăng lên gấp 2 đến 3 lần [90,91,92], do đó làm giảm sức căng tuần hoàn bằng cách thúc đẩy bài niệu natri và rò rỉ albumin ở mao mạch.
Quá tải dịch truyền trong Đơn vị chăm sóc tích cực
Truyền dịch là một trong những nền tảng của hồi sức huyết động ở những bệnh nhân nặng. Cho bao nhiêu dịch truyền đã là chủ đề của cuộc tranh luận sôi nổi trong nhiều năm. Quá nhiều dịch truyền có thể gây ra những hậu quả có hại đối với nhiều hệ thống cơ quan, ví dụ, làm xấu đi quá trình trao đổi khí, chức năng thận và việc chữa lành vết thương. Quá tải dịch truyền đặc biệt có khả năng phát sinh trong các điều kiện khi tính thấm của mao mạch bị thay đổi do phản ứng viêm, chẳng hạn như trong nhiễm trùng huyết. Cân bằng dịch dương có liên quan đến kết quả xấu hơn trong một số nghiên cứu ở nhiều nhóm bệnh nhân khác nhau của đơn vị chăm sóc đặc biệt (ICU) [16, 93,94,95]. Ở bệnh nhân sốc nhiễm trùng, truyền dịch và cân bằng dịch dương có liên quan độc lập với việc tăng tỷ lệ tử vong [93, 96]. Tương tự, ở những bệnh nhân nhập viện ICU sau phẫu thuật lớn, cân bằng dịch truyền là một yếu tố nguy cơ tử vong độc lập [95]. Thật vậy, chiến lược hạn chế dịch đa phương thức nhằm mục đích cân bằng dịch âm tính (điều trị PAL) ở bệnh nhân bị tổn thương phổi cấp tính (ALI) có liên quan đến kết quả cải thiện trong một nghiên cứu hồi cứu [97].
Cần phải thừa nhận rằng sự cân bằng dịch truyền dương tính có thể là dấu hiệu của bệnh hơn là một vấn đề do thầy thuốc, sẽ là sai lầm nếu giả định có thể ngăn ngừa đơn thuần bằng cách hồi sức dưới mức. Thật vậy, hồi sức không đầy đủ do truyền dịch không đủ có thể dẫn đến tưới máu mô kém hơn, do đó rối loạn chức năng và suy các cơ quan, đặc biệt là trong giai đoạn đầu của điều trị. Cần đạt được sự cân bằng, sao cho mỗi bệnh nhân nhận đủ nhưng không quá nhiều dịch truyền cho nhu cầu của họ. Điều quan trọng, các bệnh nhân khác nhau sẽ có nhu cầu và tình trạng dịch cơ bản khác nhau tùy thuộc vào nhiều yếu tố bao gồm tuổi tác, bệnh đồng mắc và chẩn đoán hiện tại. Ngoài ra, bắt buộc phải xem xét các chỉ số về khả năng dung nạp dịch truyền, chẳng hạn như CVP, nước phổi, oxy và nồng độ hemoglobin. Nhu cầu dịch truyền thay đổi trong suốt quá trình bệnh. Do đó, dịch truyền phải được kê đơn trên cơ sở từng bệnh nhân; đơn thuốc nên được xem xét thường xuyên và điều chỉnh cho phù hợp với giai đoạn lâm sàng đang phát triển. Do đó, câu trả lời cho câu hỏi liệu quá tải dịch truyền có phải là một vấn đề trong ICU hay không sẽ phụ thuộc vào thời điểm nó được hỏi. Trong giai đoạn hồi sức cấp tính/cứu hộ, truyền dịch rộng rãi.
Trong khi quá tải dịch truyền luôn luôn là mối quan tâm, thì sự cân bằng dịch truyền dương tính là mục tiêu cụ thể của giai đoạn này.
Giải hồi sức/xuống thang có phải là giải pháp không?
Thuật ngữ deresuscitation/de-escalation lần đầu tiên được đề xuất vào năm 2012 [98] và cuối cùng được đặt ra vào năm 2014 [16]. Nó đặc biệt đề cập đến “Loại bỏ dịch truyền có mục tiêu muộn”, liên quan đến “loại bỏ dịch truyền mạnh mẻ và tích cực thông qua thuốc lợi tiểu và liệu pháp thay thế thận bằng siêu lọc ròng”. Giải hồi sức (deresuscitation)/xuống thang (de-escala- tion) đôi khi cũng được sử dụng để chỉ giai đoạn bệnh nguy kịch và/hoặc chăm sóc bệnh nhân nặng, sau khi hồi sức, ổn định và tối ưu hóa ban đầu. Nó được đặc trưng bởi việc ngừng các liệu pháp xâm lấn và giảm cân bằng dịch truyền giả. Quản lý dịch hạn chế muộn được định nghĩa là 2 ngày liên tục cân bằng dịch âm tính trong tuần đầu tiên ở ICU, và là một yếu tố dự báo độc lập về khả năng sống sót ở bệnh nhân ICU [16].
Quá tải dịch truyền và cân bằng dịch truyền tích lũy dương tính có liên quan đến tăng tỷ lệ mắc bệnh và kết quả xấu hơn, như đã thảo luận trước đây. Diễn biến tự nhiên của các sự kiện sau một lần xúc phạm đầu tiên (như nhiễm trùng, chấn thương, v.v.) là phản ứng viêm toàn thân với tăng tính thấm mao mạch và rối loạn chức năng cơ quan [98]. Do đó, sự hiện diện của quá tải dịch truyền và phù nề kẽ có thể gây ra một vòng luẩn quẩn. Đây là những gì đã được gọi là giai đoạn Ebb (Ebb phase) của sốc [16]. Ở đa số bệnh nhân, xảy ra tình trạng đảo ngược sốc (với kháng sinh chính xác và kiểm soát nguồn thích hợp) và có thể huy động lượng dịch dư thừa: đây được gọi là giai đoạn Flow (Flow phase) [16]. Tuy nhiên, một số bệnh nhân sẽ không chuyển một cách tự nhiên từ giai đoạn Ebb sang Flow và sẽ vẫn trong tình trạng sốc chưa được giải quyết với cân bằng dịch tích lũy dương tính, và đây là lúc mà giải hồi sức/xuống thang có thể đóng một vai trò quan trọng.
Không rõ đâu là lựa chọn điều trị tốt nhất để giải hồi sức/xuống thang. Việc sử dụng albumin kết hợp với thuốc lợi tiểu (20% albumin để đạt được mức albumin huyết thanh là 30 g/L và furosemide bolus là 60 mg, sau đó là truyền liên tục 10 mg/giờ) và mối liên hệ của chiến lược này với việc áp dụng tuần tự PEEP được thiết lập để chống lại áp lực trong ổ bụng (IAP) đã được đề xuất [97]. Ngoài ra, liệu pháp thay thế thận và siêu lọc tích cực có thể được sử dụng để đạt được cân bằng dịch âm tính ở một số bệnh nhân được chọn [99]. Khi nói đến giải hồi sức/xuống thang, điều quan trọng là phải quyết định khi nào, như thế nào và trong bao lâu. Với mục đích này, chúng ta cần sử dụng đúng mục tiêu để đạt được mục tiêu của mình. “Giải hồi sức quá mức” có những hạn chế của nó và có thể gây rối loạn chức năng thần kinh về lâu dài [100].
Kết luận, điều quan trọng là phải đảm bảo rằng chỉ định hồi sức truyền dịch không còn tồn tại (ví dụ, không dùng thuốc vận mạch, không tăng lactate, bão hòa oxy tĩnh mạch của hemoglobin đầy đủ) trước khi bắt đầu giải hồi sức. Hơn nữa, 5 bước của Giải hồi sức/xuống thang cần được ghi nhớ: (1) xác định điểm cuối lâm sàng (ví dụ, cải thiện khả năng cung cấp oxy); (2) đặt mục tiêu cân bằng dịch truyền (ví dụ: cân bằng âm 1 L trong 24 giờ); (3) thiết lập các biện pháp phòng ngừa an toàn cho thận và truyền dịch (ví dụ, cần dùng thuốc vận mạch, tăng creatinin huyết thanh 25%); (4) đánh giá lại sau 24 h trừ khi đạt đến giới hạn an toàn; (5) điều chỉnh kế hoạch cho phù hợp.
4 giai đoạn của liệu pháp dịch truyền và ý tưởng R.O.S.E. hoặc S.O.S.D.
Hai bài báo đã được xuất bản gần đây, gần như đồng thời, đề cập đến động lực của liệu pháp dịch truyền [16, 101]. Các mô hình khái niệm này xác định bốn giai đoạn động. Nhóm Sáng kiến Chất lượng Lọc máu Cấp tính (ADQI) đã đề xuất
S.O.S.D. (Cứu cánh, Tối ưu hóa, Ổn định, Xuống thang) là từ viết tắt [101]. Tuy nhiên, trong các cuộc họp của Ngày Học viện Dịch truyền Quốc tế (IFAD), có sự ưu tiên rõ ràng đối với R.O.S.E. từ viết tắt (Hồi sức, Tối ưu hóa, Ổn định, Dẫn lưu) như được tóm tắt dưới đây, trong Hình 1 và Bảng
Chúng tôi đã cố gắng đề xuất các điểm cuối và mục tiêu cho các giai đoạn khác nhau; tuy nhiên, nó đã được quyết định không bao gồm chúng vì không thể có một mục tiêu cụ thể của chỉ số tim và PPV phải được xem xét chỉ khi cung lượng tim thấp. PPV cao thường là một trạng thái sinh lý và việc xác định trạng thái “bình thường” khi đạt đến giá trị PPV thấp có thể dẫn đến truyền dịch không cần thiết [102]. Ngoài ra, việc xác định mức tiền tải nhất định làm mục tiêu hồi sức là vô nghĩa vì nó có thể thay đổi từ bệnh nhân này sang bệnh nhân khác và tùy từng thời điểm.
Giai đoạn hồi sức (R – Resuscitation) hoặc giai đoạn cứu hộ (S – Salvage)
Trong giai đoạn cứu hộ/hồi sức đầu tiên, khi bệnh nhân có biểu hiện sốc huyết động, mục tiêu của điều trị là hồi sức và điều chỉnh sốc với áp lực tưới máu đầy đủ. Nên truyền nhanh một liều (lượng chính xác có thể thay đổi, thường là 3–4 mL/kg trong 10 đến 15 phút và lặp lại khi cần thiết), thường kết hợp với dùng thuốc vận mạch. Song song, các thủ thuật khẩn cấp để giải quyết bất kỳ nguyên nhân cơ bản rõ ràng nào nên được thực hiện, với việc theo dõi huyết động bắt đầu.
![Liệu pháp truyền dịch qua đường tĩnh mạch trong môi trường chu phẫu và chăm sóc tích cực: Tóm tắt thực hành của Học viện dịch truyền quốc tế (IFA) 8 Hình 1 Khái niệm R.O.S.E. và 4 giai đoạn của Liệu pháp dịch truyền. Được điều chỉnh với sự cho phép của Malbrain et al. [9]. Biểu đồ thể hiện mô hình bốn cú đấm với sự tiến triển của tình trạng thể tích dịch truyền tích lũy của bệnh nhân theo thời gian trong năm giai đoạn khác nhau của hồi sức: Hồi sức (R), Tối ưu hóa (O), Ổn định (S) và Dẫn lưu (E) (ROSE), tiếp theo là nguy cơ có thể xảy ra giảm tưới máu trong trường hợp hồi sức quá tích cực. Khi nhập viện, bệnh nhân giảm thể tích tuần hoàn, tiếp theo là mất thể tích tuần hoàn sau khi hồi sức dịch (EAFM, quản lý đủ dịch sớm), và có thể quá tải dịch, tiếp theo là giai đoạn chuyển sang giảm thể tích tuần hoàn với xử trí dịch bảo tồn muộn (LCFM) và loại bỏ dịch có mục tiêu muộn (LGFR) hoặc hồi sức. Trong trường hợp giảm thể tích máu, O2 không thể đi vào mô do các vấn đề đối lưu, trong trường hợp tăng thể tích máu thì O2 không thể vào mô do các vấn đề khuếch tán liên quan đến phù kẽ và phù phổi, phù ruột (hồi tràng và tăng áp lực ổ bụng). b Vai trò của dịch truyền trong ý tưởng R.O.S.E.](https://nhathuocngocanh.com/wp-content/uploads/2022/07/lieu-phap-truyen-dich-qua-duong-tinh-mach-trong-moi-truong-chu-phau-va-cham-soc-tich-cuc-tom-tat-thuc-hanh-cua-hoc-vien-dich-truyen-quoc-te-ifa-anh-1.jpg)
| Resuscitation (R) | Optimization (O) | Stabilization (S) | Evacuation (E) | ||
| Cú đấm | Thứ nhất | Thứ hai | Thứ hai | Thứ ba | Thứ tư |
| Nguyên nhân | Tổn thương do viêm, ví dụ, nhiễm trùng huyết, viêm tụy cấp tính nặng (SAP), bỏng, chấn thương, v.v. | Thiếu máu cục bộ và tái tưới máu | Thiếu máu cục bộ và tái tưới máu | GIPS (hội chứng tăng tính thấm toàn cục) | Giảm tưới máu |
| Giai đoạn | Ebb | Flow | Flow/no Flow | Không có chuyển biến gì | Không có chuyển biến gì |
| Loại hình | Sốc nặng | Không ổn định | Ổn định | Phục hồi | Không ổn định |
| Thí dụ | Sốc nhiễm trùng, chấn thương nặng, sốc xuất huyết, vỡ phình động mạch chủ bụng, viêm tụy cấp nặng, bỏng nặng (> 25% TBSA) | Liệu pháp hướng đến mục tiêu trong và sau phẫu thuật, bỏng ít nghiêm trọng hơn (<25% TBSA), nhiễm toan ceton do tiểu đường, tổn thương dạ dày-ruột nghiêm trọng (nôn mửa, viêm dạ dày ruột) | Bệnh nhân sau phẫu thuật (không được uống hoặc kết hợp dinh dưỡng qua đường ruột và đường tĩnh mạch), đóng ổ bụng có hỗ trợ hút chân không, thay thế các tổn thương trong viêm tụy cấp ít nghiêm trọng hơn | Bệnh nhân được nuôi bằng đường ruột hoàn toàn trong giai đoạn hồi phục của bệnh hiểm nghèo, giai đoạn đa niệu sau khi hồi phục từ hoại tử ống thận cấp tính | Bệnh nhân bị xơ gan và phù toàn thân (GIPS) và không có chảy máu, giảm tưới máu vùng gan |
| Câu hỏi | Khi nào bắt đầu truyền dịch? | Khi nào ngừng truyền dịch? | Khi nào ngừng truyền dịch? | Khi nào bắt đầu dỡ tải? | Khi nào thì dừng dỡ tải? |
| Câu hỏi phụ | Lợi ích của dịch truyền? | Nguy cơ của dịch truyền? | Nguy cơ của dịch truyền? | Lợi ích của việc dỡ hàng? | Nguy cơ khi dỡ tải? |
| Vận chuyển O2 | Vấn đề đối lưu | Đẳng thể tích, khuếch tán bình thường | Vấn đề khuếch tán | Đẳng thể tích, khuếch tán bình thường | Vấn đề đối lưu |
| Dịch truyền | Bắt buộc | Dấu ấn sinh học của bệnh hiểm nghèo | Dấu ấn sinh học của bệnh hiểm nghèo | Độc hại | |
| Liệu pháp truyền dịch | Bolus nhanh (4 ml/kg/10-15 phút) | Chuẩn độ dịch truyền duy trì, sử dụng cẩn thận hạn chế dịch truyền | Duy trì tối thiểu nếu uống không đủ, cung cấp dịch truyền thay thế | Uống nếu có thể Tránh truyền dịch không cần thiết | Tránh giảm tưới máu |
| Cân bằng dịch truyền | Dương tính | Trung tính | Trung tính/Âm tính | Âm tính | Trung tính |
| Kết quả | Cứu sống (cứu hộ, cứu nạn) | Cứu cơ quan (duy trì) | Hỗ trợ cơ quan (cân bằng nội môi) | Phục hồi cơ quan (loại bỏ) | Hỗ trợ cơ quan |
| Các mục tiêu | Huyết động học vĩ mô (MAP, CO); lactate; tiền tải thể tích (LVEDAI); huyết động chức năng; khả năng đáp ứng dịch truyền (PLR, EEO) | Tưới máu vĩ mô cơ quan (MAP, APP, CO, ScvO2); tiền tải thể tích (GEDVI, RVEDVI); GEF hiệu chỉnh; R/L shunt; nghĩ đến hội chứng đa ngăn, CARS | Chức năng cơ quan (EVLWI, PVPI, IAP, APP); dấu ấn sinh học (NGAL, cystatin-C, citrullin); dấu hiệu rò rỉ mao mạch (áp lực keo, độ thẩm thấu, CLI, RLI); FB hàng ngày và tích lũy, cân nặng | Sự tiến triển chức năng cơ quan (tỷ lệ P/F, EVLWI, IAP, APP, PVPI) Thành phần cơ thể (ECW, ICW, TBW, VE) | Tưới máu vi cơ quan (pHi, ScvO2, lactate, ICG-PDR); Dấu ấn sinh học; Cân bằng dịch truyền tích lũy âm |
| Công cụ theo dõi | Đường động mạch, đường tĩnh mạch trung tâm, PPV hoặc SVV (thủ công hoặc qua máy monitor), CO, TTE, TEE chưa hiệu chỉnh | CO đã hiệu chuẩn (TPTD, PAC) | CO hiệu chuẩn (TPTD); Xuất nhập; BIA (ECW, ICW, TBW, VE) | CO hiệu chuẩn (TPTD); Xuất nhập; BIA; xuống thang | LiMON, Máy đo pH dạ dày, lọc máu vi mô |
| Mục tiêu | Điều chỉnh sốc (EAFM — quản lý dịch truyền đầy đủ sớm) | Duy trì tưới máu mô | Nhắm đến cân bằng dịch truyền bằng không hoặc âm (LCFM – quản lý dịch truyền hạn chế muộn) | Di động tích tụ dịch (LGFR — loại bỏ dịch truyền hướng đến mục tiêu muộn) hoặc giải hồi sức | Duy trì tưới máu mô |
| Thời gian | Phút | Giờ | Ngày | Ngày đến tuần | Tuần |
APP: Áp lực tưới máu ổ bụng, = MAP – IAP, BIA: phân tích trở kháng điện sinh học, CARS: hội chứng tim-thận bụng, CLI: chỉ số rò rỉ mao mạch, = CRP huyết thanh chia cho albumin huyết thanh, CO: cung lượng tim, ECW: nước ngoại bào, EEO: thử nghiệm tắc nghẽn đường thở cuối thì thở ra, EVLWI: chỉ số nước phổi ngoài mạch, GEDVI: chỉ số thể tích cuối kỳ tâm trương toàn cục, GEF: phân suất tống máu toàn cục, GIPS: hội chứng tăng thấm toàn cục, IAP: áp lực trong ổ bụng, ICG-PDR: tỷ lệ biến mất indocyaninegreen huyết tương, ICW: nước nội bào, IV: tĩnh mạch, LVEDAI: chỉ số diện tích tâm thất cuối tâm trương trái, MAP: áp lực động mạch trung bình, P/F: tỷ lệ pO2 trên FiO2, PLRT: nâng chân thụ động, PPV: biến thiên áp lực mạch, PVPI: chỉ số tính thấm mạch phổi, RLI: chỉ số rò rỉ thận, = albumin nước tiểu chia cho creatinin nước tiểu, R/L shunt: shunt từ phải sang trái, RVEDVI chỉ số thể tích cuối tâm trương thất phải, SAP: viêm tụy cấp nặng, ScvO2: độ bão hòa oxy tĩnh mạch trung tâm, SVV: biến đổi thể tích nhát bóp, TBSA tổng số Diện tích bề mặt bị bỏng, TBW: tổng lượng nước trong cơ thể, TPTD: siêu âm tim qua thực quản, TTE: siêu âm tim qua lồng ngực, VE: lượng dư
Trong giai đoạn này, mục tiêu là quản lý dịch truyền theo hướng mục tiêu sớm: cân bằng dịch truyền phải dương tính. Chúng tôi không ủng hộ việc tuân thủ một cách mù quáng các nguyên tắc của surviving sepsis campaign adagio để truyền 30 ml/kg dịch truyền trong vòng giờ đầu tiên cho tất cả bệnh nhân, như đã giải thích trước đây [9]. Điều này có thể dẫn đến hồi sức quá mức hoặc dưới mức ở một số bệnh nhân. Mỗi bệnh nhân cần một cách tiếp cận cá nhân và được cá nhân hóa.
Giai đoạn tối ưu hóa (O-Optimization)
Giai đoạn tối ưu hóa bắt đầu khi bệnh nhân không còn trong tình trạng giảm thể tích tuần hoàn tuyệt đối/tương đối, nhưng huyết động vẫn không ổn định. Một số hình thức giám sát hiện sẽ
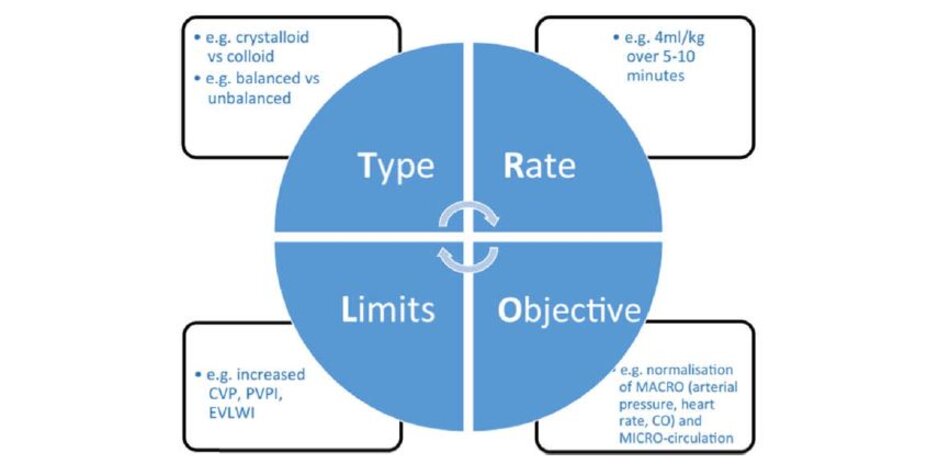
được áp dụng. Dịch truyền nên được sử dụng theo nhu cầu cá nhân, được đánh giá lại một cách thường xuyên, ví dụ, sử dụng kỹ thuật thử thách dịch truyền [103, 104]. Thử thách dịch truyền phải được tiến hành cẩn thận, lưu ý bốn thành phần thiết yếu (TROL): Loại dịch truyền (ví dụ, PlasmaLyte dạng tinh thể cân bằng); Tốc độ (ví dụ, 100–200 mL trong 10 phút); Mục tiêu (ví dụ, áp lực động mạch hoặc nhịp tim bình thường); và Giới hạn (ví dụ, mức áp lực tĩnh mạch trung tâm cao) (Hình 2) [105]. Mục đích của giai đoạn này là tối ưu hóa và duy trì tưới máu mô và oxy đầy đủ để ngăn ngừa và hạn chế tổn thương cơ quan. Bệnh nhân phải được theo dõi cẩn thận trong giai đoạn tối ưu hóa: thường cần một số loại theo dõi (ví dụ: ống thông động mạch, siêu âm tim, áp lực tĩnh mạch trung tâm, khí máu động mạch) để có được bức tranh đầy đủ nhất về tình trạng huyết động của bệnh nhân.
Mặc dù việc hồi sức dựa trên các điểm cuối vi tuần hoàn được kỳ vọng sẽ dẫn đến sự cải thiện tương tự trong vi tuần hoàn, sự thiếu chặt chẽ có thể tồn tại giữa đại tuần hoàn và vi tuần hoàn. Do đó, các dấu hiệu của giảm tưới máu nên bao gồm cả lactate, thời gian nạp đầy mao mạch kéo dài và thang điểm da nổi bông [106].
Giai đoạn ổn định (S-Stabilization)
Một khi bệnh nhân ổn định, giai đoạn ổn định bắt đầu và tiến triển trong nhiều ngày. Trong giai đoạn này, mục đích của quản lý dịch truyền là đảm bảo nước và chất điện giải để thay thế những thất thoát đang diễn ra và cung cấp hỗ trợ cho các cơ quan. Mục tiêu phải là cân bằng dịch truyền bằng không hoặc hơi âm. Trong bối cảnh này, có thể được quan tâm khi nhấn mạnh thực tế là trong các thử nghiệm lớn cho thấy tác dụng có hại của tinh bột (HES) [2, 107], những dung dịch keo này cũng được cung cấp nhiều trong giai đoạn ổn định, tức là trong giai đoạn có thể không yêu cầu các loại thuốc này.
Giai đoạn dẫn lưu (E-Evacuation) hoặc giai đoạn xuống thang (D-De- escalation)
Giai đoạn cuối cùng là dẫn lưu hoặc xuống thang, với mục đích loại bỏ dịch truyền quá mức. Điều này sẽ thường xuyên đạt được nhờ bài niệu tự phát khi bệnh nhân hồi phục, mặc dù có thể cần siêu lọc hoặc dùng thuốc lợi tiểu. Đáng chú ý, gần đây người ta đã chỉ ra rằng thuốc lợi tiểu có thể tạo lợi thế cho vi tuần hoàn, do đó làm giảm khoảng cách khuếch tán và cải thiện việc trích xuất oxy [108].
Xử trí dịch truyền trong chấn thương và bỏng
Xử trí dịch truyền trong sốc xuất huyết cấp tính sau chấn thương
Mặc dù chấn thương sọ não vẫn là nguyên nhân gây tử vong phổ biến nhất sau chấn thương nặng, nhưng xuất huyết nặng đồng thời sẽ dẫn đến giảm tưới máu não, chắc chắn góp phần gây ra chấn thương sọ não thứ phát và tử vong. Do đó, xuất huyết vẫn là nguyên nhân có thể ngăn ngừa được nhất gây tử vong do chấn thương.
Một thể tích nội mạch, nồng độ hemoglobin và độ bão hòa oxy thích hợp là những yếu tố cần thiết để duy trì quá trình trao đổi chất hiếu khí. Con người không chịu được quá trình trao đổi chất kỵ khí và 90% lượng oxy tiêu thụ được sử dụng để hình thành adenosine triphosphate (ATP), nguồn năng lượng chính cho chức năng của tế bào. Sự đảo ngược nhanh chóng của quá trình chuyển hóa kỵ khí là bắt buộc để khôi phục ATP và ngăn chặn quá trình chết và apoptosis của tế bào không thể đảo ngược [109].
Nhận thức rằng giảm thể tích tuần hoàn là hậu quả của sốc xuất huyết, các chiến lược trước đây đã sử dụng các dung dịch tinh thể để khôi phục thể tích nội mạch, sau đó là truyền máu. Tuy nhiên, dung dịch tinh thể không mang oxy và việc cung cấp oxy chỉ có thể được tăng cường khi có nồng độ hemoglobin thích hợp. Hơn nữa, xuất huyết nặng đi kèm với rối loạn đông máu (Acute Coagulopathy of Trauma and Shock – ACoTS) [110], dẫn đến hình thành cục máu đông kém, do tăng liên kết của thrombin với thrombomodulin và tăng cường quá trình tiêu sợi huyết. Pha loãng các yếu tố đông máu, nhiễm toan và hạ thân nhiệt đóng vai trò thứ yếu trong trường hợp này. Do đó, cách tiếp cận hồi sức phải chủ động và không phản ứng với việc sử dụng kết hợp các hồng cầu lắng, huyết tương, tiểu cầu và kết tủa lạnh. Nên hạn chế tối đa việc sử dụng các dịch truyền hồi sức trong (clear resuscitation fluids). Dựa trên kinh nghiệm quân sự, tỷ lệ hồng cầu lắng với huyết tương và tiểu cầu được khuyến nghị là 1:1:1. Các tiêu chí điểm cuối cho nồng độ hemoglobin là 10 g/dL, số lượng tiểu cầu > 50.000, INR < 1,5 và nồng độ fibrinogen > 1 g/L thường không được khuyến cáo. Ngoài ra, mức canxi ion hóa phải > 1,0 mmol/L.
Mặc dù những điều trên là khuyến cáo chung, nhưng không phải tất cả bệnh nhân đều yêu cầu một cách tiếp cận tích cực như vậy [111]. Thật vậy, việc truyền máu quá sốt sắng có liên quan đến những biến chứng không mong muốn.
Cách tiếp cận tiêu chuẩn là sử dụng xét nghiệm đông máu thông thường trong phòng thí nghiệm để xác định nhu cầu điều trị thành phần. Tuy nhiên, các bước này được thực hiện ở nhiệt độ phòng và không phản ánh các bước riêng lẻ trong quá trình đông máu. Đo độ đàn hồi cục máu đông (thromboelastometry) hiện đã được công nhận là một công cụ cần thiết để theo dõi rối loạn đông máu trong chấn thương [112]. Thiết bị này phản ánh toàn bộ quá trình đông máu và có thể xác định bằng đồ thị sự cần thiết của các yếu tố đông máu cụ thể. Không giống như các nghiên cứu đông máu trong phòng thí nghiệm, máy đo độ đàn hồi cục máu đông hiện đại có thể được đặt ở nhiệt độ lõi của bệnh nhân và phản ánh chính xác tình trạng đông máu in vivo. Những dụng cụ này phải là tiêu chuẩn chăm sóc tại các trung tâm xử lý chấn thương lớn.
Sau thử nghiệm CRASH-2 cho thấy lợi ích của axit tranexamic được cung cấp trong vòng 3 giờ kể từ khi bị thương, điều trị như vậy đã được đưa vào nhiều phác đồ điều trị xuất huyết nặng
[112]. Trong sự hiện diện của một hệ thống chấn thương tinh vi, những lợi ích là không thể nghi ngờ và dữ liệu thêm được đảm bảo [113].Xử trí dịch truyền khi bị bỏng
Sự hiểu biết về sinh lý bệnh của sốc bỏng và sự phát triển sau đó của các chiến lược hồi sức dịch truyền đã dẫn đến những cải thiện đáng kể về kết quả chăm sóc bỏng trong những thập kỷ qua [114]. Tuy nhiên, trong khi hồi sức dưới mức trở nên hiếm trong thực hành lâm sàng, ngày càng có nhiều lo ngại rằng việc hồi sức quá mức, dẫn đến gia tăng bệnh tật và tử vong, đã trở thành một vấn đề ngày càng trở nên phổ biến hơn trong chăm sóc bỏng. Vào cuối những năm 60 của thế kỷ trước, Baxter và Shires đã phát triển công thức mang tính bước ngoặt của họ tại Bệnh viện Parkland Memorial, đã kéo dài nhiều thập kỷ như là tiêu chuẩn vàng cho việc hồi sức bằng dịch truyền trong chăm sóc bỏng cấp tính trên toàn thế giới [115]. Công thức ủng hộ 4 ml dung dịch tinh thể trên mỗi kg trên % tổng diện tích bề mặt cơ thể trong 24 giờ, trong đó một nửa được cung cấp trong 8 giờ đầu tiên. Lợi tiểu (mục tiêu 1 ml/kg/h) được sử dụng để dẫn lượng dịch truyền tĩnh mạch. Trong 24 giờ thứ hai của hồi sức, cho phép dung dịch keo và thể tích thuốc hồi sức được điều chỉnh tùy theo bài niệu (có thể giảm dần nếu bài niệu đủ).
Tuy nhiên, trong 15 năm qua, nhiều trung tâm đã báo cáo việc truyền dịch quá mức [116, 117]. Sự dư thừa dịch truyền này thường dẫn đến “bệnh lý hồi sức”, một nhóm các biến chứng liên quan đến quá tải dịch truyền, chẳng hạn như chậm lành vết thương, chậm phục hồi chức năng dạ dày-ruột (với hồi tràng), phù phổi (do rò rỉ mao mạch và tăng nước phổi ngoài mạch) ), hội chứng khoang chi, hội chứng khoang ổ mắt, tăng áp trong ổ bụng và hội chứng khoang bụng dẫn đến suy đa tạng [118,119,120].
Sự khác biệt này giữa dịch truyền dự đoán và dịch truyền được sử dụng được gọi là “dịch truyền leo” (fluid creep), một thuật ngữ được Basil Pruitt đưa vào cuộc sống [119].
Các khuyến cáo về hồi sức dịch trong bỏng được liệt kê trong Bảng 4. Tác dụng ngoại ý được biết đến nhiều nhất của NaCl 0,9% là nhiễm toan chuyển hóa tăng clo máu. Với thể tích truyền lớn được dùng cho bệnh nhân bỏng, các dung dịch cân bằng được ưu tiên hơn. Thật vậy, kể từ khi bắt đầu hồi sức bỏng, hầu hết các công thức đều ủng hộ việc sử dụng các dung dịch tinh thể cân bằng. Đáng chú ý, một nghiên cứu quan sát đã báo cáo điểm Đánh giá Thất bại Cơ quan Tuần tự (SOFA) thấp hơn ở những bệnh nhân bị bỏng nặng được hồi sức với acetated Ringer’s [121].
Việc sử dụng dung dịch keo trong 24 giờ đầu tiên đã gây tranh cãi vì người ta cho rằng sự rò rỉ mao mạch hiện tại sẽ cho phép các phân tử lớn lọt ra ngoài khoang mạch máu và gây ra một lực kéo thẩm thấu làm tăng sự hình thành phù nề [122]. Trong 15 năm qua, mối quan tâm mới đến dung dịch keo đã phát sinh trong quá trình hồi sức bỏng, được thúc đẩy bởi nhận thức về bệnh tật liên quan đến hồi sức và truyền dịch. Cho đến gần đây, dung dịch HES trọng lượng phân tử thấp được sử dụng rộng rãi như một dịch truyền hồi sức cho bệnh nhân nặng, phẫu thuật và bỏng ICU. Tuy nhiên, sau các thử nghiệm dịch truyền lớn, bao gồm cả thử nghiệm CHEST và 6S, cho thấy tỷ lệ tử vong tăng và tỷ lệ điều trị thay thế thận cao hơn đã đưa ra kết luận đáng báo động về tính an toàn của các dung dịch HES, tinh bột không còn có thể được sử dụng trong vết thương bỏng theo khuyến cáo của Cảnh giác Dược Ủy ban Đánh giá Nguy cơ (PRAC) [2, 107, 123].
Bảng 4 Các khuyến nghị liên quan đến hồi sức bằng dịch truyền ở bệnh nhân bỏng nặng.
| Loại dịch truyền | Khuyến cáo |
| 1. Nước muối sinh lý | Do thực tế là hồi sức bằng dịch truyền trong xử trí bỏng đòi hỏi khối lượng lớn, việc sử dụng nước muối không thể được khuyến nghị trong quy trình hồi sức bỏng |
| 2. DD tinh thể cân bằng | Dựa trên các bằng chứng sẵn có, dung dịch tinh thể cân bằng là một dịch truyền hồi sức ban đầu thực dụng ở phần lớn bệnh nhân bị bệnh nặng (và bỏng). |
| 3. Dung dịch keo bán tổng hợp | Với dữ liệu gần đây liên quan đến việc sử dụng dung dịch keo bán tổng hợp (và đặc biệt là tinh bột), việc sử dụng chúng cho những bệnh nhân bị bệnh nặng, bao gồm cả bệnh nhân bỏng, không được khuyến khích. |
| 4. Albumin | Dựa trên các bằng chứng sẵn có, việc sử dụng albumin 20% có thể được khuyến cáo trong trường hợp bỏng nặng, đặc biệt là trong giai đoạn hồi sức cấp cứu được hướng dẫn bởi các chỉ số rò rỉ mao mạch, trọng lượng cơ thể, cân bằng dịch (tích lũy), quá tải dịch, nước phổi ngoài mạch và IAP |
| 5. Các dung dịch ưu trương | Cho đến ngày nay, vẫn chưa có đủ bằng chứng để đạt được sự đồng thuận về tính an toàn của nước muối ưu trương trong hồi sức bỏng. Tuy nhiên, bất cứ khi nào sử dụng nước muối ưu trương trong thực hành lâm sàng, nên theo dõi chặt chẽ nồng độ natri. |
Albumin là một protein huyết tương tự nhiên góp phần nhiều nhất vào việc tăng áp lực keo nội mạch ở người (xem ở trên). Các dung dịch phổ biến nhất là albumin 4%, 5% hoặc 20%. Đây là một dung dịch tương đối đắt tiền và tính khả dụng của nó có thể bị hạn chế ở một số quốc gia. Mặc dù hồi sức bằng albumin đã được sử dụng với một số dự phòng, đặc biệt là trong giai đoạn cấp tính của hồi sức bỏng, các thử nghiệm cung cấp dữ liệu đầy hứa hẹn về việc sử dụng albumin như một liệu pháp bổ trợ trong hồi sức bỏng [124, 125]. Tương tự, nước muối ưu trương đã được sử dụng trong nhiều thập kỷ trong hồi sức bỏng; về mặt lý thuyết, nó mở rộng thể tích tuần hoàn bằng sự dịch chuyển nước từ mô kẽ vào trong nội mạch. Những người ủng hộ cho rằng quá trình này sẽ làm giảm phù nề mô và giảm tỷ lệ biến chứng. Tuy nhiên, giả thuyết này cần được xác nhận bởi các nghiên cứu sâu hơn.
Tin nhắn về nhà và cân nhắc trước khi kê đơn dịch truyền qua đường tĩnh mạch
Hãy xem xét đơn thuốc 5 Ps của dịch truyền như thể hiện trong Hình 3 và điều chỉnh dịch truyền IV cho phù hợp với nhu cầu của bệnh nhân thông qua dịch vụ chăm sóc cá nhân và cá nhân hóa (Bảng 5) [126]. Sự an toàn theo toa có thể được tóm tắt bằng nguyên tắc ‘4 D’ như đã giải thích ở trên [4]:
- Thuốc — dịch truyền.
- Liều lượng — tính toán lượng thuốc cần cung cấp.
- Thời gian — thời gian của liệu pháp truyền dịch qua đường tĩnh mạch.
- Xuống thang — hãy dừng việc đó càng sớm càng tốt.
Điểm mấu chốt là “Cung cấp đúng dịch truyền, đúng liều lượng cho đúng bệnh nhân vào đúng thời điểm”
Bảng 5 Bốn giai đoạn để kiểm tra sự phù hợp của liệu pháp truyền dịch qua đường tĩnh mạch.
| Giai đoạn đánh giá | Tiêu chuẩn kiểm tra |
| 1. Đánh giá | Cân bằng dịch truyền của bệnh nhân (thông qua biểu đồ dịch truyền với đầu vào và đầu ra) được đánh giá khi nhập viện và hàng ngày Cân nặng của bệnh nhân được đánh giá trong vòng 3 ngày cuối cùng khi kê đơn dịch truyền Nhu cầu về dịch truyền và chất điện giải của bệnh nhân được đánh giá như một phần của mọi cuộc đánh giá tại khoa Việc đánh giá tình trạng dịch truyền của bệnh nhân (giảm/đồng/tăng thể tích máu) bao gồm việc sử dụng đánh giá lâm sàng, các dấu hiệu sinh tồn và cân bằng dịch truyền với lượng nước tiểu Kết quả phòng thí nghiệm gần đây với urê và chất điện giải (trong vòng 24 giờ kể từ khi kê đơn dịch truyền) Nếu có thể cân bằng natri nên được báo cáo |
| 2. Chỉ định | A. Hồi sức Đối với những bệnh nhân cần được hồi sức bằng dịch truyền: Nguyên nhân của sự thiếu dịch được xác định Một đánh giá về sốc hoặc giảm tưới máu đã được thực hiện Một bolus dịch truyền 4 mL/kg dung dịch tinh thể cân bằng được đưa ra Khả năng đáp ứng với dịch truyền được đánh giá bằng huyết động học chức năng, kiểm tra nâng chân thụ động hoặc kiểm tra tắc đường thở cuối kỳ thở ra, hoặc kết hợp Áp lực động mạch trung bình và cung lượng tim được theo dõi liên tục thông qua phân tích đường viền xung cho phép đánh giá sự thay đổi theo từng nhịp tim Những bệnh nhân đã được hồi sức truyền dịch ban đầu được đánh giá lại trong vòng 30 phút Việc chăm sóc được nâng cấp ở những bệnh nhân đã được truyền > 2000 mL dung dịch tinh thể và vẫn cần hồi sức dịch sau khi đánh giá lại Những bệnh nhân chưa có > 2000 mL dung dịch tinh thể và vẫn cần hồi sức dịch sau khi đánh giá lại nhận được 2–4 mL/kg dung dịch tinh thể và được đánh giá lại thêm |
| B. Duy trì Nếu bệnh nhân cần truyền dịch tĩnh mạch đơn thuần để duy trì định kỳ, đơn thuốc ban đầu được giới hạn trong: 25–30 mL/kg/ngày (1 mL/kg/h) nước và Khoảng 1 mmol/kg/ngày kali (K+) và Khoảng 1–1,5 mmol/kg/ngày natri (Na+) và Khoảng 1 mmol/kg/ngày clorua và Khoảng 50–100 g/ngày (1-5 g/kg/ngày) glucose để hạn chế nhiễm ceton do đói Định nghĩa về sự không phù hợp trong trường hợp rối loạn điện giải: |
| Dung dịch không chứa đủ lượng natri trong trường hợp hạ natri máu (Na < 135 mmol/L) Dung dịch không chứa đủ lượng kali trong trường hợp hạ kali máu (K < 3,5 mmol/L) Dung dịch chứa quá nhiều natri trong trường hợp tăng natri huyết (Na > 145 mmol/L) Dung dịch chứa quá nhiều kali trong trường hợp hạ kali máu (K > 5 mmol/L) Lượng dịch truyền đưa vào qua các nguồn khác nên được trừ đi nhu cầu duy trì cơ bản là 1 ml/kg/h: Dinh dưỡng đường ruột hoặc đường tiêm Dịch truyền creep (xem thêm) | |
| C. Thay thế và tái phân bố Nếu bệnh nhân có những mất mát bất thường liên tục hoặc một vấn đề tái phân bố phức tạp, liệu pháp truyền dịch được điều chỉnh cho tất cả các nguồn mất dịch và điện giải khác (ví dụ, nước muối sinh lý có thể được chỉ định ở những bệnh nhân nhiễm kiềm chuyển hóa do mất dịch dạ dày-ruột) | |
| D. Dịch truyền leo Tất cả các nguồn dịch truyền được sử dụng cần phải chi tiết: dịch truyền, dung dịch keo, các sản phẩm máu, các sản phẩm dinh dưỡng qua đường ruột và đường tiêu hóa, và lượng uống (nước, trà, súp, v.v.) Dữ liệu chính xác về các chất điện giải đậm đặc được thêm vào các dịch truyền này hoặc được sử dụng riêng biệt cần được thu thập Dịch truyền leo được định nghĩa là tổng thể tích của các chất điện giải này, thể tích nhỏ để giữ cho các đường tĩnh mạch mở (nước muối hoặc glucose 5%) và tổng thể tích được sử dụng làm phương tiện cho thuốc. | |
| 3. Y lệnh | Thông tin sau được bao gồm trong đơn thuốc truyền dịch qua đường tĩnh mạch: • Loại dịch truyền • Tốc độ truyền dịch • Thể tích hoặc liều lượng dịch truyền Đơn thuốc truyền dịch IV được điều chỉnh cho phù hợp với các rối loạn điện giải hiện tại và các nguồn cung cấp dịch truyền khác |
| 4. Quản lý | Bệnh nhân có kế hoạch quản lý dịch truyền qua đường tĩnh mạch, bao gồm đơn thuốc dịch truyền và chất điện giải trong 24 giờ tới Việc kê đơn dịch truyền tĩnh mạch duy trì chỉ thay đổi sau khi khám lâm sàng, thay đổi chế độ ăn uống hoặc đánh giá kết quả xét nghiệm |
Kết luận
Kê đơn điều trị bằng dịch truyền là một trong những hành vi y tế phổ biến nhất ở bệnh nhân nhập viện nhưng nhiều khía cạnh của việc thực hiện này phức tạp một cách đáng ngạc nhiên. Đã đến lúc giới thiệu quyền quản lý dịch truyền trong ICU của bạn. Để tránh tác hại do dịch
truyền gây ra, chúng tôi khuyên bạn nên đánh giá cẩn thận dung dịch đã chọn và cách tiếp cận theo từng giai đoạn để sử dụng nó, có tính đến diễn biến lâm sàng của bệnh hoặc quy trình phẫu thuật. Dịch truyền nên được kê đơn cẩn thận như bất kỳ loại thuốc nào khác và cần cố gắng hết sức để tránh sử dụng chúng không cần thiết.
References
- Van Regenmortel N, Jorens PG, Malbrain Fluid management before, during and after elective surgery. Curr Opin Crit Care. 2014;20(4):390–5.
- Perner A, Haase N, Guttormsen AB, Tenhunen J, Klemenzson G, Aneman A, et al. Hydroxyethyl starch 130/0.42 versus Ringer’s acetate in severe N Engl J Med. 2012;367(2):124–34.
- Langer T, Santini A, Scotti E, Van Regenmortel N, Malbrain ML, Caironi P. Intravenous balanced solutions: from physiology to clinical Anaesthesiol Intensive Ther. 2015;47(Spec No):s78– 88.
- Malbrain ML, Van Regenmortel N, Owczuk R. It is time to consider the four D’s of fluid management. Anaesthesiol Intensive 2015;47(Spec No):s1–5.
- Yunos NM, Bellomo R, Hegarty C, Story D, Ho L, Bailey M. Association between a chloride-liberal vs chloride-restrictive intravenous fluid administration strategy and kidney injury in critically ill JAMA. 2012;308(15):1566–72.
- Myburgh JA, Mythen Resuscitation fluids. N Engl J Med. 2013;369(13):1243–51.
- Padhi S, Bullock I, Li L, Stroud M, National Institute for H, Care Excellence Guideline Development G. Intravenous fluid therapy for adults in hospital: summary of NICE BMJ. 2013;347:7073.
- Langer T, Limuti R, Tommasino C, van Regenmortel N, Duval E, Caironi P, et al. Intravenous fluid therapy for hospitalized and critically ill children: rationale, available drugs and possible side Anaesthesiol Intensive Ther. 2018;50(1):49–58.
- Malbrain M, Van Regenmortel N, Saugel B, De Tavernier B, Van Gaal PJ, Joannes-Boyau O, et al. Principles of fluid management and stewardship in septic shock: it is time to consider the four D’s and the four phases of fluid Ann Intensive Care. 2018;8(1):66.
- Van Regenmortel N, De Weerdt T, Van Craenenbroeck AH, Roelant E, Verbrugghe W, Dams K, et al. Effect of isotonic versus hypotonic maintenance fluid therapy on urine output, fluid balance, and electrolyte homeostasis: a crossover study in fasting adult volunteers. Br J Anaesth. 2017;118(6):892–900.
- Moritz ML, Ayus Maintenance intravenous fluids in acutely ill patients. N Engl J Med. 2015;373(14):1350–60.
- Van Regenmortel N, Verbrugghe W, Roelant E, Van den Wyngaert T, Jorens PG. Maintenance fluid therapy and fluid creep impose more significant fluid, sodium, and chloride burdens than resuscitation fluids in critically ill patients: a retrospective study in a tertiary mixed ICU population. Intensive Care Med. 2018;44(4):409–17.
- Choo WP, Groeneveld AB, Driessen RH, Swart EL. Normal saline to dilute parenteral drugs and to keep catheters open is a major and preventable source of hypernatremia acquired in the intensive care J Crit Care. 2014;29(3):390–4.
- Maitland K, Kiguli S, Opoka RO, Engoru C, Olupot-Olupot P, Akech SO, et Mortality after fluid bolus in African children with severe infection. N Engl J Med. 2011;364(26):2483–95.
- Byrne L, Obonyo NG, Diab SD, Dunster KR, Passmore MR, Boon AC, et al. Unintended consequences: fluid resuscitation worsens shock in an ovine model of endotoxemia. Am J Respir Crit Care Med. 2018;198(8):1043–54.
- Malbrain ML, Marik PE, Witters I, Cordemans C, Kirkpatrick AW, Roberts DJ, et al. Fluid overload, de- resuscitation, and outcomes in critically ill or injured patients: a systematic review with suggestions for clinical Anaesthesiol Intensive Ther. 2014;46(5):361–80.
- Stewart PA. Independent and dependent variables of acid–base control. Respir Physiol. 1978;33(1):9–26.
- Kellum JA, W.G. E. Stewartìs textbook of acid–base Lulucom. 2009.
- Langer T, Scotti E, Carlesso E, Protti A, Zani L, Chierichetti M, et al. Electrolyte shifts across the artificial lung in patients on extracorporeal membrane oxygenation: interdependence between partial pressure of carbon dioxide and strong ion J Crit Care. 2015;30(1):2–6.
- Morgan TJ, Venkatesh B, Hall J. Crystalloid strong ion difference determines metabolic acid–base change during in vitro Crit Care Med. 2002;30(1):157–60.
- Langer T, Ferrari M, Zazzeron L, Gattinoni L, Caironi P. Effects of intravenous solutions on acid–base equilibrium: from crystalloids to colloids and blood components. Anaesthesiol Intensive Ther. 2014;46(5):350–60.
- Langer T, Carlesso E, Protti A, Monti M, Comini B, Zani L, et al. In vivo conditioning of acid–base equilibrium by crystalloid solutions: an experimental study on pigs. Intensive Care Med. 2012;38(4):686–93.
- Carlesso E, Maiocchi G, Tallarini F, Polli F, Valenza F, Cadringher P, et al. The rule regulating pH changes during crystalloid Intensive Care Med. 2011;37(3):461–8.
- Scheingraber S, Rehm M, Sehmisch C, Finsterer U. Rapid saline infusion produces hyperchloremic acidosis in patients undergoing gynecologic Anesthesiology. 1999;90(5):1265–70.
- Drobin D, Hahn Kinetics of isotonic and hypertonic plasma volume expanders. Anesthesiology. 2002;96(6):1371–80.
- Hahn RG. Influences of red blood cell and platelet counts on the distribution and elimination of crystalloid Medicina. 2017;53(4):233–41.
- Aksu U, Bezemer R, Yavuz B, Kandil A, Demirci C, Ince C. Balanced vs unbalanced crystalloid resuscitation in a near-fatal model of hemorrhagic shock and the effects on renal oxygenation, oxidative stress, and Resuscitation. 2012;83(6):767–73.
- Hansen PB, Jensen BL, Skott O. Chloride regulates afferent arteriolar contraction in response to Hypertension (Dallas, Tex: 1979). 1998;32(6):1066–70.
- Wilcox Regulation of renal blood flow by plasma chloride. J Clin Investig. 1983;71(3):726–35.
- Pfortmueller CA, Fleischmann E. Acetate-buffered crystalloid fluids: current knowledge, a systematic J Crit Care. 2016;35:96–104.
- Potura E, Lindner G, Biesenbach P, Funk GC, Reiterer C, Kabon B, et al. An acetate-buffered balanced crystalloid versus 0.9% saline in patients with end-stage renal disease undergoing cadaveric renal transplantation: a prospective randomized controlled Anesth Analg. 2015;120(1):123–9.
- Shaw AD, Bagshaw SM, Goldstein SL, Scherer LA, Duan M, Schermer CR, et al. Major complications, mortality, and resource utilization after open abdominal surgery: 0.9% saline compared to Plasma- Ann Surg. 2012;255(5):821–9.
- Lobo DN, Stanga Z, Aloysius MM, Wicks C, Nunes QM, Ingram KL, et al. Effect of volume loading with 1 liter intravenous infusions of 0.9% saline, 4% succinylated gelatine (Gelofusine) and 6% hydroxyethyl starch (Voluven) on blood volume and endocrine responses: a randomized, three-way crossover study in healthy Crit Care Med. 2010;38(2):464–70.
- Reid F, Lobo DN, Williams RN, Rowlands BJ, Allison SP. (Ab)normal saline and physiological Hartmann’s solution: a randomized double-blind crossover study. Clin Sci (London, England: 1979). 2003;104(1):17–24.
- Lobo DN, Awad S. Should chloride-rich crystalloids remain the mainstay of fluid resuscitation to prevent ‘pre-renal’ acute kidney injury?: Kidney Int. 2014;86(6):1096–105.
- Marik Iatrogenic salt water drowning and the hazards of a high central venous pressure. Ann Intensive Care. 2014;4:21.
- Williams EL, Hildebrand KL, McCormick SA, Bedel MJ. The effect of intravenous lactated Ringer’s solution versus 0.9% sodium chloride solution on serum osmolality in human volunteers. Anesth 1999;88(5):999–1003.
- Wilkes NJ, Woolf R, Mutch M, Mallett SV, Peachey T, Stephens R, et al. The effects of balanced versus saline-based hetastarch and crystalloid solutions on acid–base and electrolyte status and gastric mucosal perfusion in elderly surgical Anesth Analg. 2001;93(4):811–6.
- Young P, Bailey M, Beasley R, Henderson S, Mackle D, McArthur C, et al. Effect of a buffered crystalloid solution vs saline on acute kidney injury among patients in the intensive care unit: The SPLIT randomized clinical trial. 2015;314(16):1701–10.
- Semler MW, Self WH, Wanderer JP, Ehrenfeld JM, Wang L, Byrne DW, et Balanced crystalloids versus saline in critically ill adults. N Engl J Med. 2018;378(9):829–39.
- Self WH, Semler MW, Wanderer JP, Wang L, Byrne DW, Collins SP, et al. Balanced crystalloids versus saline in non-critically ill N Engl J Med. 2018;378(9):819–28.
- Semler MW, Kellum Balanced crystalloid solutions. Am J Respir Crit Care Med. 2019;199(8):952– 60.
- Fanali G, di Masi A, Trezza V, Marino M, Fasano M, Ascenzi P. Human serum albumin: from bench to Mol Aspects Med. 2012;33(3):209–90.
- Caironi P, Gattinoni L. The clinical use of albumin: the point of view of a specialist in intensive care. Blood 2009;7(4):259–67.
- Caironi P, Langer T, Gattinoni L. Albumin in critically ill patients: the ideal colloid? Curr Opin Crit 2015;21(4):302–8.
- Reitsma S, Slaaf DW, Vink H, van Zandvoort MA, oude Egbrink MG. The endothelial glycocalyx: composition, functions, and Pflugers Arch. 2007;454(3):345–59.
- Zeng Y, Zhang XF, Fu BM, Tarbell JM. The role of endothelial surface glycocalyx in mechanosensing and Adv Exp Med Biol. 2018;1097:1–27.
- Weinbaum S, Tarbell JM, Damiano ER. The structure and function of the endothelial glycocalyx layer. Annu Rev Biomed 2007;9:121–67.
- Guerci P, Ergin B, Uz Z, Ince Y, Westphal M, Heger M, et al. Glycocalyx degradation is independent of vascular barrier permeability increase in non-traumatic hemorrhagic shock in rats. Anesth Analg. 2019;129(2):598–607.
- Ince C, Mayeux PR, Nguyen T, Gomez H, Kellum JA, Ospina-Tascon GA, et al. The endothelium in Shock. 2016;45(3):259–70.
- Rubio-Gayosso I, Platts SH, Duling BR. Reactive oxygen species mediate modification of glycocalyx during ischemia–reperfusion Am J Physiol Heart Circ Physiol. 2006;290(6):H2247–56.
- Hasselgren E, Zdolsek M, Zdolsek JH, Bjorne H, Krizhanovskii C, Ntika S, et al. Long intravascular persistence of 20% albumin in postoperative Anesth Analg. 2019;129(5):1232–9.
- Nemme J, Hahn RG, Krizhanovskii C, Ntika S, Sabelnikovs O, Vanags I. Minimal shedding of the glycocalyx layer during abdominal BMC Anesthesiol. 2017;17(1):107.
- Hippensteel JA, Uchimido R, Tyler PD, Burke RC, Han X, Zhang F, et al. Intravenous fluid resuscitation is associated with septic endothelial glycocalyx degradation. Crit Care. 2019;23(1):259.
- Caironi P, Tognoni G, Masson S, Fumagalli R, Pesenti A, Romero M, et al. Albumin replacement in patients with severe sepsis or septic shock. N Engl J Med. 2014;370(15):1412–21.
- Zazzeron L, Gattinoni L, Caironi P. Role of albumin, starches and gelatins versus crystalloids in volume resuscitation of critically ill Curr Opin Crit Care. 2016;22(5):428–36.
- Investigators SS, Finfer S, McEvoy S, Bellomo R, McArthur C, Myburgh J, et al. Impact of albumin compared to saline on organ function and mortality of patients with severe sepsis. Intensive Care 2011;37(1):86–96.
- Lewis SR, Pritchard MW, Evans DJ, Butler AR, Alderson P, Smith AF, et Colloids versus crystalloids for fluid resuscitation in critically ill people. Cochrane Database Syst Rev. 2018;8:CD000567.
- Frenette AJ, Bouchard J, Bernier P, Charbonneau A, Nguyen LT, Rioux JP, et al. Albumin administration is associated with acute kidney injury in cardiac surgery: a propensity score Crit Care. 2014;18(6):602.
- Guidet B, Ghout I, Ropers J, Aegerter P. Economic model of albumin infusion in septic shock: The EMAISS study. Acta Anaesthesiol Scand. 2020. https://onlinelibrary.wiley.com/doi/epdf/10.1111/aas.13559
- Brandstrup B, Tonnesen H, Beier-Holgersen R, Hjortso E, Ording H, Lindorff-Larsen K, et al. Effects of intravenous fluid restriction on postoperative complications: comparison of two perioperative fluid regimens: a randomized assessor-blinded multicenter Ann Surg. 2003;238(5):641–8.
- Hahn RG. Arterial pressure and the rate of elimination of crystalloid fluid. Anesth Analg. 2017;124(6):1824–33.
- Li Y, Yi S, Zhu Y, Hahn RG. Volume kinetics of Ringer’s lactate solution in acute inflammatory disease. Br J Anaesth. 2018;121(3):574–80.
- Chowdhury AH, Lobo DN. Fluids and gastrointestinal function. Curr Opin Clin Nutr Metab Care. 2011;14(5):469–76.
- Coe AJ, Revanas B. Is crystalloid preloading useful in spinal anaesthesia in the elderly? Anaesthesia. 1990;45(3):241–3.
- Jackson R, Reid JA, Thorburn J. Volume preloading is not essential to prevent spinal-induced hypotension at caesarean Br J Anaesth. 1995;75(3):262–5.
- Lilot M, Ehrenfeld JM, Lee C, Harrington B, Cannesson M, Rinehart J. Variability in practice and factors predictive of total crystalloid administration during abdominal surgery: retrospective two- centre Br J Anaesth. 2015;114(5):767–76.
- Chappell D, Jacob M, Hofmann-Kiefer K, Conzen P, Rehm M. A rational approach to perioperative fluid Anesthesiology. 2008;109(4):723–40.
- Hopf HW, Morrissey Perioperative fluid management: turning art to science. Anesthesiology. 2019;130(5):677–9.
- Minto G, Mythen MG. Perioperative fluid management: science, art or random chaos? Br J Anaesth. 2015;114(5):717–21.
- Myles PS, McIlroy DR, Bellomo R, Wallace S. Importance of intraoperative oliguria during major abdominal surgery: findings of the Restrictive versus Liberal Fluid Therapy in Major Abdominal Surgery Br J Anaesth. 2019;122(6):726–33.
- Thacker JK, Mountford WK, Ernst FR, Krukas MR, Mythen MM. Perioperative fluid utilization variability and association with outcomes: considerations for enhanced recovery efforts in sample US surgical populations. Ann 2016;263(3):502–10.
- Gustafsson UO, Scott MJ, Hubner M, Nygren J, Demartines N, Francis N, et al. Guidelines for perioperative care in elective colorectal surgery: enhanced recovery after surgery (ERAS((R))) society recommendations: World J Surg. 2019;43(3):659–95.
- Pearse RM, Harrison DA, MacDonald N, Gillies MA, Blunt M, Ackland G, et Effect of a perioperative, cardiac output-guided hemodynamic therapy algorithm on outcomes following major gastrointestinal surgery: a randomized clinical trial and systematic review. JAMA. 2014;311(21):2181–90.
- Rochwerg B, Alhazzani W, Sindi A, Heels-Ansdell D, Thabane L, Fox-Robichaud A, et al. Fluid resuscitation in sepsis: a systematic review and network meta-analysis. Ann Intern Med. 2014;161(5):347–55.
- Trof RJ, Sukul SP, Twisk JW, Girbes AR, Groeneveld Greater cardiac response of colloid than saline fluid loading in septic and non-septic critically ill patients with clinical hypovolaemia. Intensive Care Med. 2010;36(4):697–701.
- Annane D, Siami S, Jaber S, Martin C, Elatrous S, Declere AD, et al. Effects of fluid resuscitation with colloids vs crystalloids on mortality in critically ill patients presenting with hypovolemic shock: the CRISTAL randomized JAMA. 2013;310(17):1809–17.
- Raiman M, Mitchell CG, Biccard BM, Rodseth RN. Comparison of hydroxyethyl starch colloids with crystalloids for surgical patients: a systematic review and meta-analysis. Eur J Anaesthesiol. 2016;33(1):42–8.
- Annane D, Fuchs-Buder T, Zoellner C, Kaukonen M, Scheeren EMA recommendation to suspend HES is hazardous. Lancet. 2018;391(10122):736–8.
- Doshi Data too important to share: do those who control the data control the message? BMJ. 2016;352:i1027.
- Priebe HJ, Malbrain ML, Elbers P. The great fluid debate: methodology, physiology and appendicitis. Anaesthesiol Intensive 2015;47(5):437–40.
- Futier E, Garot M, Godet T, Biais M, Verzilli D, Ouattara A, et al. Effect of hydroxyethyl starch vs saline for volume replacement therapy on death or postoperative complications among high-risk patients undergoing major abdominal surgery: The FLASH randomized clinical trial. JAMA. 2020;323(3):225–36.
- McNab S, Duke T, South M, Babl FE, Lee KJ, Arnup SJ, et al. 140 mmol/L of sodium versus 77 mmol/L of sodium in maintenance intravenous fluid therapy for children in hospital (PIMS): a randomised controlled double-blind Lancet. 2015;385(9974):1190–7.
- Scales NICE CG 174: intravenous fluid therapy in adults in hospital. Br J Nurs. 2014;23(8):S6–8.
- Van Regenmortel N, Hendrickx S, Roelant E, Baar I, Dams K, Van Vlimmeren K, et 154 compared to 54 mmol per liter of sodium in intravenous maintenance fluid therapy for adult patients undergoing major thoracic surgery (TOPMAST): a single-center randomized controlled double-blind trial. Intensive Care Med. 2019;45(10):1422–32.
- Magder Volume and its relationship to cardiac output and venous return. Crit Care. 2016;20:271.
- Miller TE, Roche AM, Mythen Fluid management and goal-directed therapy as an adjunct to Enhanced Recovery After Surgery (ERAS). Can J Anaesth. 2015;62(2):158–68.
- Guyton AC, Lindsey AW. Effect of elevated left atrial pressure and decreased plasma protein concentration on the development of pulmonary Circ Res. 1959;7(4):649–57.
- Kolsen-Petersen JA. The endothelial glycocalyx: the great luminal barrier. Acta Anaesthesiol Scand. 2015;59(2):137–9.
- Hahn R, Stalberg H, Carlstrom K, Hjelmqvist H, Ullman J, Rundgren M. Plasma atrial natriuretic peptide concentration and renin activity during overhydration with 1.5% glycine solution in conscious Prostate. 1994;24(2):55–61.
- Kamp-Jensen M, Olesen KL, Bach V, Schutten HJ, Engquist A. Changes in serum electrolyte and atrial natriuretic peptide concentrations, acid–base and haemodynamic status after rapid infusion of isotonic saline and Ringer lactate solution in healthy Br J Anaesth. 1990;64(5):606–10.
- Norberg A, Hahn RG, Li H, Olsson J, Prough DS, Borsheim E, et al. Population volume kinetics predicts retention of 0.9% saline infused in awake and isoflurane-anesthetized volunteers. 2007;107(1):24–32.
- Acheampong A, Vincent JL. A positive fluid balance is an independent prognostic factor in patients with Crit Care. 2015;19:251.
- de Oliveira FS, Freitas FG, Ferreira EM, de Castro I, Bafi AT, de Azevedo LC, et al. Positive fluid balance as a prognostic factor for mortality and acute kidney injury in severe sepsis and septic J Crit Care. 2015;30(1):97–101.
- Silva JM Jr, de Oliveira AM, Nogueira FA, Vianna PM, Pereira Filho MC, Dias LF, et al. The effect of excess fluid balance on the mortality rate of surgical patients: a multicenter prospective Crit Care. 2013;17(6):R288.
- Marik PE, Linde-Zwirble WT, Bittner EA, Sahatjian J, Hansell D. Fluid administration in severe sepsis and septic shock, patterns and outcomes: an analysis of a large national database. Intensive Care 2017;43(5):625–32.
- Cordemans C, De Laet I, Van Regenmortel N, Schoonheydt K, Dits H, Martin G, et al. Aiming for a negative fluid balance in patients with acute lung injury and increased intra-abdominal pressure: a pilot study looking at the effects of PAL-treatment. Ann Intensive 2012;2(Suppl 1):S15.
- Cordemans C, De Laet I, Van Regenmortel N, Schoonheydt K, Dits H, Huber W, et al. Fluid management in critically ill patients: the role of extravascular lung water, abdominal hypertension, capillary leak, and fluid balance. Ann Intensive Care. 2012;2(Suppl 1 Diagnosis and management of intra-abdominal hypertension):S1.
- Dabrowski W, Kotlinska-Hasiec E, Schneditz D, Zaluska W, Rzecki Z, De Keulenaer B, et al. Continuous veno-venous hemofiltration to adjust fluid volume excess in septic shock patients reduces intra-abdominal pressure. Clin 2014;82(1):41–50.
- Mikkelsen ME, Christie JD, Lanken PN, Biester RC, Thompson BT, Bellamy SL, et al. The adult respiratory distress syndrome cognitive outcomes study: long-term neuropsychological function in survivors of acute lung Am J Respir Crit Care Med. 2012;185(12):1307–15.
- Hoste EA, Maitland K, Brudney CS, Mehta R, Vincent JL, Yates D, et Four phases of intravenous fluid therapy: a conceptual model. Br J Anaesth. 2014;113(5):740–7.
- Silversides JA, Perner A, Malbrain Liberal versus restrictive fluid therapy in critically ill patients. Intensive Care Med. 2019;45(10):1440–2.
- Cecconi M, Hofer C, Teboul JL, Pettila V, Wilkman E, Molnar Z, et al. Fluid challenges in intensive care: the FENICE study: a global inception cohort Intensive Care Med. 2015;41(9):1529–37.
- Vincent JL, Weil Fluid challenge revisited. Crit Care Med. 2006;34(5):1333–7.
- Vincent Let’s give some fluid and see what happens” versus the “mini-fluid challenge. Anesthesiology. 2011;115(3):455–6.
- Bennett VA, Vidouris A, Cecconi Effects of fluids on the macro- and microcirculations. Crit Care. 2018;22(1):74.
- Myburgh JA, Finfer S, Bellomo R, Billot L, Cass A, Gattas D, et al. Hydroxyethyl starch or saline for fluid resuscitation in intensive N Engl J Med. 2012;367(20):1901–11.
- Uz Z, Ince C, Guerci P, Ince Y, Araujo RP, Ergin B, et al. Recruitment of sublingual microcirculation using handheld incident dark field imaging as a routine measurement tool during the postoperative de-escalation phase-a pilot study in post ICU cardiac surgery Perioperat Med. 2018;7:18.
- Paxian M, Bauer I, Rensing H, Jaeschke H, Mautes AE, Kolb SA, et al. Recovery of hepatocellular ATP and “pericentral apoptosis” after hemorrhage and FASEB J. 2003;17(9):993–1002.
- Brohi K, Cohen MJ, Ganter MT, Schultz MJ, Levi M, Mackersie RC, et al. Acute coagulopathy of trauma: hypoperfusion induces systemic anticoagulation and hyperfibrinolysis. J Trauma. 2008;64(5):1211– 7 (discussion 7).
- Schochl H, Maegele M, Solomon C, Gorlinger K, Voelckel W. Early and individualized goal-directed therapy for trauma-induced Scand J Trauma Resuscitat Emerg Med. 2012;20:15.
- Shakur H, Roberts I, Bautista R, Caballero J, Coats T, Dewan Y, et al. Effects of tranexamic acid on death, vascular occlusive events, and blood transfusion in trauma patients with significant haemorrhage (CRASH-2): a randomised, placebo-controlled Lancet. 2010;376(9734):23–32.
- Valle EJ, Allen CJ, Van Haren RM, Jouria JM, Li H, Livingstone AS, et al. Do all trauma patients benefit from tranexamic acid? J Trauma Acute Care 2014;76(6):1373–8.
- Peeters Y, Vandervelden S, Wise R, Malbrain ML. An overview on fluid resuscitation and resuscitation endpoints in burns: past, present and future. Part 1—historical background, resuscitation fluid and adjunctive Anaesthesiol Intensive Ther. 2015;47(Spec No):s6–14.
- Baxter CR, Shires T. Physiological response to crystalloid resuscitation of severe burns. Ann N Y Acad 1968;150(3):874–94.
- Cartotto R, Zhou A. Fluid creep: the pendulum hasn’t swung back yet! J Burn Care Res. 2010;31(4):551–8.
- Strang SG, Van Lieshout EM, Breederveld RS, Van Waes OJ. A systematic review on intra-abdominal pressure in severely burned Burns. 2014;40(1):9–16.
- Kirkpatrick AW, Roberts DJ, De Waele J, Jaeschke R, Malbrain ML, De Keulenaer B, et al. Intra- abdominal hypertension and the abdominal compartment syndrome: updated consensus definitions and clinical practice guidelines from the World Society of the Abdominal Compartment Syndrome. Intensive Care Med. 2013;39(7):1190–206.
- Pruitt BA Protection from excessive resuscitation: “pushing the pendulum back”. J Trauma. 2000;49(3):567–8.
- Sullivan SR, Ahmadi AJ, Singh CN, Sires BS, Engrav LH, Gibran NS, et al. Elevated orbital pressure: another untoward effect of massive resuscitation after burn J Trauma. 2006;60(1):72–6.
- Gille J, Klezcewski B, Malcharek M, Raff T, Mogk M, Sablotzki A, et al. Safety of resuscitation with Ringer’s acetate solution in severe burn (VolTRAB)—an observational Burns. 2014;40(5):871– 80.
- Baxter CR. Fluid volume and electrolyte changes of the early postburn period. Clin Plast Surg. 1974;1(4):693–703.
- Guidet B, Martinet O, Boulain T, Philippart F, Poussel JF, Maizel J, et al. Assessment of hemodynamic efficacy and safety of 6% hydroxyethyl starch 130/0.4 vs. 0.9% NaCl fluid replacement in patients with severe sepsis: the CRYSTMAS study. Crit Care. 2012;16(3):R94.
- Cochran A, Morris SE, Edelman LS, Saffle JR. Burn patient characteristics and outcomes following resuscitation with albumin. 2007;33(1):25–30.
- Lawrence A, Faraklas I, Watkins H, Allen A, Cochran A, Morris S, et al. Colloid administration normalizes resuscitation ratio and ameliorates “fluid creep”. J Burn Care 2010;31(1):40–7.
- Malbrain ML, Rice T, Mythen M, Wuyts It is time for improved fluid stewardship. ICU Manag Pract. 2018;18(3):158–62.
Từ khóa » Thử Nghiệm Lâm Sàng Bl Dưa Leo Truyện
-
Thử Nghiệm Lâm Sàng Full 4 Chap - Maikalenna - Fuhu
-
Thử Nghiệm Lâm Sàng Chap 1 - Maikalenna - Fuhu
-
DuaLeoTruyen: Đọc Truyện Tranh Online Miễn Phí Nhanh Nhất
-
Thí Nghiệm: 7 Ngày Dục Vọng - DuaLeoTruyen
-
Thử Nghiệm Sextoy Cho Sếp Máu S Là Công Việc Của Tôi - Vcomycs
-
BL Lovers | #manhwa | Facebook
-
40 Truyện đam Mỹ Ngọt Sủng đã Hoàn Cho Các Hủ - POPS
-
Đọc Truyện Tranh Thể Loại Yaoi - CManga
-
Đọc Truyện [BL] Chân Trần Trên Cỏ [Isaac X Sơn Tùng] - TruyenFun
-
15 Truyện đam Mỹ Tu Chân Huyền Huyễn Hay Dành Cho Fan Tiên Hiệp
-
List đam Mỹ Không Nên Bỏ Qua | Summerbreeze
-
Hướng Dẫn Chăm Sóc Bệnh Nhân Không đặt NKQ Bị Bệnh Hô Hấp ...
-
Bệnh Trĩ (Hạ Trĩ) - Health Việt Nam