Lớp Và Phân Lớp Electron, Hướng Dẫn Tìm Số Electron Tối đa - W3CHEM
Có thể bạn quan tâm
Tiêu chuẩn để electron di chuyển trong AO của mình chính là năng lượng nó mang trong người! Và cách nói lớp, phân lớp cũng chỉ là tượng trưng cho mức năng lượng của electron.
Nếu khó hiểu, hãy đọc lại ví dụ đã học sau: Tôi (electron) ở vila kế biển (AO) ⇔ tôi thuộc phân lớp siêu giàu ⇔ tôi ở lớp thượng lưu ⇔ tôi rất nhiều tiền (nhiều năng lượng).
Nội dung bài viết
- 1. Lớp và phân lớp electron (hoặc AO) đều ám chỉ mức năng lượng của electron
- 1.1. Lớp và phân lớp electron
- 1.2. Số electron tối đa trong phân lớp s, p, d, f
- 1.3. Số electron tối đa của lớp 1 đến lớp 7 (K, L, M, N, O, P, Q)
- 1.3.1. Bé tập đọc
- 1.3.2. Công thức chỉ đúng từ lớp 1 – lớp 4
- 1.3.3. Bé viết theo các mũi tên chéo
- 2. Qui tắc đường chéo của ông Klech-kow-ski
- 3. Liên kết nhanh
- Viết bởi Đỗ Trọng Toan từ W3chem.com
- Mình cảm ơn bạn rất nhiều ⤵
1. Lớp và phân lớp electron (hoặc AO) đều ám chỉ mức năng lượng của electron
1.1. Lớp và phân lớp electron
Lớp: chứa các electron có mức năng lượng GẦN bằng nhau. Có 7 lớp – đánh số từ 1 đến 7 hoặc kí hiệu tương ứng là K, L, M, N, O, P, Q.
Phân lớp trong 1 lớp: chứa các electron có mức năng lượng BẰNG nhau. Có 4 loại phân lớp – kí hiệu là s, p, d, f.
1.2. Số electron tối đa trong phân lớp s, p, d, f
| Phân lớp | s | p | d | f |
| Số AO | 1 | 3 | 5 | 7 |
| Số electron max | 2 | 6 | 10 | 14 |
| Kí hiệu | s2 | p6 | d10 | f14 |
1.3. Số electron tối đa của lớp 1 đến lớp 7 (K, L, M, N, O, P, Q)

1.3.1. Bé tập đọc
Bạn hãy đọc dọc từ trên xuống dưới như dưới đây:
- Lớp thứ 1 (kí hiệu K), có 1 phân lớp (kí hiệu 1s), có 1 Orbital, chứa tối đa 2 electron.
- Lớp thứ 2 (kí hiệu L), có 2 phân lớp (kí hiệu 2s-2p), có 4 Orbital, chứa tối đa 8 electron.
- Lớp thứ 3 (kí hiệu M), có 3 phân lớp (kí hiệu 3s-3p-3d), có 9 Orbital, chứa tối đa 18 electron.
- Lớp thứ 4 (kí hiệu N), có 4 phân lớp (kí hiệu 4s-4p-4d-4f), có 16 Orbital, chứa tối đa 32 electron.
Từ lớp 5, 6, 7 hao hao giống nhau, bạn hãy đọc tiếp:
- Lớp thứ 5 (kí hiệu O), có 4 phân lớp (kí hiệu 5s-5p-5d-5f), có 16 Orbital, chứa tối đa 32 electron.
- Lớp thứ 6(kí hiệu P), có 4 phân lớp (kí hiệu 6s-6p-6d-6f), có 16 Orbital, chứa tối đa 32 electron.
- Lớp thứ 7 (kí hiệu Q), có 4 phân lớp (kí hiệu 7s-7p-7d-7f), có 16 Orbital, chứa tối đa 32 electron.
1.3.2. Công thức chỉ đúng từ lớp 1 – lớp 4
Lớp thứ n (n = 1, 2, 3, 4) có
- n phân lớp electron.
- n2 Orbital
- tối đa 2n2 electron
1.3.3. Bé viết theo các mũi tên chéo
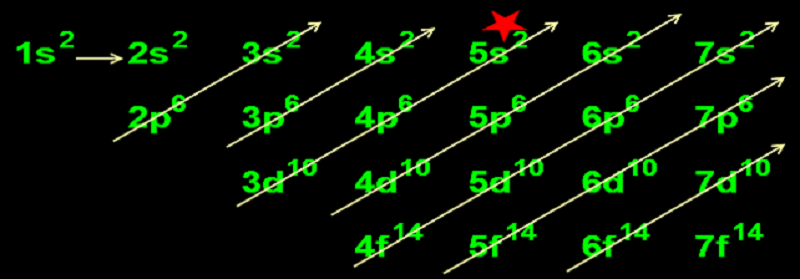
Để xài cho phần dưới, bé đọc theo từng mũi tên một và lần lượt viết ra cho đúng thứ tự; ta có dãy sau:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 (chỗ đánh dấu ngôi sao*) 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6 6f14 7d10 7f14.
Nhớ số mũ là số electron tối đa ở phân lớp đó. Vậy theo dãy này, ta lấy các số mũ cộng lại thì tổng số electron tối đa là 156 (hoặc lấy số electron max của 7 lớp cộng lại – bạn xem lại hình trên).
2. Qui tắc đường chéo của ông Klech-kow-ski
Bạn nhìn vào những đường chéo, đọc từng mũi tên một và lần lượt viết ra (xem 1.3.3); kết quả thu được là dãy MỨC NĂNG LƯỢNG TĂNG DẦN CỦA CÁC AO như sau:

Hiểu như sau:
- Năng lượng của phân lớp 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < …* (dãy còn dài …đến 7f là kết thúc; tuy nhiên tuổi teen chỉ cần học thuộc đế chỗ đánh dấu NGÔI SAO là quá đủ).
- Số mũ là số electron tối đa của phân lớp đó.
Nhớ số ghi trước không phải là toán nhân; đơn giản chỉ là kí hiệu lớp thứ mấy. Ví dụ
- Ghi 2p ⇔ 1 phân lớp 2p, đọc là phân lớp p ở lớp thứ 2.
- Ghi 3s ⇔ 1 phân lớp 3s, đọc là phân lớp s ở lớp thứ 3.
Số mũ chỉ số electron tối đa của phân lớp đó. Ví dụ
- Ghi 2p6 ⇔ có tối đa 6 electron trên phân lớp 2p.
- Tùy nguyên tử, có thể là 2p4 ⇔ có 4 electron trên phân lớp 2p.
- Nhưng sai nếu bạn ghi 2p7 (hoặc số lớn hơn) ; bởi vì ………
Bạn phải học thuộc lòng dãy này để xác định loại nguyên tố và viết cấu hình electron sau này; đây là nội dung quan trọng và dùng suốt đời học sinh 3 năm lớp 10, 11, 12.
3. Liên kết nhanh
Đọc thêm bài viết về Nguyên tử và Hóa lớp 10 tại đây.
Nếu có câu hỏi hoặc ý tưởng mới, hãy lưu lại trong phần bình luận bạn nhé. Câu hỏi và ý tưởng của bạn luôn tuyệt vời.🧸 🐧 🦥Viết bởi Đỗ Trọng Toan từ W3chem.com
Mình là người tự mình thực hiện toàn bộ dự án này – bao gồm xây dựng trang web, viết nội dung, tìm tài liệu tham khảo, trả lời câu hỏi bạn gởi về. Vui lòng xem xét QUYÊN GÓP để hỗ trợ W3chem CHỈ BẰNG CÁCH CHIA SẺ BÀI VIẾT NÀY LÊN MẠNG XÃ HỘI; bởi vì trong tương lai, bạn sẽ cho mình nhiều thời gian để làm việc trên W3chem, cũng có nghĩa bạn nhận thêm nhiều nội dung mới nhanh hơn tại đây.😍 🥰 😘
Mình cảm ơn bạn rất nhiều ⤵
- Share on Facebook
- Share on Twitter
- Share on Pinterest
- Share on LinkedIn
Post navigation
Previous: Hướng dẫn thêm về orbital nguyên tử (AO)Next: Hướng dẫn tìm loại nguyên tố (s, p, d, f); viết cấu hình electronTừ khóa » Số Electron Tối đa Của Mỗi Lớp
-
Electron Phân Bố đều Trong Không Gian Nguyên Tử Mang điện Tích ...
-
Số Electron Tối đa Trên Mỗi Lớp Là Bao Nhiêu? - Trang Lan - Hoc247
-
I. Sự Chuyển động Của Các Electron Trong Nguyên Tử - SureTEST
-
Số E Tối Đa Trong Mỗi Lớp
-
Số Electron Tối đa Của Một Lớp (n Là Số Thứ Tự Lớp) Là
-
Nêu Số Electron Tối đa Trong Một Phân Lớp S; P; D - TopLoigiai
-
Số E Tối đa Trong Lớp N
-
Bài 4 Trang 34 SGK Hóa 10 Nâng Cao: Hãy Cho Biết Số Electron Tối đa
-
Lý Thuyết Và Bài Tập Cấu Tạo Vỏ Nguyên Tử - Lớp Và Phân Lớp Electron
-
Số Electron Tối đa Trong Một Phân Lớp - Tài Liệu Text - 123doc
-
Số Electron Tối đa ở Lớp Thứ L Là
-
Số Electron Tối đa Trong Lớp P Là - Xây Nhà
-
Cấu Tạo Vỏ Nguyên Tử, Trắc Nghiệm Hóa Học Lớp 10 - Baitap123
-
Cấu Tạo Vỏ Electron Của Nguyên Tử - Thầy Dũng Hóa