Lưu Huỳnh Phân Tử – Wikipedia Tiếng Việt
Có thể bạn quan tâm
Nội dung
chuyển sang thanh bên ẩn- Đầu
- Bài viết
- Thảo luận
- Đọc
- Sửa đổi
- Sửa mã nguồn
- Xem lịch sử
- Đọc
- Sửa đổi
- Sửa mã nguồn
- Xem lịch sử
- Các liên kết đến đây
- Thay đổi liên quan
- Liên kết thường trực
- Thông tin trang
- Trích dẫn trang này
- Tạo URL rút gọn
- Tải mã QR
- Tạo một quyển sách
- Tải dưới dạng PDF
- Bản để in ra
- Wikimedia Commons
- Khoản mục Wikidata
| Bài viết này là một bản dịch thô từ ngôn ngữ khác. Đây có thể là kết quả của máy tính hoặc của người chưa thông thạo dịch thuật. Xin hãy giúp cải thiện bài viết hoặc viết lại để hành văn tiếng Việt được tự nhiên hơn và đúng ngữ pháp. Chú ý: Những bản dịch rõ ràng là dịch máy hoặc có chất lượng kém, KHÔNG dùng bản mẫu này, vui lòng đặt {{subst:clk|dịch máy chất lượng kém}} hoặc {{subst:cld5}} để xóa bản dịch kém. |
| Lưu huỳnh phân tử | |||
|---|---|---|---|
| |||
 | |||
| Tên hệ thống | Lưu huỳnh[1] Octatiocan[2] | ||
| Nhận dạng | |||
| Số CAS | 10544-50-0 | ||
| PubChem | 66348 | ||
| MeSH | Cyclooctasulfur | ||
| ChEBI | 29385 | ||
| ChEMBL | 1235452 | ||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ
| ||
| Tham chiếu Gmelin | 2973 | ||
| UNII | 70FD1KFU70 | ||
| Thuộc tính | |||
| Bề ngoài | Tinh thể màu vàng. | ||
| Khối lượng riêng | 2.07 g cm−3 | ||
| Điểm nóng chảy | 119 °C; 392 K; 246 °F | ||
| Điểm sôi | 444,6 °C; 717,8 K; 832,4 °F | ||
| log P | 6.117 | ||
| Nhiệt hóa học | |||
| Enthalpyhình thành ΔfHo298 | 0 kJ·mol−1[3] | ||
| Entropy mol tiêu chuẩn So298 | 32 J·mol−1·K−1[3] | ||
| Các hợp chất liên quan | |||
| Hợp chất liên quan | Hexatian | ||
| Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). Tham khảo hộp thông tin | |||
Lưu huỳnh là một chất vô cơ có công thức hóa học là S8. Nó là chất rắn có màu vàng đặc trưng và là dạng phổ biến nhất của nguyên tố lưu huỳnh. Do được tìm thấy rộng rãi ngoài tư nhiên nên đây là hóa chất quan trọng có nhiều ứng dụng trong công nghiệp.[4]
Lưu huỳnh là nguyên tố phong phú thứ 10 tính theo khối lượng trong vũ trụ và nhiều thứ 5 trên Trái đất. Mặc dù đôi khi được tìm thấy ở dạng nguyên chất, tự nhiên, lưu huỳnh trên Trái đất thường xuất hiện dưới dạng khoáng chất sulfide và sunfat. Có nhiều ở dạng bản địa, lưu huỳnh đã được biết đến từ thời cổ đại, được đề cập đến để sử dụng ở Ấn Độ cổ đại, Hy Lạp cổ đại, Trung Quốc và Ai Cập cổ đại. Trong lịch sử và trong văn học, lưu huỳnh còn được gọi là diêm sinh, [5] có nghĩa là "đá cháy". [6] Ngày nay, hầu hết tất cả lưu huỳnh nguyên tố được sản xuất như một sản phẩm phụ của việc loại bỏ các chất gây ô nhiễm chứa lưu huỳnh khỏi khí đốt tự nhiên và dầu mỏ.[7] [8] Việc sử dụng thương mại lớn nhất của nguyên tố này là sản xuất axit sulfuric để làm phân bón sulfate và phosphate, và các quá trình hóa học khác. Lưu huỳnh được sử dụng trong diêm, diệt côn trùng và diệt nấm. Nhiều hợp chất lưu huỳnh có mùi của khí tự nhiên, chồn hôi, bưởi và tỏi là do các hợp chất lưu huỳnh hữu cơ. Hydrogen sulfide tạo ra mùi đặc trưng là trứng thối và các mùi khác.
Cấu tạo phân tử
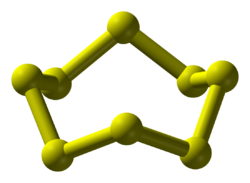
[sửa | sửa mã nguồn]Lưu huỳnh có cấu trúc hình vương miện với nhóm đối xứng D4d. Độ dài liên kết S-S bằng nhau, vào khoảng 2,05 Å. Lưu huỳnh kết tinh ở ba dạng đa hình riêng biệt: trực thoi, và hai dạng đơn tà, trong đó chỉ có hai dạng bền ở điều kiện tiêu chuẩn. Đa hình còn lại chỉ ổn định trong khoảng 96 đến 115 °C ở 100 kPa. Lưu huỳnh được tạo thành một số dạng thù hình: Alpha-lưu huỳnh, Beta-lưu huỳnh, Gamma-lưu huỳnh, Lambda-lưu huỳnh. Lưu huỳnh dễ dàng tạo thành các tinh thể lớn, thường hay có màu vàng.
Phản ứng hoá học
[sửa | sửa mã nguồn]Lưu huỳnh phản ứng với rất nhiều chất như Al, Fe, Cu, O2, Hg, C, Si,... tạo ra các muối sulfide tương ứng. Thí dụ như:
 + 8 + 8 8 8 |
|---|
Tuy nhiên, để đơn giản hơn, người ta lấy công thức của lưu huỳnh thường dùng là S, chứ không S8.
Xem thêm
[sửa | sửa mã nguồn]- Lưu huỳnh
Tham khảo
[sửa | sửa mã nguồn]- ^ International Union of Pure and Applied Chemistry (2005). Danh Pháp Hóa Vô Cơ (IUPAC Hướng dẫn 2005). Cambridge (UK): RSC–IUPAC. ISBN 0-85404-438-8. p. 49. Bản toàn văn.
- ^ "cyclooctasulfur (CHEBI:29385)". Chemical Entities of Biological Interest. UK: European Bioinformatics Institute. Main.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. tr. A23. ISBN 0-618-94690-X.
- ^ Steudel, R., "Homocyclic Sulfur Molecules", Topics Curr. Chem. 1982, 102, 149.
- ^ Greenwood, NN; & Earnshaw, A. (1997). Hóa học của các nguyên tố (xuất bản lần thứ 2), Oxford: Butterworth-Heinemann. ISBN0-7506-3365-4.
- ^ Chisholm, Hugh, ed. (Năm 1911). "Diêm sinh" . Bách khoa toàn thư Britannica . Tập 4 (ấn bản thứ 11). Nhà xuất bản Đại học Cambridge. P. 571.
- ^ Laurence Knight ( ngày 19 tháng 7 năm 2014 )," Thặng dư lưu huỳnh: lên đến cổ của chúng tôi trong một nguyên tố ma quỷ". Đài BBC.
- ^ " Lưu huỳnh ". Cấc yếu tố. Đài BBC. Ngày 11 tháng 10 năm 2014
- Khoáng vật tự sinh
- Chất khoáng dinh dưỡng
- Hóa chất dùng trong nông nghiệp
- Trang sử dụng liên kết tự động ISBN
- Bài dịch có chất lượng kém
Từ khóa » Nguyên Tố Lưu Huỳnh
-
Lưu Huỳnh Và Những điều Có Thể Bạn Chưa ... - Hóa Chất Trung Sơn
-
Lưu Huỳnh: Tính Chất đặc Trưng Và ứng Dụng Phổ Biến - Monkey Math
-
Lưu Huỳnh Là Gì? Một Số Thông Tin Cần Biết Về Lưu Huỳnh
-
Lưu Huỳnh Là Một Nguyên Tố Hay Hợp Chất?
-
Lưu Huỳnh Hóa Trị Mấy? Ứng Dụng Của Phi Kim Này Trong đời Sống
-
Lưu Huỳnh Là Gì? Thông Tin Và Tính Chất Hóa Học Của Lưu ... - VietChem
-
Tính Chất Hóa Học Của Lưu Huỳnh, Cách Điều Chế Và Các Ứng ...
-
Nguyên Tố Lưu Huỳnh (Z=16) A. Viết Cấu Hình Electron Nguyên Tử Của ...
-
VAI TRÒ DINH DƯỠNG CỦA LƯU HUỲNH TRONG CÂY TRỒNG
-
Lưu Huỳnh Và Những điều Có Thể Bạn Chưa Biết Về Phi Kim Này
-
Nguyên Tử Khối Của Nguyên Tố Lưu Huỳnh Là Bao Nhiêu? - Selfomy