Lý Thuyết Hóa 10: Bài 15. Hóa Trị Và Số Oxi Hóa - TopLoigiai
Có thể bạn quan tâm
Tóm tắt Lý thuyết Hóa học 10 Kết nối tri thức Bài 15: Phản ứng oxi hóa - khử theo chương trình Sách mới ngắn gọn nhất. Tổng hợp lý thuyết Hóa học 10 trọn bộ chi tiết, đầy đủ.
Bài 15: Phản ứng oxi hóa - khử
Mục lục nội dung I. Số oxi hóa1. Khái niệm2. Quy tắc xác định số oxi hóaII. Chất oxi hóa, chất khử, phản ứng oxi hóa – khử1. Chất oxi hóa, chất khử2. Phản ứng oxi hóa – khửIII. Lập phương trình hóa học của phản ứng oxi hóa – khửIV. Phản ứng oxi hóa - khử trong thực tiễn1. Sự cháy2. Sự han gỉ kim loại3. Sản xuất hóa chất4. Chuyển hóa các chất trong tự nhiên5. Xác định nồng độ của một chất dựa vào phản ứng oxi hóa – khửI. Số oxi hóa
1. Khái niệm
- Số oxi hóa của một nguyên tử trong phân tử là điện tích của nguyên tử nguyên tố đó nếu giả định cặp electron chung thuộc hẳn về nguyên tử của nguyên tố có độ âm điện lớn hơn
- Số oxi hóa được viết ở dạng số đại số, dấu viết trước, số viết sau.
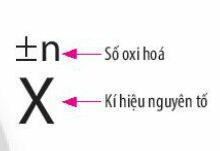
2. Quy tắc xác định số oxi hóa
Thông thường, số oxi hóa của nguyên tử được xác định trực tiếp từ công thức phân tử theo các quy tắc sau:
- Quy tắc 1: Trong đơn chất, số oxi hóa của nguyên tử bằng 0.
- Quy tắc 2: Trong phân tử các hợp chất, thông thường số oxi hóa của hydrogen là +1, của oxygen là – 2, các kim loại điển hình có số oxi hóa dương và có giá trị bằng số electron hóa trị.

- Quy tắc 3: Trong hợp chất, tổng số oxi hóa của các nguyên tử trong phân tử bằng 0.
- Quy tắc 4: Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích ion; trong ion đa nguyên tử, tổng số oxi hóa của các nguyên tử bằng điện tích ion.
II. Chất oxi hóa, chất khử, phản ứng oxi hóa – khử
1. Chất oxi hóa, chất khử
- Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron
(Câu thần chú: Chất khử cho tăng, chất o nhận giảm)
- Quá trình oxi hóa là quá trình chất khử nhường electron, quá trình khử là quá trình chất oxi hóa nhận electron
2. Phản ứng oxi hóa – khử
- Phản ứng oxi hóa – khử là phản ứng hóa học xảy ra đồng thời quá trình quá trình nhường electron và quá trình nhận electron.
- Dấu hiệu để nhận biết phản ứng oxi hóa – khử là có sự thay đổi số oxi hóa của các nguyên tử.
III. Lập phương trình hóa học của phản ứng oxi hóa – khử
- Phương pháp thăng bằng electron đường dùng để lập phương trình hóa học của phản ứng oxi hóa – khử theo nguyên tắc: “Tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận”.
- Các bước lập phương trình hóa học của phản ứng oxi hóa – khử theo phương pháp thăng bằng electron:
+ Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa, chất khử
+ Bước 2: Biểu diễn quá trình oxi hóa, quá trình khử
+ Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc: Tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.
+ Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
IV. Phản ứng oxi hóa - khử trong thực tiễn
1. Sự cháy
- Phản ứng cháy là phản ứng oxi hóa – khử xảy ra ở nhiệt độ cao giữa chất cháy và chất oxi hóa.
- Sự cháy kèm theo sự tỏa nhiệt và phát sáng, tạo ra nhiệt lượng đủ để duy trì sự cháy.
- Ví dụ: phản ứng oxi hóa – khử xảy ra khi đốt cháy carbon trong than đá:
C + O2 →CO2 (to)
2. Sự han gỉ kim loại
- Sau một thời gian sử dụng, nhiều thiết bị, máy móc, vật dụng bằng kim loại thường bị han gỉ do sự oxi hóa bởi oxygen trong không khí.
- Ví dụ: Trong không khí ẩm các vật dụng bằng thép bị oxi hóa tạo gỉ sắt:
4Fe + 3O2 + xH2O → 2Fe2O3.xH2O
3. Sản xuất hóa chất
- Trong công nghiệp, phần lớn các phản ứng hóa học xảy ra trong quy trình sản xuất là phản ứng oxi hóa – khử.
- Ví dụ: Sulfuric acid là hóa chất quan trọng trong công nghiệp, được sản xuất chủ yếu từ sulfur hoặc quặng pyrite.
Sơ đồ phản ứng;
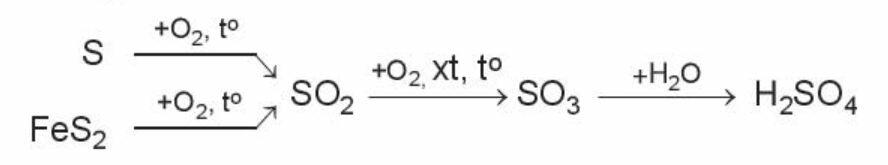
4. Chuyển hóa các chất trong tự nhiên
- Trong tự nhiên cũng xảy ra rất nhiều quá trình kèm theo phản ứng oxi hóa – khử.
- Ví dụ:
Lúa chiêm lấp ló đầu bờ
Hễ nghe tiếng sấm phất cờ mà lên
5. Xác định nồng độ của một chất dựa vào phản ứng oxi hóa – khử
- Trong thực tế, dung dịch thuốc tím (KMnO4) được sử dụng phổ biến như một tác nhân oxi hóa mạnh để xác định hàm lượng các chất khử như iron(II); hydrogen peroxide, oxalic acid, …
- Ví dụ: Trong quá trình bảo quản, một mẫu iron (II) sulfate bị oxi hóa một phần thành hợp chất iron (III). Hàm lượng iron (II) sulfate còn lại trong mẫu được xác định thông qua phản ứng với dung dịch thuốc tím có nồng độ đã biết:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
>>> Xem toàn bộ:
- Lý thuyết Hóa 10 Kết nối tri thức
- Soạn Hóa 10 Kết nối tri thức
- Sơ đồ tư duy Hóa 10 Kết nối tri thức
- Trắc nghiệm Hóa 10 Kết nối tri thức
-------------------------------------------
Trên đây Toploigiai đã cùng các bạn Tóm tắt Lý thuyết Hóa học 10 Kết nối tri thức Bài 15: Phản ứng oxi hóa - khử theo chương trình Sách mới ngắn gọn nhất. Mời các bạn hãy click ngay vào trang chủ Toploigiai để tham khảo và chuẩn bị bài cho năm học mới Lớp 10 nhé. Chúc các bạn học tốt.
Từ khóa » Bài Tập Hóa Trị Và Số Oxi Hóa Lớp 10
-
Bài Tập Hóa Trị Và Số Oxi Hóa
-
Giải Bài Tập Hóa Học 10 - Bài 15: Hóa Trị Và Số Oxi Hóa
-
Bài 15. Hóa Trị Và Số Oxi Hóa
-
Giải Hóa 10 Bài 15: Hóa Trị Và Số Oxi Hóa
-
Bài Tập Hóa Trị Và Số Oxi Hóa - Hoá Học Lớp 10 - Haylamdo
-
Giải Bài Tập Hóa 10 Bài 15: Hóa Trị Và Số Oxi Hóa
-
Hoá Học 10 Bài 15: Hóa Trị Và Số Oxi Hóa - HOC247
-
Hóa Học 10 Bài 15: Hóa Trị Và Số Oxi Hóa Giải Bài Tập Hóa 10 Trang 74
-
Giải Bài 15 Hóa Học 10: Hóa Trị Và Số Oxi Hóa - Tech12h
-
Bài Tập Hóa Trị Và Số Oxi Hóa MÔN HÓA Lớp 10
-
Bài Tập Hóa Trị Và Số Oxi Hóa Hay Nhất - TopLoigiai
-
Giải Bài Tập Hóa 10 Bài 15 Hóa Trị Và Số Oxi Hóa Dễ Hiểu - Soạn Bài ...
-
Bài Tập Hóa Trị Và Số Oxi Hóa - 123doc
-
Bài 1, 2, 3, 4, 5, 6 Trang 90 SGK Hóa Học 10 Nâng Cao: Hóa Trị Và Số ...