Lý Thuyết Hóa 10 Bài 38: Cân Bằng Hóa Học
Có thể bạn quan tâm
Lý thuyết Hóa 10 Bài 38: Cân bằng hóa học
I. Phản ứng một chiều, phản ứng thuận nghịch và cân bằng hóa học
1. Phản ứng một chiều
- Phản ứng một chiều là phản ứng chỉ xảy ra theo một chiều từ trái sang phải (tức các sản phẩm phản ứng không tác dụng được với nhau để tạo ra các chất tham gia phản ứng).
- Ví dụ phản ứng một chiều:
2KClO3 →to,MnO22KCl + 3O2 ↑
Cũng điều kiện đó O2 tạo ra không tác dụng được với KCl để tạo thành KClO3.
2. Phản ứng thuận nghịch
- Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều trái ngược nhau (tức là các chất tham gia phản ứng tác dụng với nhau để tạo thành sản phẩm đồng thời các sản phẩm phản ứng được với nhau để tạo ra các chất tham gia phản ứng).
- Ví dụ phản ứng thuận nghịch:
3H2 + N2⇄to,p,xt 2NH3
NH3 được tạo thành đồng thời lại bị phân hủy sinh ra H2 và N2 là các chất tham gia phản ứng.
3. Cân bằng hóa học
- Cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuận bằng tốc độ của phản ứng nghịch.
- Cân bằng hóa học là cân bằng động, vì ở trạng thái cân bằng, phản ứng không dừng lại mà phản ứng thuận và phản ứng nghịch vẫn diễn ra, nhưng với tốc độ bằng nhau.
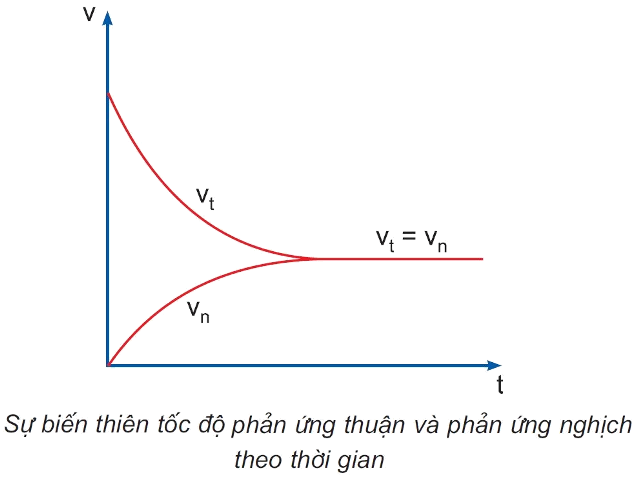
II. Sự chuyển dịch cân bằng hóa học
- Sự chuyển dịch cân bằng hóa học là sự chuyển từ trạng thái cân bằng này sang trạng thái cân bằng khác do tác động của các yếu tố từ bên ngoài lên cân bằng.
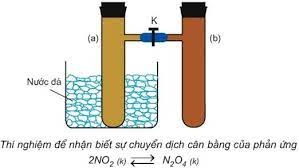
III. Các yếu tố ảnh hưởng đến cân bằng hóa học
1. Ảnh hưởng của nồng độ
- Khi tăng hoặc giảm nồng độ của một chất trong cân bằng thì cân bằng chuyển dịch theo chiểu làm giảm tác dụng của việc tăng hoặc giảm nồng độ của chất đó.
- Lưu ý: Đối với hệ cân bằng có chất rắn thì việc thêm hay bớt lượng chất rắn không ảnh hưởng đến cân bằng, nghĩa là cân bằng không chuyển dịch.
2. Ảnh hưởng của áp suất
- Khi tăng hoặc giảm áp suất chung của hệ cân bằng thì cân bằng chuyển dịch theo chiều làm giảm tác dụng của việc tăng hoặc giảm áp suất đó.
- Lưu ý: Khi hệ cân bằng có số mol khí ở 2 về bằng nhau hoặc trong hệ không có chất khí thì việc tăng, giảm áp suất chung của hệ không làm cho cân bằng chuyển dịch.
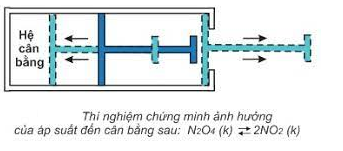
3. Ảnh hưởng của nhiệt độ
- Khi tăng nhiệt độ thì cân bằng chuyền dịch theo chiều phản ứng thu nhiệt, nghĩa là làm giảm tác dụng của việc tăng nhiệt độ.
- Còn khi giảm nhiệt độ thì cân bằng chuyển dịch theo chiều phản ứng tỏa nhiệt, nghĩa là làm giảm tác dụng của việc giảm nhiệt độ.
Kết luận: Nguyên lí chuyển dịch cân bằng (Nguyên lí Lơ Sa-tơ-li-ê): "Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động bên ngoài, như biến đổi nồng độ, áp suất, nhiệt độ sẽ chuyển dịch cân bằng theo chiều làm giảm tác động bên ngoài đó”.
4. Vai trò của chất xúc tác
- Chất xúc tác không ảnh hưởng đến cân bằng vì chất xúc tác làm tăng tốc độ phản ứng thuận và tốc độ phản ứng nghịch với số lần bằng nhau.
V. Ý nghĩa của tốc độ phản ứng và cân bằng hóa học trong sản xuất hóa học
Trong công nghiệp và sản xuất việc vận dụng các yếu tố làm tăng tốc độ phản ứng và chuyển dịch cân bằng giúp phản ứng thực hiện nhanh và đạt hiệu suất cao.
Xem thêm các bài tổng hợp lý thuyết Hóa học lớp 10 đầy đủ, chi tiết khác:
Lý thuyết Bài 32: Hiđro sunfua – lưu huỳnh đioxit – lưu huỳnh trioxit
Lý thuyết Bài 33: Axit sunfuric và muối sunfat
Lý thuyết Bài 34: Luyện tập: Oxi – lưu huỳnh
Lý thuyết Bài 36: Tốc độ phản ứng hóa học
Lý thuyết Bài 39: Luyện tập tốc độ phản ứng và cân bằng hóa học
Từ khóa » Bài Tập Lý Thuyết Cân Bằng Hóa Học
-
Lý Thuyết Cân Bằng Hóa Học Hay, Chi Tiết Nhất
-
Lý Thuyết Và Bài Tập Về Cân Bằng Hóa Học Có đáp án Hóa Học 10.
-
Lý Thuyết Cân Bằng Hóa Học - Thầy Phạm Ngọc Dũng Dạy HÓA
-
Tổng ôn Tập Lý Thuyết Cân Bằng Hóa Học Môn Hóa Lớp 10
-
Bài Tập Lý Thuyết Về Tốc độ Phản ứng Và Cân Bằng Hóa Học - Haylamdo
-
Các Dạng Bài Tập Về Cân Bằng Hóa Học - Hoá Học Lớp 10 - Haylamdo
-
30 Câu Hỏi Lý Thuyết Về Cân Bằng Hóa Học Có Lời Giải (phần 1)
-
Lý Thuyết Cân Bằng Hóa Học | SGK Hóa Lớp 10
-
Cân Bằng Hóa Học Là Gì? Lý Thuyết Cân Bằng Hóa Học Hóa Lớp 10
-
Bài Tập Cân Bằng Phương Trình Hóa Học Lớp 10 Có Lời Giải Chi Tiết
-
Lý Thuyết Hóa 10: Bài 38. Cân Bằng Hóa Học - TopLoigiai
-
Lý Thuyết, Bài Tập Về Tốc độ Phản ứng- Cân Bằng Hóa Học Có đáp án
-
Bài Tập Cân Bằng Hóa Học - Tốc độ Phản ứng (có Lời Giải Chi Tiết)
-
Cân Bằng Hoá Học