Lý Thuyết Hóa 8: Bài 13. Phản ứng Hóa Học - TopLoigiai
Có thể bạn quan tâm
Tóm tắt Lý thuyết KHTN 8 Chân trời sáng tạo Bài 13: Muối theo chương trình Sách mới ngắn gọn nhất. Tổng hợp lý thuyết Khoa học tự nhiên 8 trọn bộ chi tiết, đầy đủ.
Bài 13: Muối
Mục lục nội dung 1. Khái niệm muối2. Tín tan trong muối3. Điều chế muối4. Tính chất hóa học của muối5. Mối quan hệ giữa Acid, Base, Oxide và muối6. Câu hỏi trắc nghiệm1. Khái niệm muối
- Muối là hợp chất được tạo ra khi thay thế ion H+ trong acid bằng ion kim loại hoặc ion ammonium (NH+4).
- Cách gọi muối của kim loại:

Cách gọi tên muối của ammonium (NH+4)
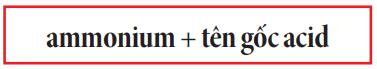
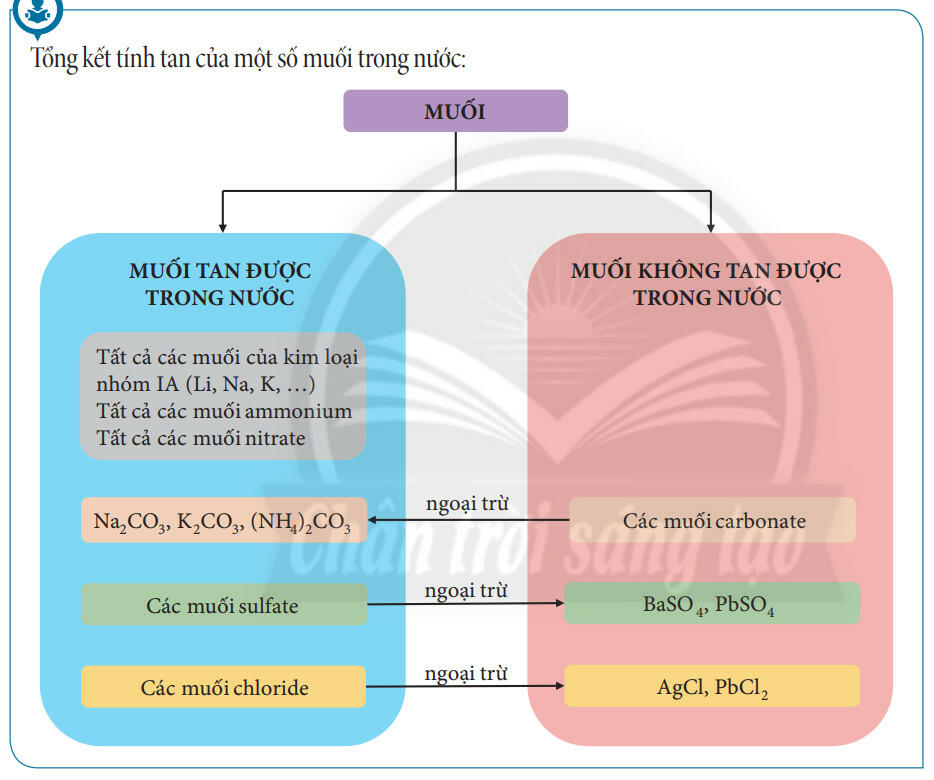
2. Tín tan trong muối
- Tuỳ thuộc vào khả năng tan trong nước của muối, ta có: muối tan, muối không tan hoặc ít tan.
3. Điều chế muối
- Các phương pháp điều chế muối
+ Oxide acid:

+ Oxide base

+ Dung dịch acid và base:
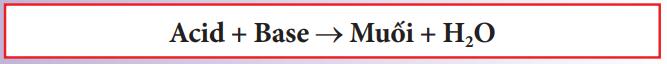
+ Kim loại và acid:

M là một số kim loại như Mg, Al, Zn, Fe,…
4. Tính chất hóa học của muối
- Dung dịch muối phản ứng với kim loại (KL):
=> Muối KL(A) + KL(B) → Muối KL(B) + KL(A)
- Dung dịch muối phản ứng với dung dịch base:
=> Muối + Base → Muối mới + Base mới
- Dung dịch muối phản ứng với dung dịch acid:
=> Muối + Acid → Muối mới + Acid mới
- Dung dịch muối phản ứng với dung dịch muối:
=> Muối(A) + Muối(B) → Muối(C) + Muối(D)
5. Mối quan hệ giữa Acid, Base, Oxide và muối
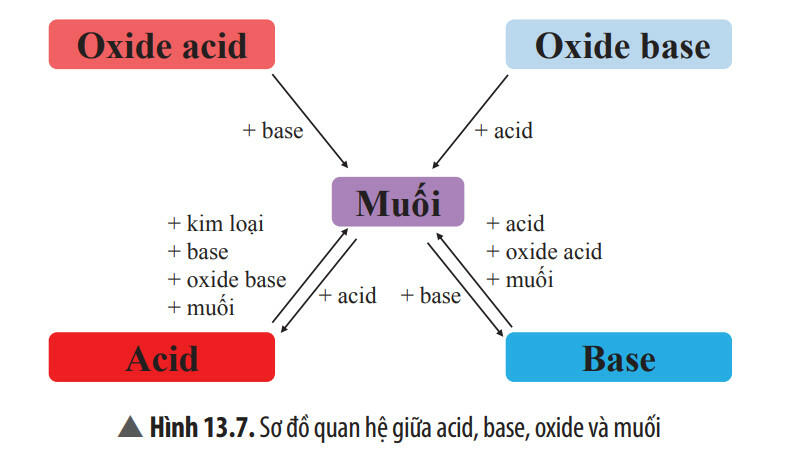
6. Câu hỏi trắc nghiệm
Câu 1: Cho dung dịch KOH vào ống nghiệm đựng dung dịch FeCl3, hiện tượng quan sát được là:
A. Có kết tủa trắng xanh.
B. Có khí thoát ra.
C. Có kết tủa đỏ nâu.
D. Kết tủa màu trắng.
Câu 2: Các Cặp chất nào sau đây không xảy ra phản ứng ?
CaCl2+Na2CO3
CaCO3+NaCl
NaOH+HCl
NaOH+KCl
A. 1 và 2
B. 2 và 3
C. 3 và 4
D. 2 và 4
Câu 3: Kim loại nào sau đây có thể tác dụng với dung dịch muối FeCl2:
A. Cu
B. Zn
C. Pb
D. Hg
Câu 4: Hãy cho biết muối nào có thể điều chế bằng phản ứng của kim loại với dung dịch axit H2SO4 loãng ?
A. ZnSO4
B. Na2SO3
C. CuSO4
D. MgSO3
Câu 5: Muối nào sau đây bị phân hủy ở nhiệt độ cao?
A. KClO3
B. KMnO4
C. CaCO3
D. A, B, C đều đúng
Câu 6: Hợp chất nào sau đây bị nhiệt phân hủy tạo ra hợp chất oxit và một chất khí làm đục nước vôi trong?
A. Muối nitrat
B. Muối sunfat
C. Muối clorua
D. Muối cacbonat không tan
Câu 7: Cho 35 gam CaCO3 vào dung dịch HCl dư, kết thúc phản ứng thu được bao nhiêu lít khí CO2 ở đktc?
A. 7,84 lít
B. 6,72 lít
C. 5,56 lít
D. 4,90 lít
Giải thích:
Số mol của CaCO3 là:
nCaCO3 = 35/100 = 0,35 mol
Phương trình phản ứng:
CaCO3 + 2 HCl → CaCl2 + CO2 + H2O
0.35 0.35 (mol)
Theo phương trình phản ứng ta có:
nCO2= 0,35 mol
Thể tích khí CO2 ở đktc là:
VCO2= 0,35.22,4 = 7,84 lít.
Câu 8: Tính chất hóa học của muối là
A. Tác dụng với kim loại
B. Tác dụng với axit
C. Tác dụng với dung dịch bazơ
D. A, B, C đều đúng
Câu 9: Cho dung dịch NaOH vào ống nghiệm đựng dung dịch FeCl3, ta quan sát được hiện tượng là
A. Có khí thoát ra
B. Xuất hiện kết tủa màu trắng
C. Xuất hiện kết tủa xanh lam
D. Xuất hiện kết tủa màu đỏ nâu
Câu 10: Cho các chất sau: CaO, H2SO4, Fe(OH)2, FeSO4, CaSO4, HCl, LiOH, MnO2, CuCl2, Al(OH)3, SO2. Có bao nhiêu hợp chất là muối?
A. 3
B. 4
C. 5
D. 6
>>> Xem toàn bộ: Lý thuyết Khoa học tự nhiên 8 Chân trời sáng tạo
-----------------------------
Trên đây Toploigiai đã cùng các bạn Tóm tắt Lý thuyết KHTN 8 Chân trời sáng tạo Bài 13: Muối theo chương trình Sách mới ngắn gọn nhất. Mời các bạn hãy click ngay vào trang chủ Toploigiai để tham khảo và chuẩn bị bài cho năm học mới Lớp 11 nhé. Chúc các bạn học tốt.
Từ khóa » Giải Sách Giáo Khoa Hóa 8 Bài 13
-
Giải Hóa 8 Bài 13: Phản ứng Hóa Học
-
Bài 13. Phản ứng Hóa Học
-
Hóa Học 8 Bài 13: Phản ứng Hóa Học
-
Giải Hóa 8 Bài 13: Phản ứng Hóa Học
-
Hoá Học 8 Bài 13: Phản ứng Hóa Học Giải Hoá Học Lớp 8 Trang 50, 51
-
Giải Bài Tập Hóa 8 Bài 13 Phản ứng Hóa Học - Soạn Bài Tập
-
Hóa Học Lớp 8 - Bài 13 - Phản ứng Hóa Học - YouTube
-
Giải Bài 13 Hóa Học 8: Phản ứng Hóa Học - Tech12h
-
Giải Bài Tập Hóa 8 Bài 13: Phản ứng Hóa Học
-
Giải Hóa 8 Bài 13: Phản ứng Hóa Học
-
Giải Bài Tập SGK Hóa Học 8 Bài 13: Phản ứng Hóa Học
-
Hoá Học 8 Bài 13: Phản ứng Hóa Học - Hoc247
-
Soạn Hóa Học 8 Bài 13: Phản ứng Hóa Học | Học Cùng
-
Bài 13 Hóa Học 8 - Phản ứng Hóa Học