Lý Thuyết Metan (mới 2022 + Bài Tập) - Hóa Học 9
Có thể bạn quan tâm
Lý thuyết Hóa 9 Bài 36: Metan
Bài giảng Hóa 9 Bài 36: Metan
Công thức phân tử metan: CH4
Phân tử khối: 16
I. Trạng thái tự nhiên, tính chất vật lí
- Trong tự nhiên, metan có nhiều trong các mỏ khí (khí thiên nhiên), trong mỏ dầu (khí mỏ dầu), trong các mỏ than (khí mỏ than), trong bùn ao (khí bùn ao), trong khí biogas.
- Metan là chất khí, không màu, không mùi, nhẹ hơn không khí (dCH4kk=1629) và tan rất ít trong nước.
Hình 1: Khí metan có trong bùn ao
II. Cấu tạo phân tử
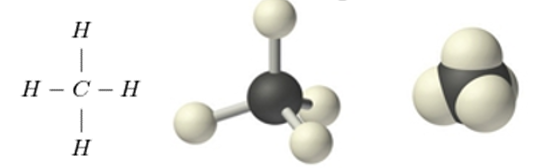
Hình 2: Công thức cấu tạo và mô hình phân tử metan dạng rỗng và dạng đặc.
- Quan sát công thức cấu tạo của metan thấy giữa nguyên tử cacbon và nguyên tử hiđro chỉ có một liên kết. Những liên kết như vậy là liên kết đơn.
⇒ Trong phân tử metan có bốn liên kết đơn.
III. Tính chất hóa học
1. Tác dụng với oxi
- Khi đốt trong oxi, metan cháy tạo thành khí CO2 và H2O. Phản ứng tỏa nhiều nhiệt.
CH4 + 2O2 →t0 CO2 + 2H2O
- Hỗn hợp gồm 1 thể tích metan và 2 thể tích oxi là hỗn hợp nổ mạnh.
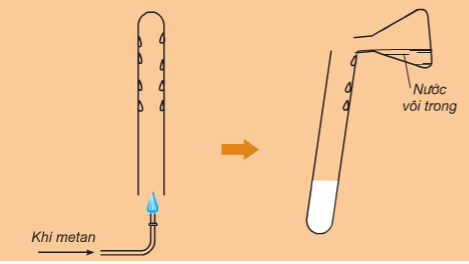
Hình 3: Phản ứng cháy của metan
2. Tác dụng với clo khi có ánh sáng
- Phương trình hóa học:
H HH−C−H+Cl−Cl→Ánh sángH−C−Cl+HCl H H
Viết gọn: CH4 + Cl2 →Ánh sáng CH3Cl (metyl clorua) + HCl
- Ở phản ứng này, nguyên tử H của metan được thay thế bởi nguyên tử Cl, vì vậy phản ứng này được gọi là phản ứng thế.
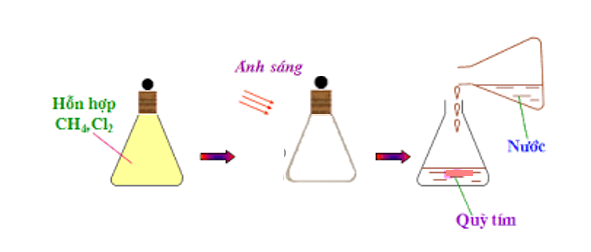
Hình 4: Phản ứng của clo với metan.
IV. Ứng dụng
- Metan cháy tỏa nhiều nhiệt nên được đùng làm nhiên liệu trong đời sống và trong sản xuất.
- Metan là nguyên liệu dùng điều chế hiđro theo sơ đồ:
Metan + H2O → t0xt cacbon đioxit + hiđro
- Metan còn được dùng để điều chế bột than và nhiều chất khác.
Trắc nghiệm Hóa học 9 Bài 36: Metan
Câu 1:Đốt cháy hợp chất hữu cơ nào sau đây thu được số mol CO2nhỏ hơn số mol H2O?
A.CH4
B.C4H6
C.C2H4
D.C6H6
Hiển thị đáp ánCâu 2:Ứng dụng của metan là
A. Metan cháy tỏa nhiều nhiệt nên được đùng làm nhiên liệu trong đời sống và trong sản xuất.
B. Metan là nguyên liệu dùng điều chế hiđro.
C. Metan còn được dùng để điều chế bột than và nhiều chất khác.
D. Cả A, B, C đều đúng.
Hiển thị đáp ánCâu 3:Đốt cháy 4,8 gam metan trong oxi, sau phản ứng thu được V lít khí CO2. Giá trị của V là
A. 3,36 lít
B. 4,48 lít
C. 5,60 lít
D. 6,72 lít
Hiển thị đáp ánCâu 4:Tính chất vật lý của metan là
A. Chất khí, không màu, không mùi, nhẹ hơn không khí, ít tan trong nước.
B. Chất lỏng, không màu, tan nhiều trong nước.
C. Chất khí, không màu, mùi xốc, nặng hơn không khí, ít tan trong nước.
D. Chất khí, màu vàng lục, tan nhiều trong nước.
Hiển thị đáp ánCâu 5:Phản ứng hóa học đặc trưng của metan là
A. Phản ứng phân hủy
B. Phản ứng tách
C. Phản ứng cộng
D. Phản ứng thế
Hiển thị đáp ánCâu 6:Thể tích khí oxi cần dùng để đốt cháy hết 4,48 lít khí metan là
A. 6,72 lít
B. 8,96 lít
C. 9,52 lít
D. 10,08 lít
Hiển thị đáp ánCâu 7:Tính chất hóa học nào sau đâykhôngphải của metan?
A. Làm mất màu dung dịch nước brom.
B. Tác dụng với oxi tạo thành CO2và nước.
C. Tham gia phản ứng thế.
D. Tác dụng với clo khi có ánh sáng.
Hiển thị đáp ánCâu 8:Điều kiện để xảy ra phản ứng giữa metan và khí clo là
A. Có ánh sáng
B. Có axit làm xúc tác
C. Có sắt làm xúc tác
D. Làm lạnh.
Hiển thị đáp ánCâu 9:Khối lượng CO2và H2O thu được khi đốt cháy 16 gam khí metan là
A. 44 gam và 36 gam
B. 44 gam và 18 gam
C. 22 gam và 18 gam
D. 22 gam và 36 gam
Hiển thị đáp ánCâu 10:Chọn câuđúngtrong các câu sau:
A. Metan có nhiều trong khí quyển.
B. Metan có nhiều trong nước biển.
C. Metan có nhiều trong nước ao, hồ.
D. Metan có nhiều trong các mỏ khí, mỏ dầu và mỏ than.
Hiển thị đáp ánXem thêm các bài tổng hợp lý thuyết Hóa lớp 9 đầy đủ, chi tiết khác:
Lý thuyết Bài 37: Etilen
Lý thuyết Bài 38: Axetilen
Lý thuyết Bài 39: Benzen
Lý thuyết Bài 40: Dầu mỏ và khí thiên nhiên
Lý thuyết Bài 41: Nhiên liệu
Từ khóa » Hóa 9 Bài 36 Lý Thuyết
-
Hóa 9 Bài 36: Metan
-
Hóa Học 9 Bài 36: Metan Hay, Chi Tiết - Lý Thuyết Hóa Học 9
-
Lý Thuyết Hóa 9: Bài 36. Metan - TopLoigiai
-
Hoá Học 9 Bài 36: Metan - HOC247
-
Lý Thuyết Hóa Học 9 Bài 36: Metan Hay, Chi Tiết - Haylamdo
-
Bài 36. Metan
-
Soạn Hoá Học 9 Bài 36: Metan | Học Cùng
-
Lý Thuyết & Bài Soạn Bài 36: Metan - Chương 4 - Hóa Học Lớp 9
-
Giải Bài 36 Hóa Học 9: Metan - Tech12h
-
Hóa Học 9 Bài 36: Metan Hay, Chi Tiết - Lý Thuyết Hóa Học 9.
-
Hóa Học 9 Bài 36: Metan Giải Hoá Học Lớp 9 Trang 116
-
Bài 36 Hóa 9
-
Lý Thuyết Hóa 9: Bài 36. Metan | Giải Hóa 9
-
Hóa Học 9 Bài 36: Metan