Năng Lượng Của Các Electron Trong Nguyên Tử - Cấu Hình Electron
Có thể bạn quan tâm
Nâng cấp gói Pro để trải nghiệm website VnDoc.com KHÔNG quảng cáo, và tải file cực nhanh không chờ đợi.
Tìm hiểu thêm » Mua ngay Từ 79.000đ Hỗ trợ ZaloNăng lượng của các electron trong nguyên tử - Cấu hình electron nguyên tử được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học nắm được cấu hình electron của nguên tử, tử đó vận dụng vào làm các dạng bài tập câu hỏi xác định cấu hình electron tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Cấu hình electron của nguyên tử
- I. Năng lượng của electron trong nguyên tử
- 1. Mức năng lượng obitan nguyên tử
- 2. Trật tự các mức năng lượng obitan nguyên tử
- II. Các nguyên lí và quy tắc phân bố electron trong nguyên tử
- 1. Nguyên lí Pau-li
-
- 2. Nguyên lí bền vững
- 3. Quy tắc Hun
- III. Cấu hình electron nguyên tử
- 1. Cấu hình electon nguyên tử
- 2. Đặc điểm của lớp electron ngoài cùng
- IV. Mối quan hệ giữa cấu hình electron và tính chất nguyên tố
- 1. Loại nguyên tố
- 2. Công thức một số loại hợp chất và tính chất của hợp chất đó
- V. Ví dụ bài tập minh họa
- VI. Bài tập cấu hình eletron
I. Năng lượng của electron trong nguyên tử
1. Mức năng lượng obitan nguyên tử
Trong nguyên tử, các electron trên mỗi obitan có một mức năng lượng xác định. Mức năng lượng này là mức năng lượng obitan nguyên tử (mức năng lượng AO).
Các electron trên các obitan khác nhau của cùng một phân lớp có năng lượng như nhau.
2. Trật tự các mức năng lượng obitan nguyên tử
Trật tự các mức năng lượng tăng dần theo trình tự sau:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d…
- Từ trình tự mức năng lượng AO trên cho thấy khi điện tích hạt nhân tăng có sự chèn mức năng lượng, mức 4s trở nên thấp hơn 3d, mức 5s thấp hơn 4d, 6s thấp hơn 4f, 5d, ...
II. Các nguyên lí và quy tắc phân bố electron trong nguyên tử
1. Nguyên lí Pau-li
Nguyên lý Pauli: Trên 1 obitan có tối đa 2e và 2e này chuyển động tự quay khác chiều nhau:
2. Nguyên lí bền vững
Ở trạng thái cơ bản, trong nguyên tử các electron chiếm lần lượt các obitan có mức năng lượng từ thấp đến cao.
3. Quy tắc Hun
Trong 1 phân lớp, các electron sẽ phân bố trên các obitan sao cho số electron độc thân là tối đa và có chiều tự quay giống nhau.
Ví dụ:
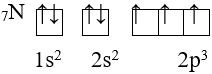
III. Cấu hình electron nguyên tử
1. Cấu hình electon nguyên tử
Cấu hình electron nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.Quy ước cách viết cấu hình electron nguyên tử:
- Số thứ tự lớp electron được ghi bằng chữ số (1, 2, 3...)
- Phân lớp được ghi bằng các chữ cái thường (s, p, d, f)
- Số electron trong một phân lớp được ghi bằng số ở phía trên bên phải của phân lớp.
Cách viết cấu hình electron nguyên tử gồm các bước sau
- Bước 1: Xác định số electron của nguyên tử.
- Bước 2: Các electron được phân bố lần lượt vào các phân lớp theo chiều tăng của năng lượng trong nguyên tử (1s 2s 2p 3s 3p 4s 3d 4p 5s…) và tuân theo quy tắc sau:
Phân lớp s chứa tối đa 2 electron;
Phân lớp p chứa tối đa 6 electron;
Phân lớp d chứa tối đa 10 electron;
Phân lớp f chứa tối đa 14 electron.
- Bước 3: Viết cấu hình electron biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
Ví dụ: 26Fe. Viết theo trật tự mức năng lượng AO tăng dần:
1s22s22p63s23p64s23d6
Sau đó viết lại theo thứ tự các phân lớp electron trong 1 lớp:
1s22s22p63s23p63d64s2
Viết gọn: [Ar]3d64s2
Chú ý: Khi viết cấu hình electron để dễ nhớ trật tự các mức năng lượng, ta viết theo thứ tự lớp với 2 phân lớp s, p như sau:
1s 2s2p 3s3p 4s ... 4p 5s ... 5p 6s ... 6p 7s ... 7p
- Sau đó thêm 3d vào giữa lớp 4s ... 4p
- Thêm 4d vào giữa lớp 5s ... 5p
- Thêm 4f 5d vào giữa lớp 6s ... 6p
- Thêm 5f 6d vào giữa lớp 7s ... 7p
Ta sẽ được: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
>> Một số lưu ý khi viết cấu hình electron:
Cần xác định đúng số e của nguyên tử hay ion (Số electron(e) = số proton(n) = Z).
Nắm vững các nguyên lý và quy tắc, kí hiệu của lớp và phân lớp.
Quy tắc bão hòa và bán bão hòa trên d và cấu hình e bền khi các e điền vào phân lớp 4 đạt bão hòa (d, f) hoặc bán bão hòa (d, f).
+ Trật tự các mức năng lượng AO tăng dần như sau:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
+ Dạng (n – 1)d4ns2 chuyển thành (n – 1)d5ns1
(n – 1)d9ns2 chuyển thành (n – 1)d10ns1
2. Đặc điểm của lớp electron ngoài cùng
Các electron lớp ngoài cùng quyết định tính chất hóa học của một nguyên tố.
Số electron lớp ngoài cùng tối đa là 8e.
+ Các nguyên tử kim loại có: 1e, 2e, 3e lớp ngoài cùng.
+ Các nguyên tử phi kim có: 5e, 6e, 7e lớp ngoài cùng.
+ Các nguyên tử khí hiếm có: 8e (He có 2e) lớp ngoài cùng.
+ Các nguyên tử có 4e lớp ngoài cùng có thể là kim loại (Ge, Sn, Pb) có thể là phi kim (C, Si).
Trong phần chuyên đề trên đây chúng ta có thể hiểu biết thêm về Năng lượng của các electron trong nguyên tử - Cấu hình electron nguyên tử gồm các khái niệm về nắng lượng các electron có trong nguyên tử và các cấu hình electron.
IV. Mối quan hệ giữa cấu hình electron và tính chất nguyên tố
1. Loại nguyên tố
Nguyên tử có 1, 2, 3 e ở lớp ngoài cùng: là nguyên tố kim loại (trừ H, He).
Nguyên tử có 5, 6, 7 e ở lớp ngoài cùng: thường là nguyên tố phi kim.
Nguyên tử có 8e ở lớp ngoài cùng: là nguyên tố khí hiếm (cả trường hợp He có 2e).
Nguyên tử có 4e ở lớp ngoài cùng là phi kim nếu thuộc chu kì 2, 3 và là kim loại nếu thuộc các chu kì khác.
2. Công thức một số loại hợp chất và tính chất của hợp chất đó
Nếu nguyên tố R thuộc nhóm nA:
Hóa trị trong oxit cao nhất là n → công thức oxit cao nhất là R2On.
Hóa trị trong hợp chất khí với H (chỉ áp dụng với phi kim) là (8 – n) → công thức hợp chất khí với H là RH8-n.
Công thức hidroxit cao nhất: R(OH)n (nếu n < 4 thì giữ nguyên công thức; nếu n > 3 thì chuyển thành dạng axit HnROn và tối giản công thức bằng cách bớt đi số phân tử H2O phù hợp).
Nếu n < 4: oxit và hidroxit cao nhất thường có tính bazơ; nếu n > 3: oxit và hidroxit cao nhất thường có tính axit.
V. Ví dụ bài tập minh họa
Ví dụ 1: Viết cấu hình e nguyên tử của các nguyên tố sau: Na (Z=11):
Hướng dẫn giải bài tập
Bước 1: Xác định E = Z = 11
Bước 2: Sắp xếp các e theo thứ tự tăng dần: 1s2 2s2 2p6 3s1
Bước 3: Viết cấu hình e: 1s2 2s2 2p6 3s1
Ví dụ 2: Tổng số hạt proton, notron và electron trong nguyên tử của một nguyên tố là 13.
a) Xác định nguyên tử khối.
b) Viết cấu hình electron nguyên tử của nguyên tố đó.
Hướng dẫn giải bài tập
a) Tổng số hạt proton, nơtron, electron trong 1 nguyên tử của nguyên tố đã cho là 13. Số proton bằng số electron nên ta có phương trình: 2Z + N =13
Mặt khác từ nguyên tố số 2 đến 82 trong bảng tuần ta có :
Z ≤ N; mà N =13 – 2Z ⇒ Z ≤ 13 – 2Z ⇒ Z ≤ 4,333 (1)
N ≤ 1,5Z ⇒ 13-2Z ≤ 1,5Z ⇒ 3,5Z ≥ 13 ⇒ Z ≥ 3,7 (2)
Từ (1) và (2) và vì Z nguyên dương 3,7 ≤ Z ≤ 4,333 . vậy Z =4
Suy ra số nơtron: N =13 – 2Z = 13 -2.4 = 5
Vậy nguyên tử khối cần tìm theo yêu cầu bài toán là 4+5=9.
b) Viết cấu hình electron: Z=4 có cấu hình là 1s22s2. Đây là nguyên tố s
Ví dụ 3: Viết cấu hình e nguyên tử của các nguyên tố sau: Fe (Z = 26)
Hướng dẫn giải bài tập
Fe Có 26 e
Viết theo trật tự mức năng lượng AO tăng dần:
1s22s22p63s23p64s23d6
+ Sau đó viết lại theo thứ tự các phân lớp electron trong 1 lớp:
1s2 2s22p63s23p6 d64s2
+ Viết gọn: [Ar] 3d64s2
VI. Bài tập cấu hình eletron
Bài 1. Nguyên tử X có tổng số hạt là 52, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16.
a. Xác định vị trí của X trong bảng tuần hoàn các nguyên tố hóa học.
b. Xác định tên nguyên tố X.
Bài 2. Nguyên tử R có tổng số hạt là 93, trong đó số hạt không mang điện tích bằng 60,3448% số hạt mang điện.
a. Xác định vị trí của R trong bảng tuần hoàn các nguyên tố hóa học
b. Xác định nguyên tố R.
Bài 3. Tổng số hạt trong ion là 24, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10.
a. Xác định vị trí của X trong bảng tuần hoàn các nguyên tố hóa học
b. Viết công thức oxit cao nhất của X.
Bài 4. Ion R+ và X2- đều có cấu hình electron ở phân lớp ngoài cùng là 3p6.
a. Xác định vị trí của nguyên tố R, X trong bảng tuần hoàn
b. Viết công thức oxit cao nhất của R, X.
Bài 5. Nguyên tử X có 7 electron p, nguyên tử Y có tổng số hạt mang điện nhiều hơn số hạt mang điện của nguyên tử X là 8 hạt.
a. Xác định vị trị của X,Y trong bảng tuần hoàn
b. Xác định nguyên tố X, Y.
.................................
>> Mời các bạn tham khảo thêm một số tài liệu liên quan
- Bài tập về cấu hình electron
- Tính phần trăm đồng vị, tính nguyên tử khối trung bình
- Xác định nguyên tố dựa vào số hạt
Từ khóa » Nguyên Lý Pauli Hóa 10
-
Lý Thuyết Cấu Hình Electron Nguyên Tử | SGK Hóa Lớp 10 - Học Tốt
-
Lí Thuyết Cấu Hình Electron Nguyên Tử - MÔN HÓA Lớp 10
-
Cách Viết Cấu Hình Electron: Nguyên Lý Pauli, Quy Tắc Hund, Nguyên ...
-
Lý Thuyết, Cách Viết Cấu Hình Electron Nguyên Tử Và Bài Tập Vận ...
-
Nguyên Lý Loại Trừ Pauli – Wikipedia Tiếng Việt
-
Toàn Bộ Lý Thuyết Và Cách Viết Cấu Hình Electron Nguyên Tử Dễ Nhớ
-
Lý Thuyết Cấu Hình Electron Nguyên Tử - Hoá Học Lớp 10 - Haylamdo
-
Môn Hóa Học Lớp 10 Khi Nào Dùng Nguyên Lý Pauli ... - By TopList24h
-
Bài 2 Trang 32 SGK Hóa 10 Nâng Cao - TopLoigiai
-
Nguyên Tắc Của Pauli(Luật Loại Trừ) (Vật Lý) - Mimir Bách Khoa Toàn Thư
-
Cấu Hình Electron Nguyên Tử: Quy ước Cách Viết Và Những Lưu ý
-
Trong Các Cấu Hình Electron Dưới đây, Cấu Hình Nào Không Tuân Theo ...
-
I. Kiến Thức Trọng Tâm Cấu Tạo Nguyên Tử - Quê Hương
-
Cách Viết Cấu Hình Electron Hay, Chi Tiết | Hóa Học Lớp 10 - Go Spring
