Nguyên Tử Khối Là Gì ? Bảng Nguyên Tử Khối Hóa Học Và Mẹo Học ...
Có thể bạn quan tâm
Khi bắt đầu bước vào lớp 8 các bạn sẽ bắt đầu làm quen với nguyên tử khối, bảng nguyên tử khối hóa học.Cùng với các kiến thức cơ sở khác nhau như bảng hóa trị, bảng nguyên tử khối hóa học sẽ song hành cùng các bạn trong suốt quá trình học hóa và là công cụ giúp các bạn giải các bài toán khó một cách nhanh chóng nhất.Nguyên tử của các nguyên tố khác nhau có kích thước và khối lượng khác nhau.
Định nghĩa thế nào là nguyên tử khối :
1.Nguyên tử khối là gì ?
Khối lượng riêng của một nguyên tử nhật định được tính băng đơn vị Cacbon (đvC) được gọi là nguyên tử khối. Các nguyên tố khác nhau có chỉ số nguyên tử khối khác nhau va khối lượng tính băng đơn vị Cacbon chỉ là khối lượng tương đối
Ví dụ : Khối lượng ( nguyên tử khối ) của Hidro (H) = 1 (đvC), của Neon (Ne) = 20 (đvC).
Nguyên tử khối của nguyên tử chính la khối lượng tương đối của một nguyên tử của nguyên tố đó, la tổng khối lượng các proton, electron và notron. Tuy nhiên khối lượng các electron thường rất nhỏ nên không được tính, vì thế khối lượng của nguyên tử chính băng số khối của hạt nhân
Nguyên tử khối cũng chính là khối lượng và tính theo đơn vị gam của 1 mol nguyên tử. Nó được ký hiệu bằng chữ u trong hệ quốc tế về đo lường.
1 u = 1/NA gam = 1/(1000 NA) kg
(Với NA là hằng số Avogadro)
1 u ≈ 1.66053886 x 10-27 kg
1 u ≈ 1.6605 x 10-24 g
2. Đơn vị Cacbon la gi?
Là đơn vị mặc định dùng để đo khối lượng các nguyên tử được ký hiệu la đvC. Trong đó một đơn vị Cacbon thương băng 1/12 khối lượng một hạt nhân của nguyên tử các bọn đồng vị C12.
Trong lịch sử và thế kỷ XII các nhà khoa học đã sử dụng Hydro hoặc Oxi để lam đơn vị tiêu chuẩn. Năm 1961 Viện Đo Lương Quốc Tế đã sử dụng Cacbon là đơn vị đo lường vì sư phổ biến của đồng vị C12 trong thiên nhiên và chỉ số sai số rất thấp.
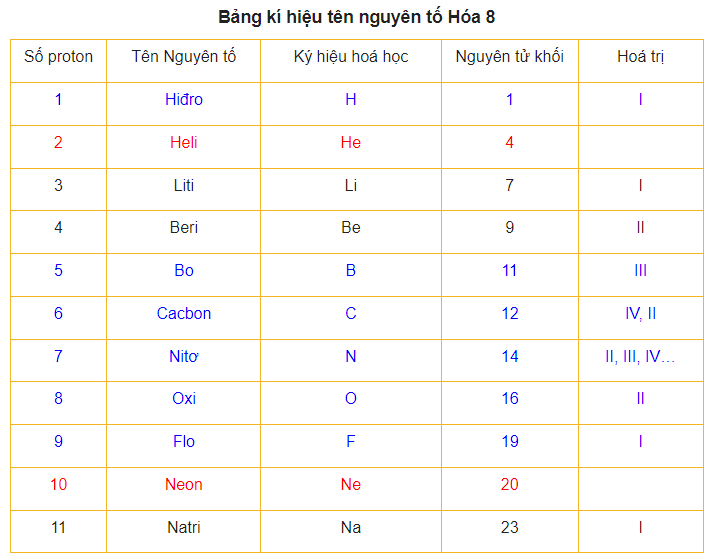
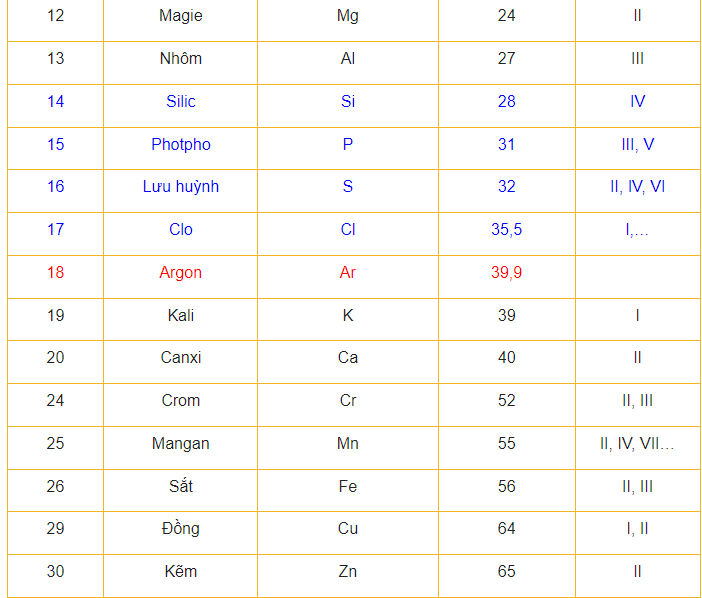
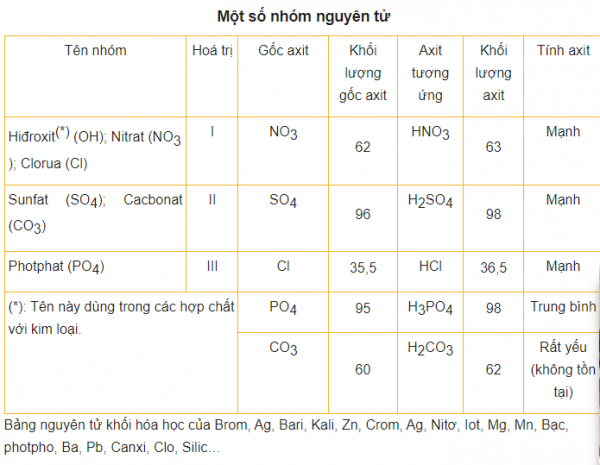
3 Nguyên tử khối trung bình
Hầu hết các nguyên tố hóa học là hỗn hợp của nhiều đồng vị với tỉ lệ phần trăm số nguyên tử xác định => nguyên tử khối của các nguyên tố có nhiều đồng vị là nguyên tử khối trung bình của hỗn hợp các đồng vị có tính đến tỉ lệ phần trăm số nguyên tử tương ứng.
Giả sử nguyên tố X có 2 đồng vị A và B. kí hiệu A,B đồng thời là nguyên tử khối của 2 đồng vị, tỉ lệ phần trăm số nguyên tử tương ứng là a và b. Khi đó: nguyên tử khối trung bình \bar{A} của nguyên tố X là:
\bar{A}=\frac{aA+bB}{100}
Trong những phép toán không cần độ chính xác cao, có thể coi nguyên tử khối bằng số khối.
Công thức tính khối lượng mol nguyên tử Công thức và các bước tính khối lượng nguyên tử
Bước 1: Cần nhớ 1 đvC = 0,166 . 10-23
Bước 2: Tra bảng nguyên tử khối của nguyên tố. Chẳng hạn nguyên tố A có nguyên tử khối là a, tức A = a. Chuyển sang bước 3.
Bước 3: Khối lượng thực của A: mA = a . 0,166.10-23 = ? (g)
Một số công thức tính thường dùng
Tính số mol: + Khi cho khối lượng chất: n = (mol); Khi cho thể tích chất khí: n = (mol)
Khi cho CM, Vlit dung dịch: n =CM.V (mol); Khi cho khối lượng dung dịch, nồng độ phần trăm: n = (mol)
Tính khối lượng: m= n.M( gam); khối lượng chất tan: mct = (gam)
Tính nồng độ: Nồng độ C%= .100%; tính nồng độ mol của dung dịch: CM= (M) (nhớ đổi V ra lit)
mẹo học nhanh :
1.Thường xuyên làm bài tập hóa học
Đây là phương pháp tối ưu để ghi nhớ nhanh bảng nguyên tử khối hóa học. Sau khi hiểu được cốt lõi nội dung bạn sẽ nhanh chóng học thuộc công thức của nó. Và sau khi đã học thuộc được các công thức, bạn nên luyện tập thường xuyên, thỉnh thoảng phải ôn lại kẽo quên.
2. Học qua bài ca nguyên tử khối
Khi đã có những bài ca về nguyên tử khối hóa học này việc học thuộc, ghi nhớ sẽ dễ dàng hơn. Sau đây là 2 bài ca nguyên tử khối dễ nhớ nhất.
Bài tập về nguyên tử khối :
Bài 1
Nguyên tử X nặng gấp hai lần nguyên tử Nitơ. Tính nguyên tử khối và cho biết X thuộc nguyên tố nào? Viết kí hiệu hóa học của nguyên tố đó.
Hướng dẫn giải :
Nguyên tử khối của nguyên tử Nito = 14 đvC. Mà nguyên tử X nặng gấp 2 lần nguyên tử Nito
=> Nguyên tử khối của X = 14 x 2 = 28 (đvC)
Nguyên tử X là là nguyên tố Silic, kí hiệu là Si.
Bài 2 :
Hãy so sánh nguyên tử magie nặng hay nhẹ hơn bao nhiêu lần so với:
a) Nguyên tử Cacbon b) Nguyên tử Lưu huỳnh c) Nguyên tử Nhôm
Hướng dẫn giải
Để làm được bài tập này, chúng ta cần xác định được nguyên tử khối của các nguyên tử Magie (Mg), Cacbon (C), Lưu huỳnh (S) và Nhôm (Al) dựa vào bảng nguyên tử khối.
a) Nguyên tử khối của Mg = 24; nguyên tử khối của C = 12
=> Nguyên tử Mg nặng hơn nguyên tử C 24/12 = 2 lần.
b) Nguyên tử khối của Mg = 24; nguyên tử khối của S = 32
=> Nguyên tử Mg nhẹ hơn nguyên tử S 24/32 = 0,75 lần.
c) Nguyên tử khối của Mg = 24, nguyên tử khối của Al = 27
=> Nguyên tử Mg nhẹ hơn nguyên tử Al 24/27 = 8/9 lần.
Chú ý : Bảo toàn khối lượng là gì ?công thức và cách tính hóa
Bảng nguyên tử khối, các nguyên tố hóa học
Bảng hóa trị lớp 8,cách học thuộc bằng bài ca hóa trị
Từ khóa » Nguyên Tử Khối Mg
-
Bảng Nguyên Tử Khối Hóa Học Và Mẹo Học Bảng ...
-
Bảng Nguyên Tử Khối Hóa Học đầy đủ Và Mẹo Ghi Nhớ Nhanh
-
Bảng Nguyên Tử Khối Hóa Học đầy đủ
-
Bảng Nguyên Tử Khối Mg, Mn, Bạc, Photpho, Ba, Pb, Canxi, C…
-
Bảng Nguyên Tử Khối Hóa Đầy Đủ Và M Của Mg, Nguyên ...
-
Bảng Nguyên Tử Khối Hóa đầy đủ Và Mẹo Học Thuộc ... - MTrend
-
Nguyên Tử Khối Của Magie, Mg Nguyên Tử Khối, M Của Mg Là Bao ...
-
Bảng Nguyên Tử Khối Và đơn Vị Của Ag, Brom, Bali... Bài ... - Bierelarue
-
Mg Nguyên Tử Khối
-
Phân Tử Khối Của Mg - Magie Nguyên Tử Khối
-
Bảng Nguyên Tử Khối
-
Nguyên Tử Khối Là Gì? Bảng Nguyên Tử Khối Hóa Học
-
Nguyển Tử Khối Là Gì? Bảng Nguyên Tử Khối Là Gì