Nguyên Tử Là Gì? Hạt Nhân Nguyên Tử - Lớp Electron - Từ điển Hóa Học
Có thể bạn quan tâm
Nguyên tử là gì? Nguyên tử được cấu tạo từ proton, nơtron và electron, vậy điện tích của chúng ra sao? Chúng ta cùng tìm hiểu thành phần cấu tạo nguyên tử trong bài học sau đây nhé!
Tóm tắt nội dung
- A – KIẾN THỨC TRỌNG TÂM – NGUYÊN TỬ
- 1. Nguyên tử là gì?
- 2. Hạt nhân nguyên tử
- 3. Lớp vỏ electron
- B – GIẢI BÀI TẬP
A – KIẾN THỨC TRỌNG TÂM – NGUYÊN TỬ
1. Nguyên tử là gì?
Nguyên tử là hạt vô cùng nhỏ và trung hòa về điện. Nguyên tử gồm có hạt nhân mang điện tích dương và lớp vỏ electron mang điện tích âm.
Electron kí hiệu là e. Nó có điện tích nhỏ nhất và quy ước ghi bằng dấu (-).
2. Hạt nhân nguyên tử
Hạt nhân nguyên tử được tạo bởi proton và nơtron.
+) Proton (p): mang điện tích dương (+), có điện tích bằng electron nhưng trái dấu.
+) Nơtron (n): không mang điện tích.
+) Trong một nguyên tử: số p = số e
Khối lượng proton = khối lượng nơtron. Khối lượng electron rất nhỏ => Khối lượng hạt nhân được xem là khối lương nguyên tử.
Mô hình nguyên tử
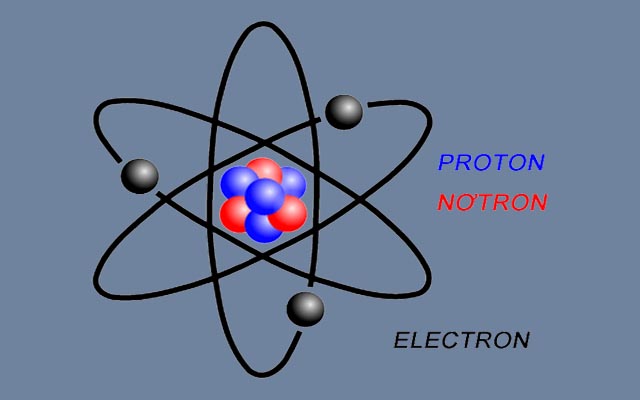
nguyen-tu-la-gi
3. Lớp vỏ electron
– Trong nguyên tử, các electron sắp xếp thành từng lớp và chuyển động quanh hạt nhân. Mỗi lớp electron có số electron nhất định.
– Ví dụ:
Nguyên tử Hiđro có 1 lớp electron, chứa 1 e.
Nguyên tử Oxi có 2 lớp electron, lớp thứ nhất có 2 e, lớp thứ 2 (ngoài cùng) có 6 e.
B – GIẢI BÀI TẬP
Câu 1. Điền từ vào chỗ trống:
+) Nguyên tử
+) nguyên tử
+) hạt nhân
+) một hay nhiều electron mang điện tích âm
Câu 2.
a) Nguyên tử được tạo thành từ 3 loại hạt nhỏ hơn, đó là: hạt proton, hạt nơtron và hạt electron.
b) Tên, kí hiệu & điện tích của những hạt mang điện:
Hạt proton, kí hiệu: p, mang điện tích dương (+)
Hạt electron, kí hiệu: e, mang điện tích âm (-)
c) Nguyên tử cùng loại có cùng số “proton” trong hạt nhân.
Câu 3. Nguyên tử được tạo thành hạt nhân và lớp vỏ electron. Vì khối lượng của electron rất nhỏ so với khối lượng proton nên có thể xem khối lượng hạt nhân là khối lượng của nguyên tử.
Câu 4. Trong nguyên tử, hạt electron chuyển động rất nhanh và sắp xếp thành từng lớp quanh hạt nhân.
Ví dụ: Nguyên tử Oxi có 2 lớp electron, lớp thứ nhất có 2 e, lớp thứ 2 có 6 e.
Câu 5. Chỉ ra số p, số e, số lớp e và số e lớp ngoài cùng:
Heli: 2p, 2e, 1 lớp e, 2e lớp ngoài cùng
Cacbon: 6p, 6e, 2 lớp e, 4e lớp ngoài cùng
Nhôm: 13p, 13e, 3 lớp e, 3e lớp ngoài cùng
Canxi: 20e, 20p, 4 lớp e, 2e lớp ngoài cùng
Đánh giá bài viếtTừ khóa » Hạt Nhân Nguyên Tử Là Gì Lớp 8
-
Toàn Bộ Kiến Thức Hóa Học Lớp 8 Về Chất, Nguyên Tử, Phân Tử
-
Lý Thuyết Về Nguyên Tử | SGK Hóa Lớp 8
-
Hoá Học 8 Bài 4: Nguyên Tử - Hoc247
-
Nguyên Tử Là Gì? Lớp Electron Là Gì? Cấu Tạo Hạt Nhân Nguyên Tử
-
Hạt Nhân Nguyên Tử Là Gì? Cấu Tạo Của Hạt Nhân Nguyên Tử
-
Nguyên Tử, Hạt Nhân Nguyên Tử Là Gì? Cấu Tạo Của Hạt Nhân Nguyên ...
-
Hạt Nhân Nguyên Tử Có Cấu Tạo Như Thế Nào? - Top Lời Giải
-
Nguyên Tử Là Gì? Phân Tử Là Gì? Các Dạng Bài Tập Liên Quan
-
Nguyên Tử Là Gì? Lớp Electron Là Gì? Cấu Tạo Hạt Nhân Nguyên Tử
-
Nguyên Tử – Wikipedia Tiếng Việt
-
Hóa 8 Bài Nguyên Tử - Null - ICAN
-
Giải Bài Tập Hóa Học 8 - Bài 4: Nguyên Tử
-
Hóa Học Lớp 8 - Bài 4 - Nguyên Tử Là Gì ? - Hoá Học Plus