Nguyên Tử
Có thể bạn quan tâm
I. L Ý THUYẾT
1. Định nghĩa
- Nguyên tử là hạt vô cùng nhỏ, trung hoà về điện, cấu tạo nên các chất.
2. Cấu tạo
- Nguyên tử luôn trung hòa về điện →
Chú ý: Hiđro là nguyên tử đặc biệt chỉ có duy nhất một hạt proton.
- Trong nguyên tử, các e chuyển động rất nhanh và sắp xếp thành từng lớp từ trong ra ngoài.
+ Lớp 1: có tối đa 2e
+ Lớp 2, 3, 4… tối đa 8e
- Khối lượng nguyên tử = số P + số N + số e = số P + số N (vì e có khối lượng rất nhỏ nên bỏ qua).
II. BÀI TẬP CỦNG CỐ
Bài 1. Điền vào chỗ trống với cụm từ thích hợp:
“….là hạt vô cùng nhỏ, trung hòa về điện: từ…tạo ra mọi chất. Nguyên tử gồm…mang điện tích dương và vỏ tạo bởi ….mang …..”
Bài 2.
- Nguyên tử tạo thành từ 3 loại hạt nhỏ hợn nữa, đó là những hạt nào?
- Hãy nói tên, kí hiệu, điện tích của những hạt mang điện.
- Những nguyên tử cùng loại có cùng số hạt nào trong hạt nhân?
Bài 3. Vì sao nói khối lượng của hạt nhân được coi là khối lượng của nguyên tử?
Bài 4.
- Trong nguyên tử, electron chuyển động và sắp xếp như thế nào?
- Nhờ đâu mà nguyên tử có khả năng liên kết?
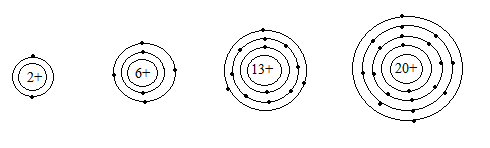
Bài 5. Cho sơ đồ một số nguyên tử sau:
Neon Cacbon Nhôm Canxi
Hãy chỉ ra số p trong hạt nhân, số e trong nguyên tử, số lớp electorn, và số electron lớp ngoài cùng.
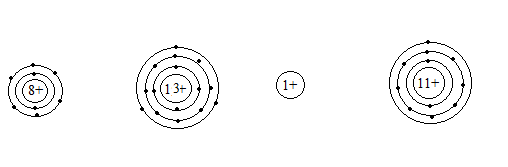
Bài 6. Cho số p của các nguyên tử sau:
| Nguyên tử | O | Al | H | Na |
| Số proton | 8 | 13 | 1 | 11 |
Hãy biểu diễn sự phân bố electron trên các lớp electron của từng nguyên tử trên.
HƯƠNG DẪN GIẢI
Bài 1.
“ Nguyên tử là hạt vô cùng nhỏ, trung hòa về điện: từ nguyên tử tạo ra mọi chất. Nguyên tử gồm hạt nhân mang điện tích dương và vỏ tạo bởi electron mang điện tích âm”.
Bài 2.
1. Electron, proton, nơtron.
2. – Electron: kí hiệu là e, mang điện tích âm.
– Protron: kí hiệu p, mang điện tích dương.
3.Các hạt nguyên tử cùng loại có cùng số proton trong hạt nhân.
Bài 3.
Hạt nhân bao gồm proton và nơtron có khối lượng rất lớn so với các hạt electron (khối lượng electron rất bé) nên khối lượng của hạt nhân được coi là khối lượng của nguyên tử.
Bài 4.
- Trong nguyên tử, electron luôn chuyển động quanh hạt nhân và sắp xếp thành từng lớp.
- Nguyên tử có khả năng liên kết là do các electron.
Bài 5.
| Nguyên tử | Số P trong hạt nhân | Số e trong nguyên tử | Số lớp electron | Số e lớp ngoài cùng |
| Neon | 2 | 2 | 1 | 2 |
| Cacbon | 6 | 6 | 2 | 4 |
| Nhôm | 13 | 13 | 3 | 3 |
| Canxi | 20 | 20 | 4 | 2 |
Bài 6.
Ta có tổng số electron trên các lớp của cac nguyên tố lần lượt là:
| Nguyên tử | O | Al | H | Na |
| Số electron | 8 | 13 | 0 | 11 |
H là trường hợp đặc biệt.
Dựa trên số electron tối đa trên các lớp:
- Lớp 1: tối đa 2 e
- Lớp 2: tối đa 8 e
- Lớp 3: tối đa 8 e
- Lớp 4 tối đa 8 e.
Ta có sự phân bố electron trên các lớp của các nguyên tố lần lượt như sau:
Từ khóa » Nguyên Tử Electron Như Thế Nào
-
Electron – Wikipedia Tiếng Việt
-
Nguyên Tử – Wikipedia Tiếng Việt
-
Nguyên Tử Là Gì? Lớp Electron Là Gì? Cấu Tạo Hạt Nhân Nguyên Tử
-
Thành Phần Cấu Tạo Của Nguyên Tử - Thầy Dũng Hóa
-
Cấu Tạo Vỏ Electron Của Nguyên Tử - Thầy Dũng Hóa
-
Thành Phần Cấu Tạo Nguyên Tử - Kích Thước Và Khối Lượng Nguyên Tử
-
Nguyên Tử Là Gì? Cấu Trúc Của Nguyên Tử Và Khối Lượng Nguyên Tử
-
Nguyên Tử Là Gì? Nguyên Tử được Cấu Tạo Bởi Những Hạt Nào?
-
Nguyên Tử Và Cấu Tạo Hạt Nhân Nguyên Tử - Hóa Học 24H
-
Trong Nguyên Tử Electron Chuyển động Và Sắp Xếp Như Thế Nào Lấy ...
-
Cấu Tạo Vỏ Nguyên Tử - Lý Thuyết Và Các Dạng Bài Tập Thường Gặp
-
Giải Bài Tập Hóa Học Lớp 8 | Bài 4 - Nguyên Tử
-
[CHUẨN NHẤT] Nguyên Tử Là Gì? - Top Lời Giải