Nung KNO3 Chất Này Phân Huỷ Thành KNO2 Và O2 A) Viết ... - Hoc24
Có thể bạn quan tâm
HOC24
Lớp học Học bài Hỏi bài Giải bài tập Đề thi ĐGNL Tin tức Cuộc thi vui Khen thưởng- Tìm kiếm câu trả lời Tìm kiếm câu trả lời cho câu hỏi của bạn
Lớp học
- Lớp 12
- Lớp 11
- Lớp 10
- Lớp 9
- Lớp 8
- Lớp 7
- Lớp 6
- Lớp 5
- Lớp 4
- Lớp 3
- Lớp 2
- Lớp 1
Môn học
- Toán
- Vật lý
- Hóa học
- Sinh học
- Ngữ văn
- Tiếng anh
- Lịch sử
- Địa lý
- Tin học
- Công nghệ
- Giáo dục công dân
- Tiếng anh thí điểm
- Đạo đức
- Tự nhiên và xã hội
- Khoa học
- Lịch sử và Địa lý
- Tiếng việt
- Khoa học tự nhiên
- Hoạt động trải nghiệm
- Hoạt động trải nghiệm, hướng nghiệp
- Giáo dục kinh tế và pháp luật
Chủ đề / Chương
Bài học
HOC24
 Khách vãng lai Đăng nhập Đăng ký Khám phá Hỏi đáp Đề thi Tin tức Cuộc thi vui Khen thưởng
Khách vãng lai Đăng nhập Đăng ký Khám phá Hỏi đáp Đề thi Tin tức Cuộc thi vui Khen thưởng - Tất cả
- Toán
- Vật lý
- Hóa học
- Sinh học
- Ngữ văn
- Tiếng anh
- Lịch sử
- Địa lý
- Tin học
- Công nghệ
- Giáo dục công dân
- Tiếng anh thí điểm
- Hoạt động trải nghiệm, hướng nghiệp
- Giáo dục kinh tế và pháp luật
Câu hỏi
Hủy Xác nhận phù hợp Chọn lớp Tất cả Lớp 12 Lớp 11 Lớp 10 Lớp 9 Lớp 8 Lớp 7 Lớp 6 Lớp 5 Lớp 4 Lớp 3 Lớp 2 Lớp 1 Môn học Toán Vật lý Hóa học Sinh học Ngữ văn Tiếng anh Lịch sử Địa lý Tin học Công nghệ Giáo dục công dân Tiếng anh thí điểm Đạo đức Tự nhiên và xã hội Khoa học Lịch sử và Địa lý Tiếng việt Khoa học tự nhiên Hoạt động trải nghiệm Hoạt động trải nghiệm, hướng nghiệp Giáo dục kinh tế và pháp luật Mới nhất Mới nhất Chưa trả lời Câu hỏi hay
- Tuyetlan Luu
Nung KNO3 chất này phân huỷ thành KNO2 và O2
a) Viết PTPU
b) Tính khối lượng KNO3 cần dùng để điều chế 2,4g oxi biết hiệu xuất phản ứng đạt 85% theo lí thuyết
c) Tính khối lượng oxi điều chế từ 10,1g KNO3 biết hiệu xuất phản ứng đạt 85% theo lí thuyết
Làm giúp mình với nhé. Mình cảm ơn nhiều lắm
Xem chi tiết Lớp 8 Hóa học Bài 27: Điều chế khí oxi-Phản ứng phân hủy 2 0 Gửi Hủy
Gửi Hủy  Đinh Tuấn Việt 8 tháng 7 2016 lúc 11:20
Đinh Tuấn Việt 8 tháng 7 2016 lúc 11:20 a. KN03 --> KN02 + 1/2 02 b. n 02 = 0,075 mol mà H% đạt 85% => n 02 lí thuyết thu đc = 0,075*100/85 = 3/34 mol KN03 --> KN02 + 1/2 02 3/17 mol <---- 3/34 mol vậy n KN03 = 3/17 mol c. n KN03 = 0,1 KN03 ---> KN02 + 1/2 02 lí thuyết:..0,1 -----------------> 0,05 mà H% = 80% => n 02 thu được = 0,05*80/100 = 0,04 mol => V 02 thực tế thu dc = 0,896 lit
Đúng 0 Bình luận (1) Gửi Hủy
Gửi Hủy  Huy Nguyen
Huy Nguyen  25 tháng 1 2021 lúc 19:31
25 tháng 1 2021 lúc 19:31 a. KN03 --> KN02 + 1/2 02 b. n 02 = 0,075 mol mà H% đạt 85% => n 02 lí thuyết thu đc = 0,075*100/85 = 3/34 mol KN03 --> KN02 + 1/2 02 3/17 mol <---- 3/34 mol vậy n KN03 = 3/17 mol c. n KN03 = 0,1 KN03 ---> KN02 + 1/2 02 lí thuyết:..0,1 -----------> 0,05 mà H% = 80% => n 02 thu được = 0,05*80/100 = 0,04 mol => V 02 thực tế thu dc = 0,896 lit
Đúng 0 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Chan Chan
Nung KNO3 chất này phân huỷ thành KNO2 và O2
a) Viết PTPU
b) Tính khối lượng KNO3 cần dùng để điều chế 2,4g oxi biết hiệu xuất phản ứng đạt 85% theo lí thuyết
c) Tính khối lượng oxi điều chế từ 10,1g KNO3 biết hiệu xuất phản ứng đạt 85% theo lí thuyết
Giúp mk với
Xem chi tiết Lớp 8 Hóa học CHƯƠNG IV: OXI - KHÔNG KHÍ 1 0 Gửi Hủy
Gửi Hủy  Trần Hữu Tuyển
Trần Hữu Tuyển  12 tháng 7 2017 lúc 13:46
12 tháng 7 2017 lúc 13:46 2KNO3\(\rightarrow\)2KNO2 + O2
b;nO2=\(\dfrac{2,4}{32}=0,075\left(mol\right)\)
Theo PTHH ta có:
nKNO3=2nO2=0,15(mol)
mKNO3 ban đầu=0,15.101=15,15(g)
mKNO3 thực tế=15,15.\(\dfrac{85}{100}=12,8775\left(g\right)\)
c;
nKNO3=\(\dfrac{10,1}{101}=0,1\left(mol\right)\)
Theo PTHH ta có:
\(\dfrac{1}{2}\)nKNO3=nO2=0,05(mol)
mO2 ban đầu=32.0,05=1,6(g)
mO2 thu được=1,6\(\dfrac{85}{100}=1,36\left(g\right)\)
Đúng 1 Bình luận (1) Gửi Hủy
Gửi Hủy 
- Trần Quý
Nung KNO3 chất này phân huỷ thành KNO2 và O2
a) Viết PTPU
b) Tính khối lượng KNO3 cần dùng để điều chế 6,4g oxi biết hiệu xuất phản ứng đạt 85%
c) Nếu phân hủy 20,2g KNO3 thì thể tích oxi sinh ra là bao nhiêu,biết hiệu xuất phản ứng đạt 80%
Xem chi tiết Lớp 8 Hóa học Bài 27: Điều chế khí oxi-Phản ứng phân hủy 3 0 Gửi Hủy
Gửi Hủy  Lê Tuấn Lộc 24 tháng 1 2019 lúc 11:44
Lê Tuấn Lộc 24 tháng 1 2019 lúc 11:44 Hướng dẫn: câu a, lập phương trình tự làm nha
b, có 6,4 g O2 thì tính được mol O2, theo phương trình tính được mol KNO3 rồi tính được khối lượng KNO3. mKNO3(thực tế)=mKNO3(tính theo PTHH)x100/H
c, tương tự câu b nhưng mO2(thực tế)=mO2(lý thuyết)xH/100
Đúng 0 Bình luận (0) Gửi Hủy
Gửi Hủy  Petrichor 24 tháng 1 2019 lúc 12:09
Petrichor 24 tháng 1 2019 lúc 12:09 a. PTHH: \(2KNO_3\rightarrow2KNO_2+O_2\) b. \(n_{O_2}=\dfrac{6,4}{32}=0,2\left(mol\right)\) Theo PT ta có: \(n_{KNO_3\left(theoPT\right)}=\dfrac{0,2.2}{1}=0,4\left(mol\right)\) \(n_{KNO_3\left(thực-tế\right)}=0,4:85\%=\dfrac{8}{17}\left(mol\right)\) => \(m_{KNO_3\left(thực-tế\right)}=\dfrac{8}{17}.101\approx47,53\left(g\right)\) c. \(n_{KNO_3}=\dfrac{20,2}{101}=0,2\left(mol\right)\) => \(n_{KNO_3\left(pư\right)}=0,2.80\%=0,16\left(mol\right)\) => \(n_{O_2}=\dfrac{0,16.1}{2}=0,08\left(mol\right)\) => \(V_{O_2}=0,08.22,4=1,792\left(l\right)\)
Đúng 0 Bình luận (0) Gửi Hủy
Gửi Hủy  Huy Nguyen
Huy Nguyen  25 tháng 1 2021 lúc 19:32
25 tháng 1 2021 lúc 19:32 a. PTHH: 2KNO3→2KNO2+O2 b. nO2=6,432=0,2(mol) Theo PT ta có: nKNO3(theoPT)=0,2.21=0,4(mol) nKNO3(thực−tế)=0,4:85%=817(mol) => mKNO3(thực−tế)=817.101≈47,53(g) c. nKNO3=20,2101=0,2(mol) => nKNO3(pư)=0,2.80%=0,16(mol) => nO2=0,16.12=0,08(mol) => VO2=0,08.22,4=1,792(l)
Đúng 0 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Nguyen Quynh
Nung Nóng KNO3 thu được KNO2 và O2 . Biết hiệu xuất phản ứng là 80% . Khối lượng KNO3 cần dùng để điều chế 0,64 gam O2 là
A. 4,04 gam B. 5,05 gam C. 7,84 gam D. 4,89 gam
Xem chi tiết Lớp 8 Hóa học 2 0 Gửi Hủy
Gửi Hủy  乇尺尺のレ
乇尺尺のレ  7 tháng 8 2023 lúc 21:10
7 tháng 8 2023 lúc 21:10 \(n_{O_2}=\dfrac{0,64}{32}=0,02mol\\ 2KNO_3\xrightarrow[]{t^0}2KNO_2+O_2\\ n_{KNO_3\left(lí.thuyết\right)}=0,02.2=0,04mol\\ n_{KNO_3\left(thực.tế\right)}=0,04:80\%=0,05mol\\ m_{KNO_3\left(cần\right)}=0,05.101=5,05g\\ \Rightarrow B\)
Đúng 2 Bình luận (1) Gửi Hủy
Gửi Hủy  Tieen Ddat dax quay trow...
Tieen Ddat dax quay trow...  7 tháng 8 2023 lúc 21:07
7 tháng 8 2023 lúc 21:07 b
Đúng 0 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Khánh Nghiêm
Nung nóng ( kali nitrat )KNO3 tạo thành KNO2 ( Kali nitrit) và khí O2 a) Viết PTHH cho biết thuộc loại phản ứng nào. b) Tính lượng KNO3 cần dùng để điều chế được 1,68 lít O2 ở đktc biết H = 85% c) Tính VO2 ở đktc điều chế được khi phân hủy 10,1 gam KNO3 biết H = 80%
Xem chi tiết Lớp 8 Hóa học 2 0 Gửi Hủy
Gửi Hủy  ๖ۣۜDũ๖ۣۜN๖ۣۜG
๖ۣۜDũ๖ۣۜN๖ۣۜG  21 tháng 1 2022 lúc 16:08
21 tháng 1 2022 lúc 16:08 a) \(2KNO_3\underrightarrow{t^o}2KNO_2+O_2\)
Phản ứng phân hủy
b) \(n_{O_2}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\)
PTHH: 2KNO3 --to--> 2KNO2 + O2
0,15<--------------------0,075
=> \(m_{KNO_3\left(PTHH\right)}=0,15.101=15,15\left(g\right)\)
=> mKNO3 (thực tế) = \(\dfrac{15,15.100}{85}=17,824\left(g\right)\)
c) \(n_{KNO_3\left(pư\right)}=\dfrac{10,1.80\%}{101}=0,08\left(mol\right)\)
=> nO2 = 0,04 (mol)
=> VO2 = 0,04.22,4 = 0,896(l)
Đúng 4 Bình luận (0) Gửi Hủy
Gửi Hủy  Kudo Shinichi
Kudo Shinichi  21 tháng 1 2022 lúc 16:08
21 tháng 1 2022 lúc 16:08 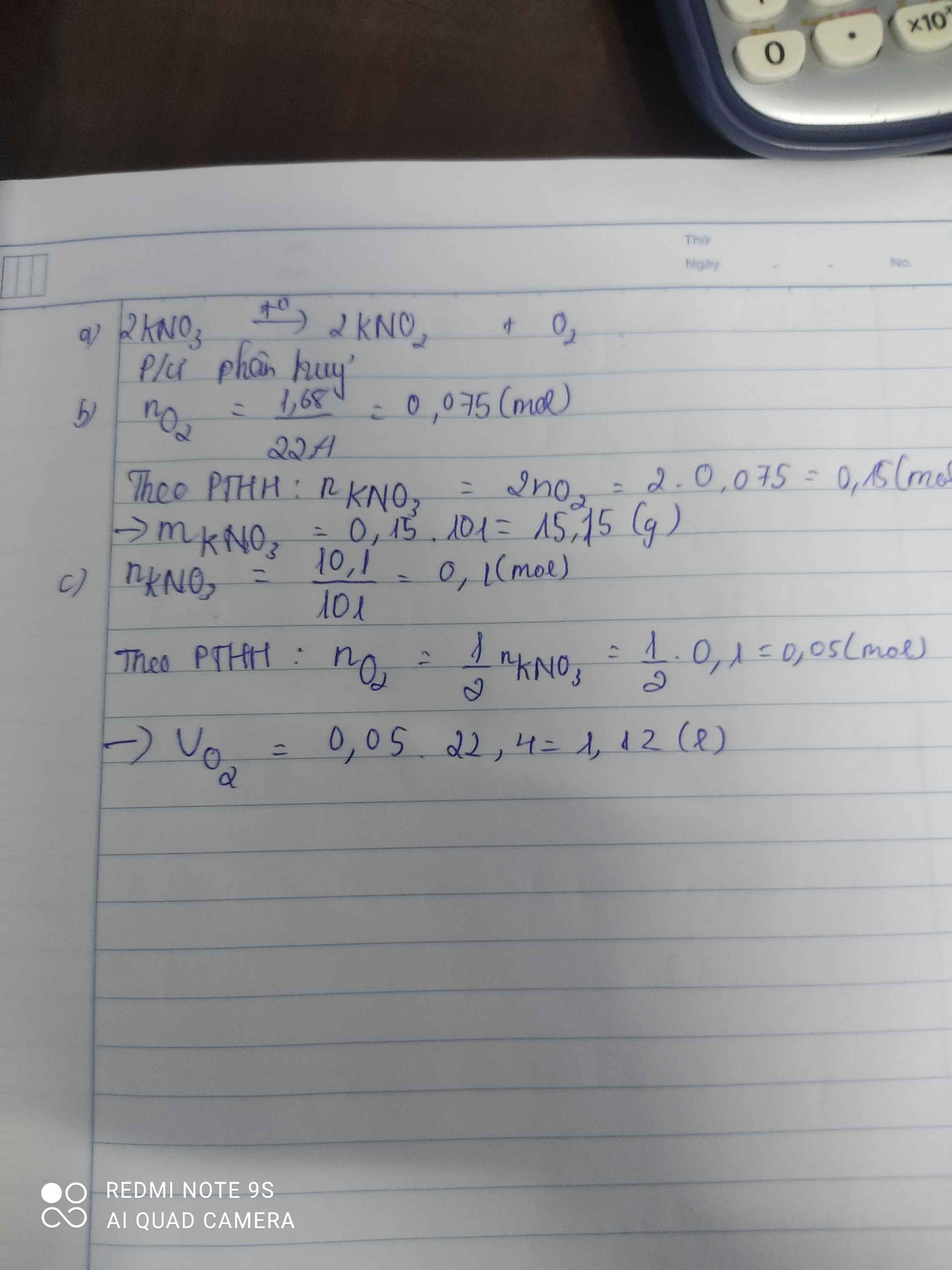
 Gửi Hủy
Gửi Hủy 
- maiizz
Khi nung nóng KNO3 sẽ bị phân hủy thành KNO2 và O2
A, Viết PTHH B, Tính khối lượng KNO2 thu được nếu đem nhiệt phân hoàn toàn 35,35g KNO3.
C, Tình thể tích oxi điều chế được khi nhiệt phân 40,4 g KNO3 . Biết hiệu suất phản ứng là 75%.
Xem chi tiết Lớp 8 Hóa học 2 0 Gửi Hủy
Gửi Hủy  Kudo Shinichi
Kudo Shinichi  23 tháng 2 2022 lúc 17:23
23 tháng 2 2022 lúc 17:23 a) PTHH: 2KNO3 -> (t°) 2KNO2 + O2
b) nKNO3 = 35,35/101 = 0,35 (mol)
nKNO2 = nKNO3 = 0,35 (mol)
mKNO2 = 0,35 . 85 = 29,75 (g)
c) nKNO3 = 40,4/101 = 0,4 (mol)
nO2(LT) = 0,4/2 = 0,2 (mol)
nO2(TT) = 0,2 . 75% = 0,15 (mol)
VO2 = 0,15 . 22,4 = 3,36 (l)
Đúng 2 Bình luận (4) Gửi Hủy
Gửi Hủy  Buddy
Buddy  23 tháng 2 2022 lúc 17:27
23 tháng 2 2022 lúc 17:27 2KNO3-to>2KNO2+O2
0,35-----------0,35 mol
n KNO3=\(\dfrac{35,35}{101}=0,35mol\)
=>m KNO2=0,35.85=29,75g
c)
2KNO3-to>2KNO2+O2
0,4----------------------0,2 mol
n KNO3=\(\dfrac{40,4}{101}\)=0,4 mol
H=75%
=>VO2=0,2.22,4.\(\dfrac{75}{100}\)=3,36l
Đúng 0 Bình luận (2) Gửi Hủy
Gửi Hủy 
- Thiên sứ
Nung nóng kali nitrat \(KNO_3\), chất này bị phân huỷ thành kali nitrit \(KNO_2\) và oxi \(O_2\).
a, Viết phương trình hoá học biểu diễn sự phân huỷ \(KNO_3\).
b, Tính khối lượng \(KNO_3\) cần dùng để điều chế được 2,4g oxi, biết hiệu suất phản ứng đạt \(85\%\) theo lý thuyết.
c, Tính khối lượng khí oxi điều chế được khi phân huỷ 10,1g \(KNO_3\), biết hiệu suất phản ứng đạt \(80\%\) theo lý thuyết.
Giúp với!!
Xem chi tiết Lớp 8 Hóa học Bài 27: Điều chế khí oxi-Phản ứng phân hủy 2 0 Gửi Hủy
Gửi Hủy  Nào Ai Biết 10 tháng 7 2017 lúc 13:55
Nào Ai Biết 10 tháng 7 2017 lúc 13:55 Theo Đề bài ta có :
PTHH :
2KNO3 -----> 2KNO2 + O2
Ta có :
nO2 = 2,4 : 32 = 0,075(mol)
=> nO2(lý Thuyết) = 0,075:85% = 0,088(mol)
=> nKNO3(PU) = 0,088 . 2 = 0,176(mol)
=> mKNO3(PƯ) = 17,78(g)
c)
nKNO3 = 10,1 : (39 + 14 + 48) = 0,1(mol)
=> nKNO3(PƯ) = 0,1 . 80% = 0,08(mol)
=> nO2 = 0,04(mol)
=> mO2 = 0,04 . 32 = 1,28(g)
Đúng 1 Bình luận (1) Gửi Hủy
Gửi Hủy  thuongnguyen
thuongnguyen  10 tháng 7 2017 lúc 13:00
10 tháng 7 2017 lúc 13:00 Theo đề bài ta có : \(nO2=\dfrac{2,4}{16}=0,15\left(mol\right)\)
a) PTHH :
\(2KNO3-^{t0}\rightarrow2KNO2+O2\)
0,3 mol..................................0,15mol
b) Khối lượng của KNO3 cần dùng là : \(mKNO3=\dfrac{\left(0,3.101\right).85}{100}=25,755\left(g\right)\)
c) Theo đề bài ta có : nKNO3 = \(\dfrac{10,1}{101}=0,1\left(mol\right)\)
khối lượng khí oxi điều chế được khi phân huỷ là : \(mO2=\dfrac{\left(0,1.32\right).80}{100}=2,56\left(g\right)\)
Đúng 1 Bình luận (3) Gửi Hủy
Gửi Hủy 
- Nguyễn Thị Hằng
Nung nóng Kali nitrat (KNO3) tạo thành Kali nitrit(KNO2) và oxi.
a. Viết PTHH biểu diễn sự phân hủy.
b. Tính khối lượng KNO3 cần dùng để điều chế được 1,68 lít khí oxi (đktc).Biết hiệu suất phản ứng là 85%
GIÚP MÌNH VỚI NHA
Xem chi tiết Lớp 8 Hóa học CHƯƠNG IV: OXI - KHÔNG KHÍ 1 0 Gửi Hủy
Gửi Hủy  Thảo Phương
Thảo Phương  1 tháng 2 2018 lúc 21:38
1 tháng 2 2018 lúc 21:38 a) PTHH:
2KNO3→2KNO2 + O2
b)\(n_{O_2}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\)Theo PTHH ta có:
nKNO3=2nO2=0,15(mol)
mKNO3 ban đầu=0,15.101=15,15(g)
mKNO3 thực tế=15,15.\(\dfrac{85}{100}\)=12,8775(g)
Đúng 0 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Leopard
Đốt cháy hoàn toàn 5,6g sắt trong bình khí chứa oxi, sản phẩm tạo thành là oxit sắt từ.
a) Viết PTHH xảy ra
b) Tính khối lượng sản phẩm tạo thành
c) Tính khối lượng KMnO4 tối thiểu cần dùng để điều chế lượng oxi trên. Biết hiệu suất phản ứng đạt 85%
Xem chi tiết Lớp 8 Hóa học 1 0 Gửi Hủy
Gửi Hủy  Lê Ng Hải Anh
Lê Ng Hải Anh  7 tháng 3 2023 lúc 20:58
7 tháng 3 2023 lúc 20:58 a, PT: \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
b, Ta có: \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Theo PT: \(n_{Fe_3O_4}=\dfrac{1}{3}n_{Fe}=\dfrac{1}{30}\left(mol\right)\Rightarrow m_{Fe_3O_4}=\dfrac{1}{30}.232\approx7,733\left(g\right)\)
c, Theo PT: \(n_{O_2}=\dfrac{2}{3}n_{Fe}=\dfrac{1}{15}\left(mol\right)\)
PT: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
\(n_{KMnO_4\left(LT\right)}=2n_{O_2}=\dfrac{2}{15}\left(mol\right)\)
\(\Rightarrow m_{KMnO_4\left(LT\right)}=\dfrac{2}{15}.158=\dfrac{316}{15}\left(g\right)\)
Mà: H% = 85%
\(\Rightarrow m_{KMnO_4\left(TT\right)}=\dfrac{\dfrac{316}{15}}{85\%}\approx24,78\left(g\right)\)
Đúng 1 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Kim Taeyeon
khi nung KNO3 theo pt KNO3--------> 2KNO2+O2.
Để điều chế 6,4 g khí O2 thì khối lượng KNO3 cần dùng là bao nhiêu,biết hiệu suất =85%
Xem chi tiết Lớp 8 Hóa học CHƯƠNG III: MOL VÀ TÍNH TOÁN HÓA HỌC 2 0 Gửi Hủy
Gửi Hủy  Hoàng Tuấn Đăng 17 tháng 1 2017 lúc 21:31
Hoàng Tuấn Đăng 17 tháng 1 2017 lúc 21:31 PTHH: 2KNO3 =(nhiệt)=> 2KNO2 + O2
Ta có: nO2 = \(\frac{6,4}{32}=0,2\left(mol\right)\)
=> nKNO3(theo phương trình) = 0,4 (mol)
=> nKNO3(thực tế) = \(0,4\div\frac{85}{100}=\frac{8}{17}\left(mol\right)\)
=> mKNO3(thực tế) = \(\frac{8}{17}\times101=47,53\left(gam\right)\)
Đúng 0 Bình luận (0) Gửi Hủy
Gửi Hủy  Nguyễn Trần Thành Đạt
Nguyễn Trần Thành Đạt  17 tháng 1 2017 lúc 21:45
17 tháng 1 2017 lúc 21:45 Ta có:
\(PTHH:2KNO_3->>2KNO_2+O_2\)
Ta có:
\(n_{O_2}=\frac{m_{O_2}}{M_{O_2}}=\frac{6,4}{32}=0,2\left(mol\right)\)
Theo PTHH và đề bài, ta có:
\(n_{KNO_3}=2.n_{O_2}=2.0,2=0,4\left(mol\right)\)
Theo thực tế, ta được:
\(n_{KNO_3\left(thựctế\right)}=0,4:85\%=\frac{8}{17}\left(mol\right)\)
Khối lượng KNO3 trong thực tế:
\(m_{KNO_3\left(thựctế\right)}=n_{KNO_3}.M_{KNO_3}=\frac{8}{17}.101\approx47,529\left(g\right)\)
Đúng 0 Bình luận (0) Gửi Hủy
Gửi Hủy Từ khóa » điều Chế O2 Từ Kno3
-
KNO3 = KNO2 O2 | Cân Bằng Phương Trình Hóa Học
-
2KNO3 → 2KNO2 + O2 | , Phản ứng Oxi-hoá Khử
-
KNO3 | KNO2 + O2 | Cân Bằng Phương Trình Hóa Học - CungHocVui
-
Phương Trình Hóa Học KNO3 Ra O2 - Trường THPT Trịnh Hoài Đức
-
KNO3 = KNO2 + O2 - Trình Cân Bằng Phản ứng Hoá Học - ChemicalAid
-
KNO3 | KNO2 + O2 | Cân Bằng Phương Trình Hóa Học
-
Nhiệt Phân KNO3
-
Tôi Yêu Hóa Học - Trong Số Các Chất Sau : KNO3, Cu(NO3)2
-
Bài 27: Điều Chế Khí Oxi-Phản ứng Phân Hủy - Hoc24
-
Phương Trình Hóa Học KNO3 Ra O2 - Trường THPT Trịnh Hoài Đức
-
Nung Kno3 Chất Này Phân Huỷ Thành Kno2 Và O2 A) Viết ...
-
Top 15 Cân Bằng Kno3 2022