Oxy Difluoride – Wikipedia Tiếng Việt
Có thể bạn quan tâm
Nội dung
chuyển sang thanh bên ẩn- Đầu
- Bài viết
- Thảo luận
- Đọc
- Sửa đổi
- Sửa mã nguồn
- Xem lịch sử
- Đọc
- Sửa đổi
- Sửa mã nguồn
- Xem lịch sử
- Các liên kết đến đây
- Thay đổi liên quan
- Liên kết thường trực
- Thông tin trang
- Trích dẫn trang này
- Tạo URL rút gọn
- Tạo một quyển sách
- Tải dưới dạng PDF
- Bản để in ra
- Wikimedia Commons
- Khoản mục Wikidata
| Oxy difluoride | |
|---|---|
 Mô hình 2D Mô hình 2D | |
 Mô hình 3D Mô hình 3D | |
| Tên khác | Monoxy difluoridehypofluorơ anhydride |
| Nhận dạng | |
| Số CAS | 7783-41-7 |
| PubChem | 24547 |
| Số EINECS | 231-996-7 |
| ChEBI | 30494 |
| Số RTECS | RS2100000 |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| ChemSpider | 22953 |
| Thuộc tính | |
| Công thức phân tử | OF2 |
| Khối lượng mol | 53,9962 g/mol |
| Bề ngoài | khí không màu, chất lỏng vàng nhạt khi làm lạnh |
| Mùi | hôi |
| Khối lượng riêng | 1,9 g/cm³ (-224 ℃, chất lỏng)1,719 g/cm³ (-183 ℃, chất lỏng)1,521 g/cm³ (-145 ℃, chất lỏng)1,88 g/L (chất khí) |
| Điểm nóng chảy | −223,8 °C (49,3 K; −370,8 °F) |
| Điểm sôi | −144,75 °C (128,40 K; −228,55 °F) |
| Độ hòa tan trong nước | thủy phân[1] |
| Nhiệt hóa học | |
| Enthalpyhình thành ΔfHo298 | 24,5 kJ mol-1 |
| Entropy mol tiêu chuẩn So298 | 246,98 J/mol K |
| Nhiệt dung | 43,3 J/mol K |
| Các hợp chất liên quan | |
| Hợp chất liên quan | HFOO2F2NHF2NF3SCl2 |
| Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
| Bài viết này cần thêm chú thích nguồn gốc để kiểm chứng thông tin. Mời bạn giúp hoàn thiện bài viết này bằng cách bổ sung chú thích tới các nguồn đáng tin cậy. Các nội dung không có nguồn có thể bị nghi ngờ và xóa bỏ. (Tìm hiểu cách thức và thời điểm xóa thông báo này) |
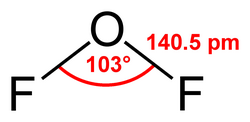
Oxy difluoride là một hợp chất vô cơ có công thức hóa học OF2, là một chất khí không màu có mùi gần giống với ozone, rất độc. OF2 có hình dạng phân tử như nước (hình chữ V), là một chất có tính oxy hóa mạnh. Mặc dầu nó là nguyên tố có chứa oxy và nguyên tố khác (fluorine), nhưng không được coi là một oxide, vì độ âm điện của fluorine lớn hơn độ âm điện của oxy, số oxy hoá của oxy trong trường hợp này là +2 thay vì -2 trong các oxide.[2]
Lịch sử
[sửa | sửa mã nguồn]Oxy difluoride được phát hiện lần đầu tiên vào năm 1929 bằng cách cho fluor phản ứng với NaOH loãng 2% lạnh:
2F2 + 2NaOH → OF2↑ + 2NaF + H2OTính chất hóa học
[sửa | sửa mã nguồn]Oxy difluoride là một chất khí có tính oxy hóa mạnh. Trên 200 °C (392 °F; 473 K), OF2 bị phân hủy thành O2 và F2:
2OF2 → O2↑ + 2F2↑Phản ứng với nước
[sửa | sửa mã nguồn]- Oxy difluoride phản ứng rất chậm với nước tạo thành acid hydrofluoric:
- Oxy difluoride còn phản ứng với hơi nước ở 250 °C (482 °F; 523 K) tạo thành oxy và hydro fluoride:
Phản ứng với kim loại và phi kim
[sửa | sửa mã nguồn]- OF2 phản ứng với nhiều kim loại và phi kim tạo thành oxide và fluoride:
- Phản ứng với phosphorus tạo thành PF5 và POF3;
- Phản ứng với lưu huỳnh cho SF4 và SO2;
- OF2 còn phản ứng với khí trơ, như xenon ở nhiệt độ cao cho XeF4.
Phản ứng với hợp chất
[sửa | sửa mã nguồn]- Oxy difluoride oxy hóa lưu huỳnh dioxide thành lưu huỳnh trioxide và fluorine:
- Ngoài ra dưới tác động của tia cực tím UV OF2 còn phản ứng với SO2 tạo thành SO2F2 và S2O5F2:
An toàn
[sửa | sửa mã nguồn]OF2 là một chất độc, cần phải cẩn thận khi tiếp xúc với nó.
Tham khảo
[sửa | sửa mã nguồn]- ^ http://www.chemyq.com/En/xz/xz1/2818mqnrv.htm
- ^ Doubtnut. "OF_(2) should be called oxygen difluolide and not fluorine oxide -". doubtnut (bằng tiếng Anh). Truy cập ngày 27 tháng 2 năm 2022.
Liên kết ngoài
[sửa | sửa mã nguồn]- Thư viện y học quốc gia Hoa Kỳ -NIH
| |
|---|---|
| Hợp chất hainguyên tố |
|
| Khác |
|
| |
Bài viết liên quan đến hóa học này vẫn còn sơ khai. Bạn có thể giúp Wikipedia mở rộng nội dung để bài được hoàn chỉnh hơn. |
- x
- t
- s
- Sơ khai hóa học
- Hóa chất
- Hợp chất oxy
- Hợp chất fluor
- Hợp chất halogen của phi kim
- Nguồn CS1 tiếng Anh (en)
- Trang thiếu chú thích trong bài
- Tất cả bài viết sơ khai
Từ khóa » Công Thức Cấu Tạo F2o
-
Bài Giảng Hóa Học 11 - Tiết 27,28. Bài 17: Liên Kết Cộng Hóa Trị
-
Viết Công Thức Electron Và Công Thức Cấu Tạo Của F2O - Xây Nhà
-
Thông Tin Cụ Thể Về F2O (Flo Monoxit) - Chất Hóa Học - CungHocVui
-
F2O - Flo Monoxit - Chất Hoá Học - Từ Điển Phương Trình Hóa Học
-
F2o = Hcl.h2o Phương Trình Hóa Học Không Tồn Tại để Cân Bằng
-
Giải Thích Liên Kết Hoá Học Trong Phân Tử F2O? - Phương Quang Hồ
-
Cách Viết Công Thức Cấu Tạo Của Các Phân Tử
-
Hãy Viết Công Thức Electron Và Công Thức Cấu Tạo Của Các Phân Tử ...
-
Bài Tập Sự Hình Thành Liên Kết Cộng Hóa Trị - Tài Liệu Text - 123doc
-
Cấu Tạo Nguyên Tử - Hóa Học 10 - Nguyễn Văn Thành
-
Cách Viết Công Thức Cấu Tạo Của Các Phân Tử Và Viết Công Thức Cấu ...
-
Liên Kết Hóa Học - Tài Liệu, Ebook, Giáo Trình
-
Viết Công Thức Electron Và Công Thức Cấu Tạo Của Chất (Luyện Tập ...